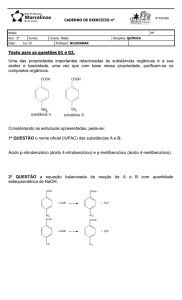
Interbits – SuperPro ® Web
1. O gás hidrogênio (H2) é uma excelente alternativa para substituir combustíveis de origem
fóssil ou qualquer outro que produza CO2. Uma forma bastante simples de produzir gás
hidrogênio em pequena escala é adicionando alumínio a ácido clorídrico, de acordo com a
equação a seguir:
j A q HC
xA C
3
y H2
Após o balanceamento correto, a soma dos menores coeficientes estequiométricos inteiros j, q,
x e y será:
a) 4.
b) 9.
c) 11.
d) 13.
e) 15.
2. Uma das etapas do processo de obtenção do metal zinco envolve o aquecimento do
mineral esfalerita, ZnS, em presença de oxigênio do ar. A equação química, não balanceada,
que representa essa transformação é:
....... ZnS s ....... O2 g ....... ZnO s ....... SO2 g
Nessa equação, se o coeficiente estequiométrico da esfalerita for 2, os coeficientes
estequiométricos do oxigênio, do óxido de zinco e do dióxido de enxofre serão,
respectivamente,
a) 2, 2 e 2.
b) 2, 2 e 3.
c) 2, 3 e 3.
d) 3, 2 e 2.
e) 3, 3 e 3.
3. O ácido fluorídrico é utilizado para a gravação em vidros, porque ele reage com o dióxido
de silício, conforme a equação química não balanceada representada abaixo.
HF aq SiO2 s SiF4 aq H2O( )
No processo de gravação de vidros, a soma dos menores coeficientes estequiométricos
inteiros que balanceiam a equação química é de
a) 8.
b) 7.
c) 6.
d) 5.
e) 4.
4. O aço-liga, também chamado de aço especial, é uma liga de ferro-carbono com elementos
de adição como o manganês, o tungstênio, o silício, o cobalto e o alumínio para conferir a esse
aço características especiais, tais como: resistência à tração e à corrosão, elasticidade e
dureza, entre outras, tornando-os melhores do que aços-carbono comuns.
Dos elementos de adição, acima citados, aquele que possui mesmo número de níveis de
energia que o manganês e é considerado metal de transição externa é o
a) W
b) Si
c) Co
d) A
5. Um professor, utilizando comprimidos de antiácido efervescente à base de NaHCO 3,
Página 1 de 6
Interbits – SuperPro ® Web
realizou quatro procedimentos, ilustrados a seguir:
Procedimento I – Comprimido inteiro e água a 25°C
Procedimento II – Comprimido inteiro e água a 5°C
Procedimento III – Comprimido pulverizado e água a 25°C
Procedimento IV – Comprimido pulverizado e água a 5°C
A reação ocorreu mais rapidamente no procedimento
a) I.
b) II.
c) III.
d) IV.
6. Um dos grandes problemas ambientais na atualidade relaciona-se com o desaparecimento
da camada de ozônio na atmosfera. É importante notar que, quando desaparece o gás ozônio,
aparece imediatamente o gás oxigênio de acordo com a equação abaixo:
hv
2O3 g
3O2 g
Considerando a velocidade de aparecimento de O2 igual a 12 mol L s, a velocidade de
desaparecimento do ozônio na atmosfera em mol L s é:
a) 12
b) 8
c) 6
d) 4
e) 2
7. Se um comprimido efervescente que contém ácido cítrico e carbonato de sódio for colocado
em um copo com água, e mantiver-se o copo aberto, observa-se a dissolução do comprimido
acompanhada pela liberação de um gás. Assinale a alternativa correta sobre esse fenômeno.
a) A massa do sistema se manterá inalterada durante a dissolução.
b) A velocidade de liberação das bolhas aumenta com a elevação da temperatura da água.
c) Se o comprimido for pulverizado, a velocidade de dissolução será mais lenta.
d) O gás liberado é o oxigênio molecular.
e) O fenômeno corresponde a um processo físico.
8. A reação de decomposição do peróxido de hidrogênio, bem como vários processos
industriais, podem ser catalisados pela presença de metais. O gráfico representa o perfil da
energia envolvida e o caminho da reação para um processo A + B C + D, sem e com
catalisador.
Página 2 de 6
Interbits – SuperPro ® Web
A curva ___________ é a da reação com catalisador.
Na ausência de catalisador, a energia de ativação da reação inversa (C + D A + B)
___________ é que a da reação direta.
A reação direta (A + B C + D) é __________________.
As lacunas são correta e respectivamente preenchidas por
a) I ... maior ... endotérmica
b) I ... maior ... exotérmica
c) II ... maior ... endotérmica
d) II ... maior ... exotérmica
e) II ... menor ... exotérmica
09. Colocamos um pedaço de palha de aço em cima de uma pia e a seu lado um prego de
mesma massa. Notamos que a palha de aço enferruja com relativa rapidez enquanto que o
prego, nas mesmas condições, enferrujará mais lentamente. Os dois materiais têm
praticamente a mesma composição, mas enferrujam com velocidades diferentes. Isso ocorre
devido a um fator que influencia na velocidade dessa reação, que é:
a) temperatura.
b) concentração dos reagentes.
c) pressão no sistema.
d) superfície de contato.
e) presença de catalisadores.
10. Dada a reação não balanceada H2 O2 H2O, é correto afirmar-se que a massa de
água produzida na queima de 40 kg de hidrogênio e a massa de oxigênio consumidos na
reação são, respectivamente,
(Dados: 11H; 168 O)
a) 320 kg e 360 kg.
b) 360 kg e 320 kg.
c) 360 kg e 80 kg.
d) 320 kg e 80 kg.
e) 160 kg e 80 kg.
11. O Óxido de lítio pode ser preparado segundo a reação expressa pela seguinte equação
química:
4Li(s) O2(g) 2Li2O(s)
Qual será a quantidade de Li2O produzida em gramas partindo-se de 14 g de lítio sólido?
a) 30
b) 20
c) 16
Página 3 de 6
Interbits – SuperPro ® Web
d) 10
12. No jornal Folha de São Paulo, de 14 de junho de 2013, foi publicada uma reportagem
sobre o ataque com armas químicas na Síria “[...] O gás sarin é inodoro e invisível. Além da
inalação, o simples contato com a pele deste gás organofosforado afeta o sistema nervoso e
provoca a morte por parada cardiorrespiratória. A dose letal para um adulto é de meio
miligrama. […]”.
Baseado nas informações fornecidas e nos conceitos químicos, quantas moléculas
aproximadamente existem em uma dose letal de gás sarin aproximadamente?
Dado: Considere que a massa molar do gás sarin seja 140 g/mol. Constante de Avogadro:
6 10 23 entidades.
a) 1,68 1026 moléculas.
b) 3,00 1023 moléculas.
c) 2,14 1021 moléculas.
d) 2,14 1018 moléculas.
13. Os camelos armazenam em suas corcovas gordura sob a forma de triestearina
C57H110O6 . Quando essa gordura é metabolizada, ela serve como fonte de energia e água
para o animal. Esse processo pode ser simplificadamente representado pela seguinte equação
química balanceada:
2C57H110O6 s 163O2 g 114CO2 g 110H2O( )
A massa de água que pode ser obtida a partir da metabolização de 1 mol de triestearina é de
Dado: Considere que o rendimento da reação seja de 100%.
a) 55g.
b) 110g.
c) 890g.
d) 990g.
e) 1kg.
14. Fitas de magnésio podem ser queimadas quando em contato com fogo e na presença de
gás oxigênio. Durante a reação, pode-se observar a formação de um sólido branco e a
liberação de uma luz intensa.
Suponha que uma fita de magnésio de 3 g, com 80% de pureza em massa, seja queimada.
A massa aproximada, em gramas, do sólido branco será igual a
a) 3.
b) 4.
c) 5.
d) 6.
15. Quando o ácido clorídrico, conhecido popularmente como ácido muriático, entra em
contato com objetos de ferro, ocorre uma reação de simples troca. Nesse caso, forma-se
hidrogênio gasoso e cloreto de ferro II, conforme reação abaixo.
HC
(aq)
Fe(s) H2(g) FeC
2(aq)
A quantidade de ácido muriático, em gramas, necessária para produção de 56 L de H2 , nas
CNTP, é aproximadamente igual a
Página 4 de 6
Interbits – SuperPro ® Web
a)
b)
c)
d)
56
91
182
238
16. Os refrigerantes são formados por uma mistura de água, gás carbônico e algum tipo de
xarope, que dá a cor e o gosto da bebida. Mas essas três coisas não são combinadas de uma
vez – primeiro, os fabricantes juntam a água e o gás, em um aparelho chamado carbonizador.
Quando esses dois ingredientes se misturam, a água dissolve o CO2 , dando origem a uma
terceira substância, o ácido carbônico, que tem forma líquida. Depois, acrescenta-se o xarope
a esse ácido. O último passo é inserir uma dose extra de CO2 dentro da embalagem para
aumentar a pressão interna e conservar a bebida.
(Disponível em: http://mundoestranho.abril.com.br/materia/como-se-coloca-o-gas-nosrefrigerantes.)
Com relação ao gás dos refrigerantes, é correto afirmar que
a) diminui, se aumentar a pressão.
b) está completamente dissolvido no líquido.
c) escapa mais facilmente do refrigerante quente.
d) escapa mais facilmente do refrigerante gelado.
17. Em alguns casos, há necessidade de coletar-se o produto de uma reação sob a água para
evitar que ele escape e misture-se com o ar atmosférico. Uma amostra de 500 mL de oxigênio
foi coletada sob a água a 23C e pressão de 1 atm. Sabendo-se que a pressão de vapor da
água a 23C é 0,028 atm, o volume que o O2 seco ocupará naquelas condições de
temperatura e pressão será
a) 243,0 mL.
b) 486,0 mL.
c) 364,5 mL.
d) 729,0 mL.
18. Considere a reação representada pela equação química
NH3(g) H2(g) N2(g)
que não se encontra balanceada. Ao ser decomposto 1,7 105 g de gás amônia, em um
processo cujo rendimento global seja de 100%, é correto afirmar que o volume total dos gases
produzidos nas CNTP é de:
Dados: massas molares (g mol1) H 1 e N 14, volume molar nas CNTP
(L mol1) 22,4.
a) 6,00 105 L
b) 4,48 105 L
c) 3,36 105 L
d) 2,24 105 L
e) 1,12 105 L
Página 5 de 6
Interbits – SuperPro ® Web
19. O metano, CH4 , é formado nos aterros sanitários pela ação de certas bactérias em
matéria orgânica queimada. Uma amostra de metano, coletada em um aterro, tem volume de
250 mL a 750 Torr e 27 C. (R 0,0821L atm K 1 mol1)
A quantidade de metano presente na amostra é:
a) 22 102 g
b) 25 102 g
c) 19 102 g
d) 16 102 g
e) 30 102 g
20. Em dois recipientes, ligados por uma válvula, foram colocados dois gases à temperatura
de 25°C. Em um dos recipientes foram colocados 3 L de gás oxigênio (O 2) a uma pressao de 1
atm, no outro recipiente 1 L de gás Hélio (He) e 2 atm de pressão. Abrindo a válvula, os dois
gases se misturam. Sabendo-se que a temperatura permanece a mesma, a pressão parcial do
oxigênio é de, aproximadamente,
a) 1,25 atm.
b) 0,597 atm.
c) 0,12 atm.
d) 0,081 atm.
21. Uma amostra de cerâmica deve ser analisada para se verificar o teor de carbonato
presente que afeta a qualidade do material. Uma cerâmica constituída por uma mistura de
óxidos estáveis à temperatura elevada contém uma quantidade de carbonato de cálcio que foi
determinada por gravimetria. Para tal, 200,00 g de cerâmica pulverizada e seca foram
aquecidas a 1000C de forma a decompor o carbonato de cálcio, produzindo gás CO2 . A
massa da cerâmica, após o tratamento térmico, foi igual a 191,20 g.
Dado: MCaCO 100 g mol1
3
MCO2 44 g mol1
a) Escreva a equação da reação de decomposição do carbonato de cálcio.
b) Calcule o teor (em valores percentuais) do carbonato de cálcio na cerâmica.
22. Para as equações químicas a seguir, verifique se as mesmas estão equilibradas:
a) 3H2SO4 + 2Aℓ Aℓ2(SO4)3 + 3H2
b) KOH + HCN KCN + H2O
c) Fe(OH)2 + H3PO4 Fe3(PO4)2 + H2O
Página 6 de 6