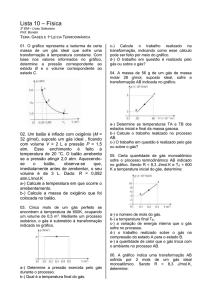
QUÍMICA
2° ANO
ENSINO MÉDIO
PROF.ª DARLINDA MONTEIRO
PROF.ª YARA GRAÇA
CONTEÚDOS E HABILIDADES
Unidade IV
Ser humano e saúde
2
CONTEÚDOS E HABILIDADES
Aula 21.2
Conteúdo
•• Estudo dos gases
3
CONTEÚDOS E HABILIDADES
Habilidades
Relacionar informações representadas em diferentes
formas e conhecimentos, disponíveis em situações
concretas para construir argumentação consistente.
4
REVISÃO
Estudo dos Gases
Características dos Gases
•• Possuem forma e volume
indefinidos;
•• Formam misturas homogêneas;
•• Possuem alta compressibilidade
devido ao grande espaçamento
entre moléculas;
•• Possuem baixa densidade.
5
DESAFIO DO DIA
Faça um acróstico com a palavra GASES utilizando os
conceitos da aula de hoje.
6
AULA
Equação geral dos Gases
Um gás pode passar por três tipos de variáveis de estado:
quanto ao seu volume, quanto à temperatura e quanto
à pressão. Essas alterações são conhecidas como
transformação isobárica, isovolumétrica e isotérmica. A
partir dessas três transformações gasosas é que se chegou
à equação:
P1V1
T1
=
P2V2
T2
7
AULA
Equação geral dos Gases
•• Essa é conhecida como a equação geral dos gases, que
aborda as três variáveis de estado (P, V e T).
•• A equação geral nos permite calcular, por exemplo,
o volume de um gás que passou por alterações de
temperatura e pressão.
8
AULA
Um objeto prático que nos ajuda a entender a aplicação
deste princípio: as latas de aerossóis. Os rótulos
aconselham a não deixar esse tipo de recipiente em
ambientes quentes ou expostos ao fogo, sabe por quê?
9
AULA
Observando a equação geral dos gases:
P1V1
T1
=
P2V2
T2
Podemos perceber que P, T, V são grandezas proporcionais,
ou seja, o aumento de um incute no aumento de outro.
10
AULA
Considerando a presença do gás dentro do recipiente, e
que altas temperaturas provocam aumento excessivo da
pressão, o que acontece então quando aquecemos uma lata
de spray?
Ela explode na presença de altas temperaturas. O aumento
da pressão exercida pelo gás, ocasionada pelo aumento da
temperatura absoluta, explode a lata.
11
AULA
Gás ideal e Gás Real
Interações
Intermoleculares
12
AULA
Equação dos gases perfeitos
O francês Paul Clapeyron, no século XIX, constatou que
para 1 mol (6,02 . 1023 moléculas) de um gás perfeito:
p.V
T
= 0,082
atm . L
mol . K
= 62,3
mmHg . L
mol . K
13
AULA
Este valor obtido é chamado de “constante universal dos
gases perfeitos” e é simbolizado por R.
E se a amostra do gás tiver n mols, então:
p.V
T
= n.R
ou
p.V = n . R . T
Essa equação é chamada de Lei geral dos gases perfeitos
ou Equação de Clapeyron.
14
AULA
Aplicação Equação geral dos gases
(Estácio-RJ) Um volume de 10 L de um gás perfeito teve
sua pressão aumentada de 1 para 2 atm e sua temperatura
aumentada de -73 °C para +127 °C. O volume final, em
litros, alcançado pelo gás foi de:
a) 50
b) 40
c) 30
d) 10
e) 20
15
AULA
Aplicação Equação dos gases perfeitos ou ideais
Determine o número de mols de um gás que ocupa volume
de 90 litros. Este gás está a uma pressão de 2 atm e a uma
atm
.
L
temperatura de 100 K. (Dado: R = 0,082
)
mol . K
16
DINÂMICA LOCAL INTERATIVA
1. Determine o volume ocupado por 1 mol de substância
gasosa a 10 atm de pressão e 25 ºC.
a) 22,4 L
b) 2,44 L
c) 20,5 L
d) 0,205 L
e) 244,36 L
17
RESUMO DO DIA
Gases
•• Um dos estados físicos da matéria, com mais energia.
•• Não possui forma nem volume definido.
•• Apresenta uma estrutura desorganizada.
•• É considerado um fluido por suas propriedades de
compressibilidade e expansibilidade.
18
RESUMO DO DIA
Propriedades do Ar e dos
Gases
19
RESUMO DO DIA
Equação dos gases perfeitos
PV = nRT
P = Pressão final.
V = Volume final.
n = Número de mols do gás.
T = Temperatura.
R = Constante universal dos gases ideias.
20
RESUMO DO DIA
Equação dos gases perfeitos
Com: R = 0,082
atm . L
mol . K
ou R = 62,3
mmHg . L
mol . K
21
DESAFIO DO DIA
1. Observe a figura:
22
DESAFIO DO DIA
2. Faça um acróstico com a palavra GASES utilizando os
conceitos da aula de hoje.
23