Data
___/___/2012
DNA
[email protected]
Tá com Dúvida? Faça DNA
Série:
Professor:
Aluno (a)
Disciplina:
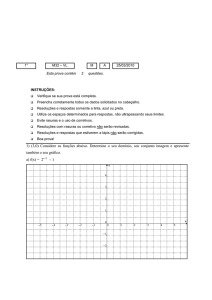
01) Uma criança encontra uma mola em repouso, pendurada no teto da garagem de sua casa.
Resolve então prender nesta mola um objeto, sustentando-o inicialmente com a mão. Ao soltálo, verifica que esse objeto desce 50 cm em 1 s, quando então volta a subir, passando a
executar um MHS, com amplitude e período dados respectivamente por
a) 1 m e 1 s
b) 50 cm e 1 s
c) 25 cm e 2 s
d) 1 m e 2 s
e) 25 cm e 1 s
02) Das afirmativas a seguir:
I. Todo movimento periódico é um movimento harmônico simples
II. No movimento harmônico simples, a aceleração é proporcional ao deslocamento e tem
sentido oposto
III. O período de oscilação de um pêndulo simples, cujo movimento se realiza nas vizinhanças
do equilíbrio estável, é proporcional ao comprimento do pêndulo.
Está(ão) correta(s):
a) apenas I e II
b) apenas I e III
c) somente II
d) somente III
03) Uma massa M executa um movimento harmônico simples entre as posições x = - A e x = A,
conforme representa a figura. Qual das alternativas refere-se corretamente aos módulos e aos
sentidos das grandezas velocidade e aceleração da massa M na posição x = - A?
a) A velocidade é nula; a aceleração é nula.
b) A velocidade é máxima e aponta para a direita; a aceleração é nula.
c) A velocidade é nula; a aceleração é máxima e aponta para a direita.
d) A velocidade é nula; a aceleração é máxima e aponta para a esquerda.
e) A velocidade é máxima e aponta para a esquerda; a aceleração é máxima e aponta para a
direita.
04) O período do Movimento Harmônico Simples (MHS) de um sistema massa-mola:
a) depende da massa do ponto material em movimento.
b) depende da amplitude de oscilação.
c) independe da massa do ponto material.
d) independe da constante elástica.
e) independe da frequência de oscilação.
Para quem faz DNA, a seleção é natural!
05) Um corpo de 0,1 kg, preso a uma mola ideal de rigidez elástica 200 N/m, oscila em MHS de
amplitude 0,2 m. A velocidade do corpo, quando sua energia cinética é igual ao dobro da
energia potencial, é, em m/s:
a) 12
b) 10
c) 8
d) 6
e) 4
06) Adotando-se os valores log 2 = 0,30 e log 3 = 0,48, a raiz da equação 5x = 60 vale
aproximadamente:
a) 2,15
b) 2,28
c) 41
d) 2,54
e) 2,67
07) O valor de x que satisfaz a equação log3(x−2) + log3(x−4) =1 é igual a:
a) 2
b) 1
c) 5
d) 4
e) 0
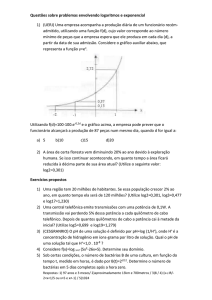
08) A figura mostra o esboço do gráfico da função y = loga(x+b). A área do retângulo assinalado é
a) 1
b) 1/2
c) ¾
d) 2
e) 4/3
09) Determine a solução da equação:
log 2 x 2 log 2 x 3 1 log 2 2x 7
10) Os valores de x que satisfazem log x + log (x - 5) = log 36 são:
a) 9 e -4
b) 9 e 4
c) -4
d) 9
e) 5 e -4
11) A temperatura normal de ebulição do 1-propanol, CH3CH2CH2OH, é 97,2 ºC, enquanto o
composto metoxietano, CH3CH2OCH3, de mesma composição química, entra em ebulição
normal em 7,4 ºC.
Assinale a alternativa que é compatível com esta observação experimental.
a) O mais elevado ponto de ebulição do 1-propanol deve-se principalmente às ligações de
hidrogênio.
Para quem faz DNA, a seleção é natural!
b) O 1-propanol e o metoxietano ocorrem no estado líquido, à temperatura ambiente.
c) Geralmente, os álcoois são mais voláteis do que os éteres, por dissociarem mais facilmente
o íon H+.
d) Em valores de temperatura abaixo de 7,4 ºC, a pressão de vapor do metoxietano é maior do
que a pressão atmosférica.
e) Em valores de temperatura entre 7,4 e 96 ºC, a pressão de vapor do 1-propanol é sempre
maior do que a de igual quantidade do metoxietano.
12) As ligações intermoleculares por pontes de hidrogênio é uma interação dipolo-dipolo
exageradamente alta sendo responsável por alto ponto de ebulição para alguns compostos.
Dos compostos abaixo relacionados, o que não apresenta este tipo de interação, está
relacionada na alternativa ?
a) H3COH
b) NH3
c) H3C - CH2 - OH
d) HF
e) H3C - COOH
13) Considere a distribuição energética crescente, pelos orbitais, dos elétrons de um átomo
representativo de elemento de número atômico 26. O último elétron distribuído terá o número
quântico magnético igual a zero
a) -1
b) -2
c) +1
d) +2
14) Leia as declarações abaixo e, em seguida, assinale a alternativa que apresenta as declarações
corretas:
l. A eletronegatividade não existe como propriedade do elemento químico isolado: ocorre a
partir da relação entre os átomos dos elementos quando os mesmos se ligam.
2. O primeiro potencial de ionização é a energia liberada quando se retira o elétron de maior
energia de um átomo gasoso em seu estado fundamental.
3. Os elementos químicos de configuração eletrônica 1s22s22p63s1e 1s22s22p63s23p64s1
apresentam baixa energia de ionização.
4. Em um período, considerando-se os elementos representativos, quanto maior a carga
nuclear, menor o raio atômico.
a) 1, 3 e 4
b) 1, 2 e 3
c) 1, 2 e 4
d) 2, 3 e 4
e) 1, 2 e 4
15) O princípio de Exclusão de Pauli estabelece que:
a) A posição e a velocidade de um elétron não podem ser determinadas simultaneamente.
b) Elétrons em orbitais atômicos possuem spins paralelos.
c) A velocidade de toda radiação eletromagnética é igual à velocidade da luz.
d) Dois elétrons em um mesmo átomo não podem apresentar os quatro números quânticos
iguais.
e) Numa dada subcamada que contém mais de um orbital, os elétrons são distribuídos sobre os
orbitais disponíveis, com seus spins na mesma direção.
Para quem faz DNA, a seleção é natural!