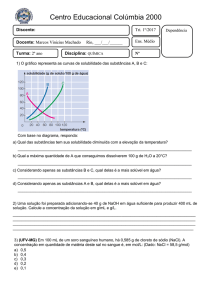
COLÉGIO EUCARÍSTICO
Fixando o Conteúdo
2° Bimestre
1. Considere as informações:
I) A + B → C + D
∆Hº = - 10,0 kcal
II) C + D → E
∆Hº = +15,0 kcal
Calcule o ∆H° para cada uma das reações a seguir:
a) C + D → A + B
b) 2C + 2D → 2A + 2B
c) A + B → E
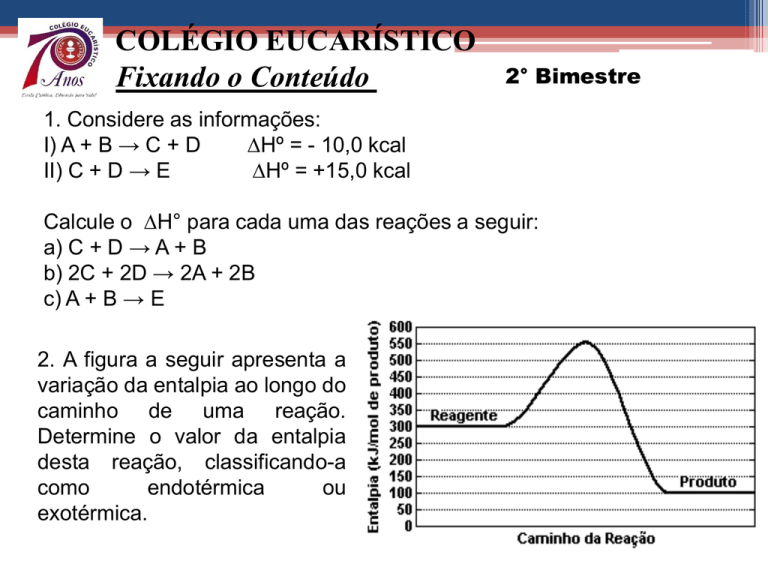
2. A figura a seguir apresenta a
variação da entalpia ao longo do
caminho de uma reação.
Determine o valor da entalpia
desta reação, classificando-a
como
endotérmica
ou
exotérmica.
3. Verifica-se em laboratório que a preparação de uma solução aquosa
de H2SO4 por adição deste à água, causa um aumento na temperatura
da solução quando comparada com a temperatura original do solvente.
Trata-se, portanto, de um processo:
a) endotérmico
d) sem variação de energia
b) exotérmico
e) sem variação de entalpia
c) isotérmico
4. Dadas as reações
I. H2 (g) + 1/2 O2 (g) → H2O (g)
II. H2O (g) → H2 (g) + 1/2 O2 (g)
∆H = - 68,3 kcal/mol
∆H = + 68,3 kcal/mol
podemos afirmar que
a) a reação II é exotérmica e a I é endotérmica.
b) a reação I é exotérmica e a II é endotérmica.
c) as duas reações são exotérmicas.
d) as duas reações são endotérmicas.
e) as duas reações liberam calor.
5. A oxidação de açúcares no corpo humano produz ao redor
de 4,0 quilocalorias por grama de açúcar oxidado. A oxidação
de um décimo de mol de glicose (C6H12O6) vai produzir
aproximadamente:
Massas atômicas: H = 1,0; C = 12; O = 16
a) 40 kcal
b) 50 kcal
c) 60 kcal
d) 70 kcal
e) 80 kcal
6. A queima de 4,0 kg de metano (CH4) liberou 53.200 kcal. O
calor de combustão de um mol de metano é igual a:
Dada
a massa molar do metano: 16 g/mol.
a) 13.300 kcal.
b) 0,66 kcal.
c) 212,8 kcal.
d) 13,3 kcal.
e) 212.800 kcal.
7. NH3(g) + HCl (g) → NH4Cl(s)
A variação de entalpia em kJ/mol e o tipo
de reação equacionada acima são:
a) - 454,0 kJ/mol e reação exotérmica.
b) - 177,0 kJ/mol e reação exotérmica.
c) + 138,5 kJ/mol e reação endotérmica.
d) + 177,0 kJ/mol e reação endotérmica.
e) + 454,0 kJ/mol e reação endotérmica.
8. Dada a reação termoquímica 3/2 O2(g) → O3(g) ∆H = +142,3 kJ/mol
é possível afirmar que na formação de 96g de ozônio o calor da reação,
em kJ, será
a) +71,15
c) +142,3
e) -284,6
b) +284,6
d) -142,3
9. O ∆H° da reação Cu2O(s) + 1/2 O2(g) → 2 CuO(s) a 25°C é 146,8kJ/mol. Sabendo-se que o calor de formação (∆H°f) do óxido de
cobre (II) é -157,2kJ/mol, o valor do ∆H°f do óxido de cobre (I) é, em
kJ/mol,
a) -10,4.
d) -324,8.
b) -167,6.
e) 324,8.
c) 167,6.
10. Ao se sair molhado em local aberto, mesmo em dias quentes, sente-se
uma sensação de frio. Esse fenômeno está relacionado com a evaporação
da água que, no caso, está em contato com o corpo humano.
Essa sensação de frio explica-se CORRETAMENTE pelo fato de que a
evaporação da água
a) é um processo endotérmico e cede calor ao corpo.
b) é um processo endotérmico e retira calor do corpo.
c) é um processo exotérmico e cede calor ao corpo.
d) é um processo exotérmico e retira calor do corpo.
11. Observe a reação, nas condições padrão, e marque a alternativa que
responde corretamente à pergunta abaixo.
H2(g) + F2 (g) → 2HF(g); ∆H = - 5,4 kcal
Qual o calor de formação do HF e o tipo da reação representada acima?
a) + 5,4 kcal/mol; reação endotérmica
b) - 2,7 kcal/mol; reação exotérmica
c) + 2,7 kcal/mol; reação exotérmica
d) - 5,4 kcal/mol; reação endotérmica
e) + 7,0 kcal/mol; reação exotérmica
12. Considere as seguintes equações termoquímicas hipotéticas:
A+ B → C
∆H = -20,5 kcal
D+B→C
∆H = -25,5 kcal
A variação de entalpia da transformação de A em D será:
a) - 5,0 kcal
c) + 46,0 kcal
b) + 5,0 kcal
d) - 46,0 kcal
13. Com relação aos processos de mudança de estado físico de uma substância,
pode-se afirmar que são endotérmicos:
a) vaporização - solidificação - liquefação.
b) liquefação - fusão - vaporização.
c) solidificação - fusão - sublimação.
d) solidificação - liquefação - sublimação.
e) sublimação - fusão - vaporização.
14. Observe as seguintes equações termoquímicas:
I - C(s)+H2O(g) → CO(g)+H2(g)......∆H=31,4kcal
II - CO(g)+1/2O2(g) → CO2(g).......∆H=-67,6kcal
III - H2(g)+1/2O2(g) → H2O(g)........∆H=-57,8kcal
De acordo com a variação de entalpia, podemos afirmar:
a) I é endotérmica, II e III exotérmicas.
b) I e III são endotérmicas, II exotérmica.
c) II e III são endotérmicas, I exotérmica.
d) I e II são endotérmicas, III exotérmica.
e) II é endotérmica e I e III exotérmicas.
15. A partir do diagrama
INCORRETO afirmar que:
é
a) a entalpia das substância simples é
igual a zero.
b) a reação absorve energia.
c) o ∆H de formação de um mol de
C2H2 é igual a +226kJ.
d) a síntese do C2H2 é uma reação
exotérmica.
e) na obtenção de dois mols de C2H2,
o sistema absorve 452kJ.