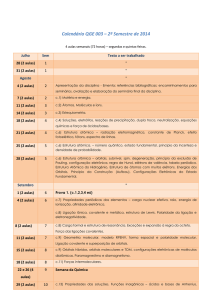
Mecânica
quântica e os orbitais
orbitaisatômicos
atômicos
Mecânicaquântica
Schrödinger propôs uma equação que
incorpora o comportamento ondulatório e o
comportamento de partícula do elétron.
Erwin Schrödinger - Físico
Prêmio Nobel de Física (1933)
Mecânica quântica e os orbitais atômicos
2
V E
2m
A posição do elétron é
especificada por uma
“função de onda”
(x,y,z)
As diferentes funções de onda
possíveis serão identificadas
por 4 números quânticos:
n, l, ml e ms
E.Schorödinger
A Equação de Onda
• Schrödinger propôs uma equação que contém os termos onda e
partícula.
• A resolução da equação leva às funções de onda.
• A função de onda fornece o contorno da nuvem eletrônica (orbital).
• O quadrado da função de onda fornece a probabilidade de se
encontrar o elétron, isto é, dá a densidade eletrônica para o átomo.
A Equação de Onda
Não tem significado físico
2 É uma expressão matemática de como a probabilidade de encontrar
a partícula varia de lugar para lugar.
Conforme o princípio da incerteza na mecânica quântica, as trajetórias
exatas do elétron não aparecem
Orbitais e Números Quânticos
Distribuição da Densidade Eletrônica no Estado Fundamental do Átomo
de Hidrogênio
(a) Na física clássica uma partícula segue uma trajetória
que pode ser seguida e prevista em qualquer instante
(b) Na física quântica a partícula “é distribuida” como uma onda.
Para a função de onda que tem amplitude grande “a probabilidade
de se encontrar a partícula é grande” e vice-versa
1- O
Orbitais e Números Quânticos
número quântico principal (n)
Este número quântico pode ter qualquer valor inteiro, positivo,
exceto zero.
A medida que n aumenta o orbital torna-se maior, e o elétron
passa mais tempo distante do núcleo.
Portanto n
núcleo.
indica a distância média do elétron ao
Um aumento de n indica também que o elétron tem energia
mais alta e por isso esta mais fracamente preso ao núcleo.
Orbitais e números quânticos
2. O número quântico azimutal, l. Esse número
quântico depende do valor de n. Os valores de l
começam de 0 e aumentam até n -1.
O valor de l é representado pela letras s, p, d, f
correspondendo aos valores = 0, 1, 2, e 3.
l
fornece informação sobre o
formato do orbital
Orbitais e números quânticos
3. O número quântico magnético, ml.
É um número inteiro que
fornece informação
sobre a orientação de um orbital no espaço.
Esse número quântico depende de l.
O número quântico magnético tem valores inteiros
entre -l e +l.
Orbitais e Números Quânticos
4-Número Quântico de Spin (ms)
Esse número determina
o sentido do giro de
rotação do elétron em torno do seu próprio eixo.
Valores : ms = +1/2
e
ms = -1/2
Orbitais e números quânticos
Spin eletrônico
Orbitais e números quânticos
n = 1, 2, 3, 4, …
l = 0, 1, 2, ..., n-1 (s, p, d, f, ...)
ml = -l, ..., 0, ..., +l
ms = +½, -½
s: __
p: __ __ __
d: __ __ __ __ __
f: __ __ __ __ __ __ __
Orbitais e números quânticos
Ex.: 1s2
___
n = 1; l = 0(subcamada s); ml = 0; ms = +½
n = 1; l = 0(subcamada s); ml = 0; ms = -½
Orbitais e números quânticos
2p1 ___ ___ ___
n = 2; l = 1(subcamada p); ml = -1; ms = +½
2p2 ___ ___ ___
n = 2; l = 1(subcamada p); ml = -1; ms = +½
n = 2; l = 1(subcamada p); ml = 0; ms = +½
2p3 ___ ___ ___
n = 2; l = 1(subcamada p); ml = -1; ms = +½
n = 2; l = 1(subcamada p); ml = 0; ms = +½
n = 2; l = 1(subcamada p); ml = +1; ms = +½
Orbitais e números quânticos
Níveis de energia dos
orbitais para o átomo de
hidrogênio.
Os orbitais podem ser
classificados em termos
de energia para produzir
um diagrama de Aufbau.
Orbitais e números quânticos
• Observe que esse diagrama de Aufbau é para um
sistema de um único elétron.
À medida que n aumenta,
o espaçamento entre os
níveis de energia torna-se menor.
No átomo de hidrogênio a
energia de um orbital depende
apenas do seu número
quântico principal.
Representação dos Orbitais : Orbitais s
•
•
•
•
•
•
•
•
•
Todos os orbitais s são esféricos.
À medida que n aumenta, os orbitais s ficam
maiores.
À medida que n aumenta, aumenta o número
de nós.
Um nó é uma região no espaço onde a
probabilidade de se encontrar um elétron é zero.
Em um nó, 2 = 0
Orbitais s possuem apenas nós esféricos.
Distribuição da Densidade Eletrônica nos Orbitais 1s, 2s e 3s
“Orbitais” 1s, 2s e 3s representados por superfícies
mostrando ~90% de probabilidade de se encontrar o elétron
nós
1s
2s
3s
nós
Distribuição da Densidade Eletrônica nos Orbitais 1s, 2s e 3s
n = Número de nós esféricos
Distribuição da Densidade Eletrônica nos Orbitais 1s, 2s e 3s
A densidade eletrônica representada por 2 varia em função da distância
r ao núcleo.
Nos orbitais 2s e 3s a probabilidade de encontrar um elétron a
certas distâncias do núcleo cai para zero.
As regiões onde psi ao quadrado é zero são chamadas de nós
1s
1 nó em r = ∞
2s
2 nós ; um nó em 2 =0 e um nó em r = ∞
3s
3 nós ; 2 nós em 2 =0 e um nó em r = ∞
Orbitais p
• Existem três orbitais p: px, py, e pz.
• Os três orbitais p localizam-se ao longo dos eixos x, y e z de
um sistema cartesiano.
• As letras correspondem aos valores permitidos de ml, -1, 0,
e +1.
• Os orbitais têm a forma de halteres.
• À medida que n aumenta, os orbitais p ficam maiores.
Orbitais 2p
O índice inferior nos símbolos dos
orbitais indica o eixo ao longo do qual o
orbital se encontra.
Superfícies para os orbitais p
plano nodal
(nó angular)
Orbitais d
• Existem cinco orbitais d: dxy , dzx , dyz , dx2-y2 e dz2
• Três dos orbitais d encontram-se em um plano
bissecante aos eixos x-, y- e z.
• Dois dos orbitais d se encontram em um plano
alinhado ao longo dos eixos x-, y- e z.
• Quatro dos orbitais d têm quatro lóbulos cada.
• Um orbital d tem dois lóbulos e um anel.
Superfícies para os orbitais d
0s cinco orbitais d
Orbitais f
Existem 7 orbitais f equivalentes. Os orbitais f estão presentes
quando o número quântico principal é maior ou igual a 4.
Para todos os orbitais f
l =3
Orbitais f
Átomos polieletrônicos
Orbitais e suas energias
• Orbitais de mesma energia são conhecidos como
degenerados.
• Para n 2, os orbitais s e p não são mais
degenerados porque os elétrons interagem entre si.
• Portanto, o diagrama de Aufbau apresenta-se
ligeiramente diferente para sistemas com muitos
elétrons.
Átomos polieletrônicos
Orbitais e suas energias
No hidrogênio a energia de um
orbital depende apenas do seu
número quântico principal n .
Em um átomo polieletrônico,
(figura ao lado) para certo valor
de n a energia de um orbital
aumenta com o valor de l