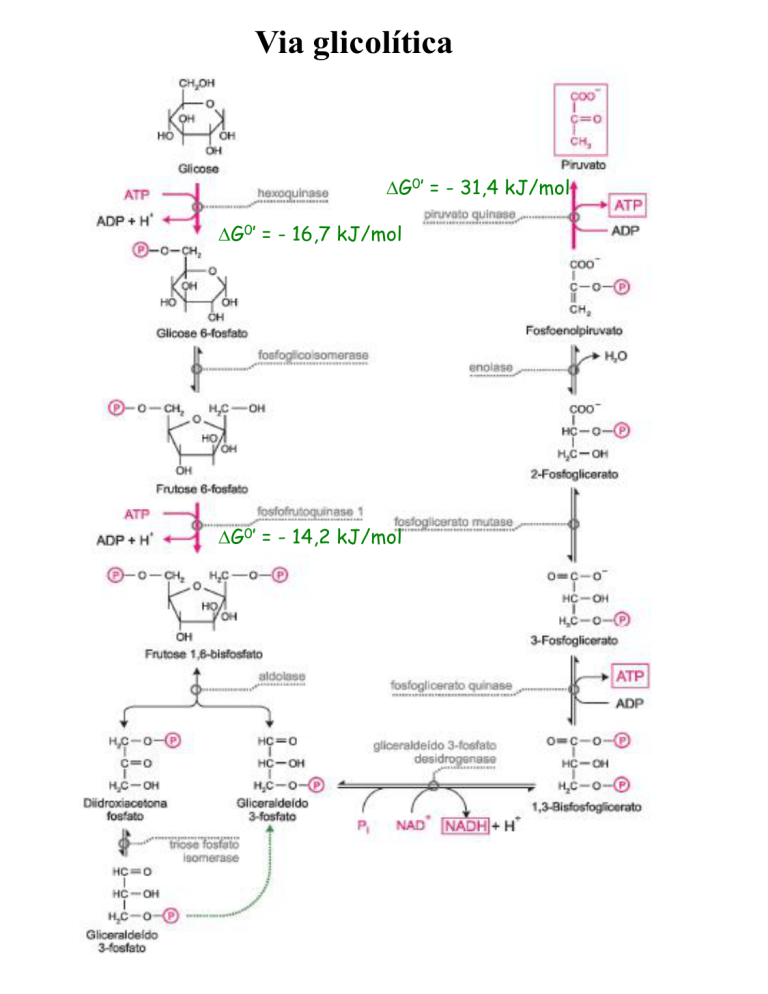
Via glicolítica
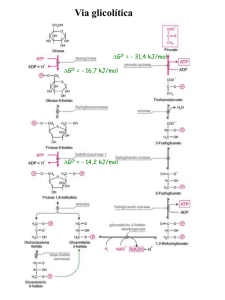
G0’ = - 31,4 kJ/mol
G0’ = - 16,7 kJ/mol
G0’ = - 14,2 kJ/mol
Hexoquinase:
Glicose + ATP HK Glicose 6-fosfato +ADP + H+
inibidor
Isoformas I, II e III: cinética michaeliana com Km < 0,1 mM,
ou seja, funcionam sempre em Vmáx.
[glicose] plasm = 5 a 8 mM
Glicoquinase e Hexoquinase
Hexoquinase (músculo): I, II, e III
Glicoquinase ou Hexoquinase IV – presente no fígado:
menor afinidade pela glicose.
Ligada a uma proteína reguladora forma um complexo
inativo.
Hexoquinase IV é regulada pelo nível de glicose no sangue:
regulação por seqüestro no núcleo celular
hepatócito
Após refeição
Durante jejum
Vindo da gliconeogênese
Fígado não compete com demais órgãos pela glicose escassa.
HEXOQUINASE IV
• Glicoquinase (Hexoquinase IV) não
é inibida por glicose 6-fosfato e tem
maior Km pela glicose.
• É importante no fígado para garantir
que glicose não seja desperdiçada
quando estiver abundante, sendo
encaminhada para síntese de
glicogênio e ácidos graxos.
• Além disso, quando a glicose está
escassa, garante que tecidos como
cérebro e músculo tenham prioridade
no uso
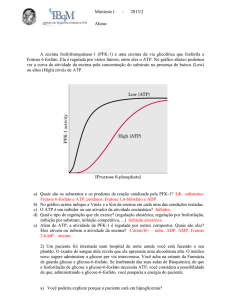
PFK-1
• Fru 6-F Fru 1,6-bF a partir desse ponto o
açúcar está comprometido com a via glicolítica
• Reação altamente exergônica e irreversível
G0’ = - 14,2 kJ/mol
• Além do sítio ativo essa enzima possui diversos
sítios onde inibidores e ativadores alostéricos se
ligam.
Fosfofrutoquinase 1 (PFK 1):
Frutose 6-fosfato + ATP
Frutose 1,6-bifosfato + ADP + H+
Efetuadores alostéricos:
• Negativos: ATP (retroinibição) e Citrato (CK)
• Positivos: AMP (musc. Esq.) e frutose 2,6-bifosfato
FRUTOSE 2,6BISFOSFATO
• Em 1980, foi observado que frutose 2,6-bisfosfato
ativava
a
fosfofrutoquinase
aumentando
sua
afinidade pelo substrato frutose 6-fosfato.
• Além disso, diminuia o efeito inibitório do ATP
• Frutose 2,6-bisfosfato é um ativador alostérico que
desloca o equilíbrio conformocional da enzima para
sua forma ativa.
• É produzido pela FOSFOFRUTOQUINASE 2
(PFK 2).
PFK2/FBPASE2
Enzima bifuncional: 6-fosfofruto-2quinase/frutose 2,6-bifosfatase
Regulação
alostérica
PFK2
Ativa PFK1
+ glicólise
Regulação por controle covalente: substrato para PKA
Piruvato Quinase:
PEP + ADP
Piruvate + ATP
Regulação
alostérica
= ativação anterógrada
Regulação por
controle
covalente
PIRUVATO QUINASE
• Último passo da via glicolítica. Fluxo de
saída.
• Produz ATP e Piruvato.
• Também é um tetrâmero presentando
diferentes isoformas em diferentes tecidos.
• Isoforma L (fígado) e isoforma M
(músculo).
• Muitas propriedades em comum:
• - Frutose 1,6-bisfosfato: ativa
• - ATP: inibe alostericamente
• - Alanina: produzida a partir de piruvato,
inibe a PIK.
• No entanto, as isoformas L (fígado) e M
(músculo) diferem na regulação por
modificação covalente: fosforilação.
• A isoforma L é inativada ao ser fosforilada
quando o nível de glicose no sangue cai
(estímulo disparado pelo glucagon)
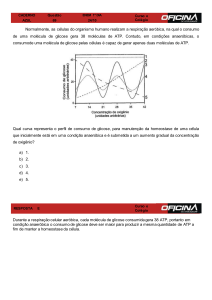
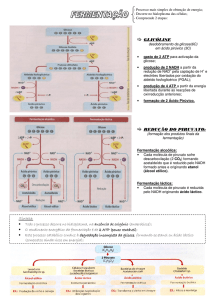
Regulação da via glicolítica
Via antagônica a glicólise: Gliconeogênese
Síntese de glicose a partir de compostos que não são
carboidratos: aminoácidos, lactato e glicerol.
Gliconeogênese
Alguns tecidos dependem quase completamente de glicose para
energia metabólica depleção de glicose gliconeogênese
Conversão de piruvato a fosfoenolpiruvato
Frutose 1,6-bisfosfato + H2O frutose 6-fosfato + Pi
Frutose 1,6-bisfosfatase
Glicose 6-fosfato + H2O glicose + Pi
Glicose 6-fosfatase
* Músculo e cérebro não contêm esta enzima
Fosfofrutoquinase 1 e Frutose 1,6-bifosfatase
Frutose-2,6- bifosfato
Regulação da via glicolítica
Hexoquinase X Glicoquinase
Fosfofrutoquinase
Piruvatoquinase
21