• FLUTUAÇÕES DE GLICOSE
PLASMÁTICA DURANTE O DIA
• Atividade
• Quantidade de alimento ingerido
• Fase de crescimento
Homeostase e regulação metabólica:
• Grafico glicose vs insulina
.
Rato: infusâo de glicose(125 mg/100ml)
resulta em aumento de glicose e liberação de insulina
Caumo A , Luzi L Am J Physiol Endocrinol Metab
2004;287:E371-E385
©2004 by American Physiological Society
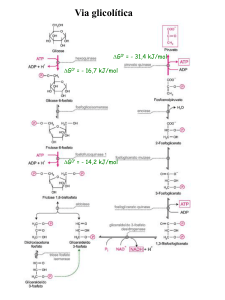
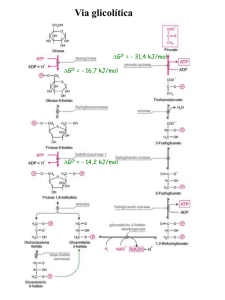
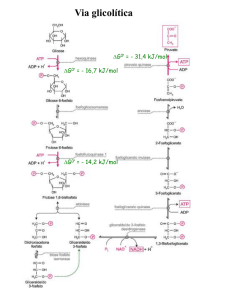
GLICÓLISE: REGULAÇÃO
• O fluxo da via glicolítica precisa se regulado em
respostas às condições dentro e fora da célula.
• Duas demandas principais:
– Produção de ATP
– Fornecimento de blocos para biossíntese.
• Pontos de regulação: reações irreversíveis
• 3 enzimas-chaves
– Fosfofrutoquinase
– Hexoquinase
– Piruvato quinase
Regulação de atividade de proteinas por fosforilação
FOSFOFRUTOQUINASE
• Homotetrâmero,
• Regulação alostérica
1) Questão energética: ATP/AMP
2) Disponibilidade de blocos para
biossíntese: citrato
3) Evitar acidose: pH
Regulação alostérica
1) Questão
energética: ATP/AMP
2) Disponibilidade de
blocos para
biossíntese: citrato
3) Evitar acidose: pH
Homotetrâmero
1) ATP: inibe a ligação do substrato, disponibilidade de energia.
2) AMP: tem o efeito contrário ao ATP, necessidade de energia.
3) Citrato: abundância de blocos, inibe a glicólise
4) Queda no pH: causado pela produção de lactato, glicólise deve ser inibida para
evitar acidose.
GLICOSE
citrato
FRUTOSE 2,6-BISFOSFATO
•
Em 1980, foi observado que frutose 2,6-bisfosfato ativava a fosfofrutoquinase
aumentando sua afinidade pelo substrato frutose 6-fosfato.
•
Além disso, diminuia o efeito inibitório do ATP
•
Frutose 2,6-bisfosfato é um ativador alostérico que desloca o equilíbrio
conformocional da enzima para sua forma ativa.
• É produzido pela FOSFOFRUTOQUINASE 2 (PFK 2).
• ENZIMAS REGULATÓRIAS DA
GLICÓLISE:
• PFK1
FRUTOSE 2,6 BISFOSFATO
• PFK2
PFK2 é REGULADA por FOSFORILAÇÃO
• Fosfofrutoquinase 2 ......
PFK2
• Frutose 2,6 bisfosfatase...... FBPase
Mesma enzima duas atividades
PFK2/FBPase2
• DUAS ISOFORMAS• L (LIVER-FÍGADO)
• M (MUSCLE-MUSCULO)
• MESMO GENE-SPLICING ALTERNATIVO
PFK2/FBPase2
no fígado
FIGADO
HEXOQUINASE
•
Por que a PFK é o ponto de
hexoquinase?
•
Hexoquinase é inibida pelo produto da reação: glicose 6-fosfato.
•
Ativada por fosfato inorgânico.
•
PFK inibida = [frutose 6-fosfato] = [glicose 6-fosfato] = HXK inibida
regulação mais importante e não a
– logo, inibição da fosfofrutoquinase vai resultar na inibição da
hexoquinase!
GLICOQUINASE (FÍGADO)
•
Glicoquinase (hexoquinase IV) não é inibida por glicose 6-fosfato e
tem maior Km pela glicose. (FIGADO)
•
É importante no fígado para garantir que glicose não seja desperdiçada
quando estiver abundante, sendo encaminhada para síntese de
glicogênio e ácidos graxos.
•
Além disso, quando a glicose está escassa, garante que tecidos como
cérebro e músculo tenham prioridade no uso.
GLICOQUINASE (FÍGADO)
Hexoquinase IV é regulada pelo nível de glicose no sangue:
regulação por seqüestro no núcleo celular
Após refeição
Durante jejum
Vinda da gliconeogênese
Fígado não compete com demais órgãos pela glicose escassa.
PIRUVATO QUINASE
• Último passo da via glicolítica. Fluxo de saída.
• Produz ATP e Piruvato.
• Também é um tetrâmero apresentando diferentes isoformas em
diferentes tecidos.
• Isoforma L (fígado) e isoforma M (músculo).
• Muitas propriedades em comum:
- Frutose 1,6-bisfosfato: ativa
- ATP: inibe alostericamente
- Alanina: produzida a partir de piruvato, inibe a PYK.
PIRUVATO QUINASE
• No entanto, as isoformas L (fígado) e M (músculo) diferem na
regulação por modificação covalente: fosforilação.
• A isoforma L é inativada ao ser fosforilada quando o nível de glicose
no sangue cai (estímulo disparado pelo glucagon)
• Cómo lembrar se uma enzima é regulada por
fosforilação ou defosforilação???????
• Lembrete:
• Glucagon só existe no fígado e é hormonio do
jejum. Ele ativa a Proteina kinase A (PKA) que
fosforila enzimas é inibe glicólise.
• Insulina hormónio do edo Alimentado. Inibe a
(PKA) e induz a defosforilação de proteínas.