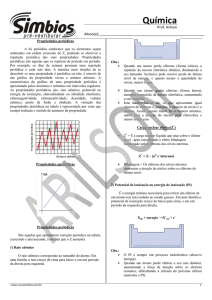
A ESTRUTURA DA
TABELA PERIÓDICA
A TABELA PERIÓDICA ATUAL
Vários estudiosos tentaram reunir
John Alexander
Newlandes
- 1864
1
18
CLASSIFICAÇÃO
PERIÓDICA
DOS ELEMENTOS
QUÍMICOS
os
elementos
químicos
de
forma
organizada
1A
0
Alexandre Chancourtois - 1863
2 W. Döbereiner - 1829
16
13
14
15
17
1ºJohann
H
7A
2A
3A
4A
5A
6A
ELEMENTOS DE TRANSIÇÃO
Organizou os elementos químicos
2º
BeIvannovitch
F
Li
B
Dimitri
Henry Moseley
Mendeleev
- 1913 - 1869
C
O
Ne
N
em
ordem
massas
3 de4 suas
10
11 em
12 linhas horizontais
5
7
8 atômicas
6
9
3º
S
Cl
Na
Mg
Si
P
Ar
Al
7B
8B
3B
6B
8B
8B
1B
2B
5B
4B
Dispôs
os elementos
químicos
em uma
contendo
7 elementos
cada.
4º
1
1
1,01
4,00
Hidrogênio
Hélio
2
1
3
P
E
R
Í
O
D
O
S
2
2
2
4
2
3
5
2
4
6
2
5
7
2
6
8
2
7
9
10
6,94
9,01
10,81
12,01
18,99
20,18
Berílio
Boro
14,00
15,99
Lítio
Carbono
Nitrogênio
Oxigênio
Flúor
Neônio
2
8
1
11
2
8
2
12
13
2
8
3
2
8
4
14
15
2
8
5
16
2
8
6
2
8
7
17
22,99
24,30
26,98
28,08
30,97
32,06
35,45
Sódio
Magnésio
Alumínio
Silício
Fósforo
Enxofre
Cloro
19
K
2
8
8
1
20
2
8
Ca 82
21
Sc
2
8
9
2
22
Ti
2
8
10
2
2
8
11
2
23
V
24
2
8
2
8
25
26
2
8
Cr 131 Mn 132 Fe 142
27
2
8
28
Co 152 Ni
2
8
16
2
29
2
8
30
2
31
2
8
2
8
32
8
Zn 182 Ga 183 Ge 184
Cu 181
33
As
2
8
18
5
2
8
34
Se 186
35
Br
18
37
1,01
Rubídio
55
132,91
Césio
7º
87
Fr
2
8
18
8
1
2
8
18
18
8
1
2
8
18
32
18
8
1
40,07
44,95
Cálcio
Escândio
38
87,62
Estrôncio
56
137,33
Bário
88
2
8
18
8
2
39
88,90
Ítrio
2
8
18
18
8
2
2
8
18
32
18
8
2
2
8
18
9
2
47,86
Vanádio
2
8
18
91,22 10
Zircôno 2
41
40
72
178,49
Háfnio
89
a
103
50,94
Titânio
2
8
18
32
10
2
104
2
8
18
12
1
92,90
Nióbio
73
180,95
Tântalo
2
8
18
32
11
2
105
51,99
54,93
Crômio
Manganês
42
95,94
2
8
18
13
1
Molibdênio
74
183,85
2
8
18
32
12
2
2
8
18
98,90 14
Tecnécio 1
43
75
186,21
Tungstênio
Rênio
106
107
58,93
58,69
63,54
65,39
69,72
72,61
74,92
Ferro
Cobalto
Níquel
Cobre
Zinco
Gálio
Germânio
Arsênio
2
8
18
101,07 15
Rutênio 1
45
2
8
18
102,91 16
Ródio 1
46
2
8
18
106,42 18
47
2
8
18
32
14
2
77
2
8
18
32
17
78
55,84
2
8
18
32
13
2
44
76
190,23
Ósmio
192,22
Irídio
109
108
Paládio
195,08
Platina
2
8
18
32
17
1
110
2
8
18
107,87 18
1
Prata
79
196,97
Ouro
2
8
18
32
18
1
111
2
8
18
112,41 18
Cádmio 2
Indio
80
81
48
2
8
18
32
200,59 18
Mercúrio 2
49
114,82
204,38
Tálio
78,96
79,90
Selênio
Bromo
2
8
18
18
3
2
2
51
52
8
8
18
18
18
118,71 18 121,76 5 127,60
Telúrio
Estanho 4 Antimônio
2
8
18
32
18
3
82
50
2
8
18
32
207,2 18
Chumbo 4
2
8
18
32
208,98 18
Bismuto 5
83
2
8
18
18
6
84
209,98
Polônio
2
8
18
32
18
6
53
126,90
Iodo
85
209,99
Astato
2
8
2
8
8
39,94
Argônio
2
8
18
7
36
Kr
Em 1829,
agrupou
os elementos
químicos
TRÍADES
traçada
em um cilindro
e em em
ordem
O
apresenta
propriedades
semelhantes
ao
primeiro
5º oitavoEspiral
Rb
Y
Ru Rh
Te
Xe
Sr
Zr
Nb Mo
Pd Ag
In
Sn
Tc
Sb
I
Cd
onde a massa
atômica
desucessivamente
um de
deles
era a média aritmética
crescente
massa.
57
e
assim
6º
Pt
Hg
Au
Bi
Po At
Tl
Ba
Ir
Pb
Ta
W
Cs
Rn
Re
Os
Hf
a
71
Organizou
os
elementos
químicos
dos outros dois.
39,09
Potássio
2
83,80
2
8
18
8
Criptônio
2
8
18
18
7
2
8
18
32
18
7
54
131,29
Titânio
2
8
18
18
8
86
2
8
18
32
222,02 18
Radônio 8
112
em ordem
suas atômico
massas atômicas
e verificou
queS
Descobriu
o de
número
dos elementos
químicos
E
SÉRIE DOS LANTANÍDEOS
M
muitas
de suas
propriedades
físicas
e químicas
a
partir
daí
ficou
determinado
que
os
elementos
E
Nº atômico
Li
B Pr Nd CPm Sm N Eu Gd O Tb Dy F Ho Er Tm YbL Lu
K Be
Ce
La
Lirepetiam7 periodicamente
u.m.a.
L
se
H
M
deveriam
uma
ordem
crescente
de Clnúmero atômico
Na obedecer
Al
Si
P
S
N Mg
SÍMBOLO
A
O
NaACTINÍDEOS23 u.m.a.
SÉRIE DOS
N
P
223,02
Frâncio
Ra
226,03
Rádio
Db
Rf
262
261
Rutherfódio
2
8
18
18
138,91 9
Lantânio 2
57
K
Massa atômica
Nome
Q
Ca
89
Ac
227,03
Actínio
Sg
2
8
18
32
18
9
2
Dúbnio
Seabórgio
58
140,12
Cério
90
232,04
2
8
18
21
140,91 82
Praseodímio
59
Cr
K
Th
Tório
2
8
18
20
8
2
2
8
18
32
18
10
2
2
8
18
32
231,04 20
9
Protactínio
2
91
Pa
Bh
Hs
Hássio
Bóhrio
2
61
8
18
22
144,24 8 146,92
Neodímio 2 Promécio
60
92
Ti
U
238,03
Urânio
2
8
18
32
21
9
2
2
8
18
23
8
2
Mt
Uun
Meitnério
Ununílio
62
63
2
8
18
24
150,36 8
Samário 2
151,96
Európio
Uuu Uub
2
64
8
18
25
157,25
8
2
Gadolínio
39 u.m.a.
93
Np
237,05
Netúnio
2
8
18
32
22
9
2
2
8
18
32
239,05 23
9
Plutônio 2
94
Pu
2
8
18
32
241,06 24
9
Amerício 2
95
Am
Unúmbio
Ununúnio
2
8
18
25
9
2
2
8
18
32
244,06 25
9
Cúrio
2
96
Cm
65
158,93
Térbio
2
8
18
27
8
2
2
8
18
28
162,50 8
Disprósio 2
66
2
98
8
18
32
249,08 26 252,08
Berquélio 92 Califórnio
97
Bk
Cf
2
8
18
32
27
9
2
67
164,92
Hólmio
2
8
18
29
8
2
2
8
18
32
252,08 28
9
Einstênio 2
99
Es
68
167,26
Érbio
100
Fm
257,10
Férmio
2
8
18
30
8
2
Túlio
2
8
18
31
8
2
2
101
8
18
32
29 258,10
9
2 Mendelévio
2
8
18
32
30
9
2
69
168,93
Md
70
173,04
Itérbio
Ç
A
No
102
259,10
Nobélio
2
8
18
32
8
2
71
174,97
Lutécio
2
8
18
32
9
2
2
2
103
8
8
18
18
32
32
32
32
262,11
8
9
2 Laurêncio 2
Lr
Prof. Agamenon Roberto
www.agamenonquimica.com
www.auladequimica.cjb.net
PERÍODOS
São as LINHAS HORIZONTAIS da tabela periódica
1º Período
2º Período
3º Período
4º Período
5º Período
6º Período
7º Período
6º Período
Série dos Lantanídios
7º Período
Série dos Actinídios
Famílias ou grupos
São as 18 LINHAS VERTICAIS da tabela periódica na forma curta
1 2 3 4 5 6
7 8 9 10 11 12 13 14 15 16 17 18
1A
0
2A
3A 4A 5A 6A 7A
3B 4B 5B 6B 7B 8B 8B 8B 1B 2B
Elementos de um mesmo grupo têm propriedades semelhantes
Famílias com nomes ESPECIAIS
1 ou 1A
metais alcalinos
2 ou 2A
metais alcalinos terrosos
16 ou 6A
calcogênios
17 ou 7A
halogênios
18 ou 0
gases nobres
1A
0
2A
Li
3A
4A
5A
Be
3B
4B
5B
6B
8B
7B
8B
8B
1B
7A
He
O
F
Ne
S
Cl
Ar
2B
Na Mg
K
6A
Se Br Kr
Ca
Rb Sr
Te
Cs Ba
Po At
Fr Ra
LiNaK Roubou César na França
Bela Margarida Casou
com o
Sr Barão Rabelo
O Sport Sempre Tem Poder
Fui Claro Brasil, Independência A todos
Helio Negou Arroz
a
Karina
e
Xerem
a
Ronaldo
I
Xe
Rn
REPRESENTATIVOS
e TRANSIÇÃO
REPRESENTATIVOS
1A
2A
3A 4A 5A 6A 7A
3B 4B 5B 6B 7B 8B 8B 8B 1B 2B
TRANSIÇÃO INTERNA)
0
TRANSIÇÃO (EXTERNA)
H
C
Na
K Ca
N O F
S Cl Ar
Fe
Ba
Br
Au
U
01) Qual(is) desses elementos é(são) representativo(s)?
H, Na, K, Ca, Ba, C, N, O, S, F, Cl, Br e Ar
02) Qual(is) deles é(são) de transição?
Fe
e Au
03) Qual(is) deles é(são) de transição interna?
U
Pág.161
Ex. 7 a 12
H
C
Na
K Ca
N O F
S Cl Ar
Fe
Ba
Pág.161
Ex. 7 a 12
Br
Au
U
04) Qual(is) deles pertence(m) a um mesmo grupo?
Na e K:
grupo 1 ou 1A
Ca e Ba: grupo 2 ou 2A
O
e
S:
grupo 16 ou 6A
F, Cl e Br: grupo 17 ou 7A
05) Qual(is) deles pertence(m) a um mesmo período?
C, N, O e F :
2º período.
K, Ca, Fe e Br : 4º período.
U :
7º período.
Na, S, Cl e Ar : 3º período.
Ba e Au : 6º período.
H
C
Na
K Ca
Fe
Ba
N O F
S Cl Ar
Pág.161
Ex. 7 a 12
Br
Au
U
06) Dentre os elementos em questão, qual(is) é(são) classificado(s) como
a) alcalinos?
Na e K
d) halogênios?
b) alcalinos terrosos?
Ca e Ba
e) gases nobres?
c) calcogênios?
O e S
F, Cl e Br
Ar
Configuração eletrônica e a Tabela Periódica
REPRESENTATIVOS e TRANSIÇÃO
REPRESENTATIVOS:
Subnível mais energético
é “ s ” ou “ p ”
localizado na última camada
TRANSIÇÃO (EXTERNA):
Subnível mais energético é “ d ”
localizado na penúltima camada
TRANSIÇÃO INTERNA:
Subnível mais energético é “ f ”
localizado na antepenúltima camada
Configuração eletrônica e a Tabela Periódica
PERÍODO DE UM ELEMENTO
O período do elemento é igual ao número de camadas do elemento
Configuração eletrônica e a Tabela Periódica
FAMÍLIA DE UM ELEMENTO
REPRESENTATIVOS
Número da Família é IGUAL ao número de elétrons da última camada
Para os de transição (externa) observamos o
número de elétrons do subnível “d” mais energético
e seguimos a tabela abaixo
3B
4B
5B
6B
7B
d1 d2
d3
d4 d5
8B
8B
d6 d7
8B
1B
2B
d8
d9 d10
26Fe
1s²
2s² 2p6 3s² 3p6 4s² 3d6
Família 8 B
23V
1s²
2s² 2p6 3s² 3p6 4s² 3d3
Família 5 B
Metais, Semimetais e Ametais
Ametais
H
He
Metais
B
C N
O F Ne
S Cl Ar
Ge As Se Br Kr
Si
P
Sb Te
I Xe
Semimetais
Po At Rn
01) (Uneb – BA) Um átomo apresenta normalmente 2 elétrons na
primeira camada, 8 elétrons na segunda, 18 elétrons na terceira
camada e 7 na quarta camada. A família e o período em que se
encontra esse elemento são, respectivamente:
a) família dos halogênios e sétimo período.
Pág.168
Ex. 23
b) família do carbono e quarto período.
c) família dos halogênios e quarto período.
d) família dos calcogênios e quarto período.
e) família dos calcogênios e sétimo período.
halogênio: 7 elétrons de valência
K = 2; L = 8; M = 18; N = 7
4º período: 4 camadas com elétrons
02) (PUC – SP)
sequência
Na classificação periódica,
considerando-se uma
de elementos de transição, dispostos
em ordem
crescente de números atômicos, pode-se concluir que os elétrons
vão sendo acrescentados sucessivamente na:
a) última camada eletrônica.
b) penúltima camada eletrônica.
c) antepenúltima camada eletrônica.
d) última ou penúltima camada eletrônica.
e) penúltima ou antepenúltima camada eletrônica.
Pág.168
Ex. 24
03) (Vunesp) Os elementos I, II e III têm as seguintes configurações
eletrônicas em suas camadas de valência:
I.
... 3s2 3p3.
II. ... 4s2 4p5.
Pág.168
Ex. 27
III. ... 3s2.
Com base nessas informações, assinale a afirmação errada:
a) O elemento I é um não metal.
b) O elemento II é um halogênio.
c) O elemento III é um metal alcalino terroso.
d) Os elementos I e III pertencem ao terceiro período da tabela
periódica.
e) Os três elementos pertencem ao mesmo grupo da tabela
periódica.
04) A configuração eletrônica de um átomo é
1
2
3
4
5
6
7
1s² 2s² 2p6 3s² 3p6 4s² 3d5
Para este elemento podemos afirmar
F
I)
V II)
É elemento representativo
É elemento de transição.
V III) Seu número atômico é 25.
V IV) Possui 7 subníveis de energia.
a) somente I é correta.
b) somente II e III são corretas.
c) somente II, III e IV são corretas.
d) todas são corretas.
e) todas são falsas.
Elétron diferencial
em subnível “d”
elemento de transição
2 + 2 + 6 + 2 + 6 + 2 + 5 = 25
05) Um átomo de certo elemento químico apresenta em sua
eletrosfera 19 elétrons. Sua configuração eletrônica nos
permite concluir que este elemento químico:
a) localiza-se no 3º período da classificação periódica.
b) pertence à família dos gases nobres.
c) é um metal de transição interna.
d) é um metal representativo.
e) é metal de transição externa.
1s² 2s² 2p6 3s² 3p6 4s1
06) Um elemento químico está na família 4A e no 5º período
da classificação periódica. A sua configuração eletrônica
permitirá concluir que seu número atômico é:
a) 50.
b) 32.
c) 34.
d) 82.
e) 46.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p2
2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 10 + 2 = 50
1s
2s
2p
3s
3p
3d
4s
4p
4d
4f
5s
5p
5d
5f
6s
6p
6d
7s
7p
PROPRIEDADES
PERIÓDICAS
Muitas características dos
elementos químicos se repetem periodicamente,
estas propriedades são denominadas de
propriedades periódicas.
RAIO ATÔMICO
LINK
RAIO ATÔMICO
Não podemos medir diretamente o raio de um átomo e,
esta medida é feita por meio de raios X,
medindo-se a distância entre
dois núcleos de átomos iguais vizinhos e
tomando-se a sua metade
VARIAÇÃO DO RAIO ATÔMICO EM UM
UMAPERÍODO
FAMÍLIA
F
9
1s² 2s² 2p5
Cl
N
17
7
1s² 2s²
2s² 2p36
A carga
do
FLÚORo
Numa
O
Onuclear
cloro
cloro
mesma
épossui
maior
família
Em um mesmo período o
Quanto
O
NITROGÊNIO
menor
o número
é tem
maior
atômico
é
maior
que
tamanho
três
que
o
camadas
flúor
do
átomo
pois
eletrônicas
aumenta
mais
tamanho do átomo aumenta da
maior
que
será
o
oeletrônicas
átomo
a carga
nuclear
do
NITROGÊNIO
camadas
de
e
cima
o FLÚOR
flúor
para
tem
baixo
direita para a esquerda
a ELETROSFERA
duasmais
camadas
eletrônicas
3s² 3p5atraindo
RESUMO
RAIO ATÔMICO
AUMENTA
A
U
M
E
N
T
A
Quando um átomo origina um íon verificamos que ...
átomo neutro
É MAIOR
átomo neutro
É MENOR
íon cátion
íon ânion
01)(UFV – MG) Os átomos neutros de dois elementos químicos e B,
estáveis, apresentam respectivamente as distribuições eletrônicas:
A: K – 2, L – 8, M – 7;
B: K – 2, L – 7
Pode-se dizer, a respeito desses dois elementos, que:
a) Apresentam o mesmo número de nêutrons.
b) São metais.
c) Apresentam o mesmo número de prótons.
d) Pertencem à mesma família da Tabela Periódica.
e) Apresentam o mesmo raio atômico.
Pág. 179
Ex.04
02) Considerando um grupo ou família na tabela periódica podemos
afirmar em relação ao raio atômico:
a) Aumenta com o aumento do número atômico, devido ao aumento
do número de camadas.
b) Aumenta à medida que aumenta o número de elétrons no nível L.
c) Não sofre influência da variação do número atômico.
d) Diminui à medida que aumenta o número atômico, devido ao
aumento da força de atração do núcleo.
e) Diminui com aumento do número atômico, devido ao aumento do
número de elétrons.
Pág. 179
Ex.03
03) (UFSM-RS) sabendo-se que o íon, genericamente representado
por X2+, tem 18 elétrons, classifique os itens como verdadeiros
ou falsos.
• O último elétron da distribuição eletrônica do íon está
no nível energético número 3.
• O nível de valência de do elemento X é o terceiro.
• O raio atômico de X2+ é maior que o raio atômico de
elemento X.
•Os subníveis “p” do íon X2+ estão totalmente preenchidos.
A sequência correta é:
a) V – F – F – V.
b) F – V – F – V.
c) V – F – V – F.
d) F – V – V – F.
e) V – F – V – V.
Pág. 179
Ex.07
ENERGIA ou POTENCIAL DE IONIZAÇÃO
LINK
ENERGIA ou POTENCIAL DE IONIZAÇÃO
É a energia necessária para retirar um elétron de
um átomo neutro e isolado no estado gasoso
formando um cátion
A remoção do primeiro elétron, que é mais afastado do
núcleo, requer uma quantidade de energia denominada de
primeira energia de ionização (1ª E.I.)
A remoção do segundo elétron requer uma energia maior
que à primeira, e é denominada de segunda energia de
ionização (2ª E.I.)
Quanto MENOR for o átomo MAIOR será a
ENERGIA DE IONIZAÇÃO
RESUMO
ENERGIA ou POTENCIAL DE IONIZAÇÃO
AUMENTA
A
U
M
E
N
T
A
01) (Unifor – CE) A 1ª energia de ionização é medida pela energia X
quando o 1º elétron é retirado de um Y isolado. Para um mesmo
elemento, a 2ª energia de ionização é Z do que a 1ª.
Completa-se corretamente o texto substituindo-se X, Y
e Z,
respectivamente, por:
a) liberada, átomo neutro, maior.
b) absorvida, átomo neutro, maior.
c) absorvida, íon positivo, menor.
d) liberada, íon positivo, menor.
e) absorvida, íon negativo, menor.
Pág. 184
Ex.15
02) (UFSM-RS) Para dois elementos químicos genéricos X e Y, sabe-se
que é mais fácil retirar elétrons de X do que de Y. Com relação a
essa afirmativa, analise as proposições a seguir:
F
I.
O 1º potencial de ionização de X é maior que o 1º potencial de
ionização de Y.
F
II. X poderia ser representado pelo elemento químico enxofre (S)
e Y, pelo elemento químico alumínio (Al).
V
III. X poderia ser representado pelo elemento químico rubídio (Rb)
e Y, pelo elemento químico lítio (Li).
F
IV. X pode ser um não metal e Y, um metal, sendo ambos do
mesmo período da tabela periódica.
Pág. 184
Ex.15
Está(ao) correta(s):
a) apenas I.
b) apenas II.
c) apenas III.
d) apenas IV.
e) apenas II e IV.
O P.I de X é < P.I. de Y
03) Os dados X e Y que faltam no quadro são:
Ponto de fusão (ºC)
1ª energia de ionização
(kcal/mol)
Cálcio
850
Y
Estrôncio
X
131
Bário
700
120
a) X = 770; Y = 141.
b) X = 861; Y = 1430.
c) X = 1550; Y = 141.
d) X = 770; Y = 1430.
e) X = 1550; Y = 251.
Pág. 184
Ex.16
ELETROAFINIDADE ou AFINIDADE ELETRÔNICA
LINK
ELETROAFINIDADE ou AFINIDADE ELETRÔNICA
É a energia liberada pelo átomo, isolado no estado
gasoso, quando recebe um elétron
formando um ânion
Não definimos AFINIDADE ELETRÔNICA para
os GASES NOBRES
A afinidade eletrônica varia nas famílias
de baixo para cima
e nos períodos
da esquerda para a direita
AUMENTA
A
U
M
E
N
T
A
01)(Unifor-CE) Do leite ao peixe, os minerais estão presentes em todos
os alimentos. São fundamentais para o corpo humano, atuando
como poderosos coadjuvantes da saúde física e psíquica ao manter
bem ajustado um sem-número de funções. Pela sua importância,
são classificados:
Macrominerais: Ca, Fe e P. Microminerais antioxidantes: Cu, Mg, Zn e Se.
É correto afirmar que:
a) Na, Cu, Zn e Se pertencem ao mesmo período da classificação
periódica.
b) Fe (Z = 26), possui em seu estado fundamental o subnível “d”
incompleto.
c) Mg, Ca e K são metais alcalino-terrosos e, portanto, apresentam
as mesmas propriedades químicas.
d) Com relação a afinidade eletrônica, a ordem correta é
P > Se > Na > Cu.
e) Ca e Mg são metais alcalinos.
Pág. 187
Ex.23
DENSIDADE
É a relação entre a massa (m) e o volume (V) de um corpo
d=
Os
LINK
m
V
PONTO DE FUSÃO E PONTO DE EBULIÇÃO
Corresponde à temperatura em que um elemento passa
do estado sólido para o líquido e
do líquido para o gasoso, respectivamente
AUMENTA
ELETRONEGATIVIDADE
É a tendência que um átomo possui de atrair
elétrons para perto de si, quando se encontra ligado
a outro átomo de elemento químico diferente
numa substância composta
H
F
O par de elétrons é mais atraído pelo flúor
O flúor é mais ELETRONEGATIVO que o hidrogênio
01) (Cefet-PR) Relacione as frases a seguir com elementos constantes na
Tabela Periódica apresentada e indique a sequência correta:
A
Y
G
J
M
D
E
Y
L
Q
Pág. 190
Ex.31
R
X
• Dentre os elementos A, Y, D e E, o de menor energia de ionização.
• O elemento que pertence ao 3º período do grupo 5A.
• O elemento de maior afinidade eletrônica.
• Entre os semimetais o de maior raio atômico.
• O elemento de maior densidade.
a) A – L – T – D – J.
b) A – D – E – R – Q.
c) A – L – E – R – J.
d) E – L – T – R – Q.
e) E – R – T – L – J.