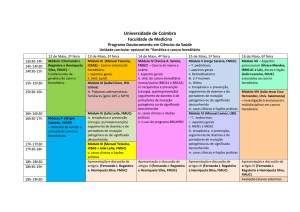
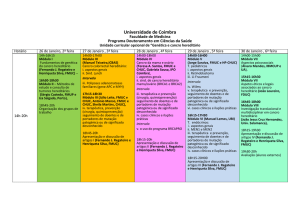
Seminário Orientado
Bioquímica I
FMUC 2007/2008
Bioquímica I
Os principais tampões
com interesse fisiológico
FMUC 2007/2008
Bioquímica I
Objectivos
• Noção de ácido-base;
• Intervenção dos tampões na regulação do pH
de líquidos orgânicos;
• Principais tampões com interesse fisiológico;
• Mecanismos reguladores de pH em resposta à
acidose e à alcalose.
FMUC 2007/2008
Bioquímica I
Sistema Tampão
Um tampão é uma mistura de um ácido fraco e do
seu sal, capaz de captar e libertar H+.
Evita alterações na concentração de H+ e
consequentemente alterações de pH, quando
adicionadas pequenas quantidades de ácidos ou bases
fortes.
FMUC 2007/2008
Bioquímica I
Para se tamponizar uma solução recorre-se a
ácidos ou bases fracos.
Porquê?
Ácido – substância que liberta H+.
HA
H+ +
A-
Base – substância que capta H+.
BOH
B+
+
OH-
FMUC 2007/2008
Bioquímica I
Dissociação parcial - Ao ser
atingido o equilíbrio químico
ácido-base, qualquer
alteração no sistema é
contrariada até ser atingido
novo estado de equilíbrio –
Principio de Le Chatelier.
O valor do pK deve corresponder ao pH do meio
desejado.
[H+]
[ A-]
Ka =
[HA]
[H+] = Ka
[A-]
[HA]
[HA]
-log [H+] = -log Ka – log
pH = pK + log
[A-]
[A-]
[HA]
Eq. de Henderson Hasselbalch
Equação útil no cálculo do pH de soluções de ácidos fracos.
pK – valor de pH necessário para permitir 50% de
dissociações de uma substância.
Ka – constante de dissociação.
pH = -log [H+]
FMUC 2007/2008
Bioquímica I
Eficiência de um tampão
Quanto maior o número de moles que é necessário
adicionar a um meio contendo um sistema tampão, de modo
a alterar significativamente a concentração de H+, mais
eficiente é o tampão.
Pela equação de Handerson-Hasselbalch,
pH = pKa + log ([A-]/[HA])
• O pH depende das concentrações do ácido (HA) e da base
(A-).
• O sistema tampão será mais eficiente quando [A-]=[HA], ou
seja, quando o pH = pKa. Na prática, o tampão é mais
eficiente na gama de valores situados entre uma unidade
abaixo e uma unidade acima do valor do pKa;
FMUC 2007/2008
Bioquímica I
A manutenção do pH é vital para as células
Porquê??
Cada célula é banhada por um meio óptimo
para o seu funcionamento de tal modo que é
necessário um controlo da circulação e da
composição dos fluídos do organismo.
Só uma variação muito limitada da
concentração de ácidos ou de bases
circulantes é compatível com a vida.
pH do sangue arterial normal é igual a 7,40 ± 0,05
Valores compatíveis com a vida - pH entre 7,8 e 6,8
FMUC 2007/2008
Bioquímica I
Principais Sistemas Tampão
O pH intracelular:
O pH extracelular:
Proteínas
Ácido carbónico/
bicarbonato
Ácidos resultantes do
metabolismo
FMUC 2007/2008
Bioquímica I
Iões fosfato
Sistema Tampão das Proteínas
•
As proteínas intracelulares e plasmáticas podem funcionar como moléculas -tampões;
•
A existência de grupos funcionais, como os grupos carboxílicos e amínicos, nos
aminoácidos que constituem as proteínas são responsáveis pela sua capacidadetampão;
•
Os grupos funcionais podem funcionar como ácidos ou bases fracas, o que permite o
controlo da concentração de H+ ;
•
A hemoglobina e as histonas associadas a ácidos nucleícos são moléculas
intracelulares que podem funcionar como tampões.
FMUC 2007/2008
Bioquímica I
Sistema Hemoglobina
Realiza o transporte de gases respiratórios e tem
um efeito tampão;
Evita que a concentração de iões H+ varia de
forma brusca, provocando variações de acidez
com consequências danosas para o organismo;
HbH
H+ + Hb-
O efeito tampão que assegura faz com que o pH
do sangue venoso seja ligeiramente mais baixo do
que o do sangue arterial;
FMUC 2007/2008
Bioquímica I
Sistema
Hemoglobina
FMUC 2007/2008
Bioquímica I
Sistema Tampão dos Fosfatos
• As moléculas que contém fosfatos
na sua estrutura, tal como o ADN, o
ARN e o ATP, bem como os iões
fosfatos podem funcionar como
tampões;
• O par HPO4 2- / H2PO4- é o principal
tampão das células, onde se
pretende que o pH seja
aproximadamente 7;
• Assume também grande importância
a nível do sistema renal.
FMUC 2007/2008
Bioquímica I
Sistema tampão ácido carbónico/bicarbonato
Ácido fraco, que estabelece o seguinte equilíbrio:
•
Quando no organismo aumenta,
por exemplo:
PCO2
Ácido láctico
Ácidos gordos
Organismos cetónicos
O H+ liga-se ao HCO3- e forma H2CO3
e somente uma pequena porção
permanece sob a forma de H+ livre.
•Se, no organismo, for removida
uma grande quantidade de H+,
através da adição de uma base
forte:
As moléculas de H2CO3 irão formar
HCO3- e H+
Diminui o pH
Aumenta o pH
FMUC 2007/2008
Bioquímica I
Regulação respiratória do equilíbrio ácido-base
1. O CO2 reage com H2O para
formar H2CO3. Este
dissocia-se para formar H+
e HCO3-.
2. A diminuição do pH do
líquido extracelular estimula
o centro respiratório e
provoca o aumento da
frequência respiratória.
3. O aumento da frequência e
profundidade respiratória
faz com que o CO2 seja
expelido dos pulmões,
reduzindo assim os seus
níveis extracelulares. À
medida que estes
decrescem, a [H+]
extracelular diminui e o pH
aumenta.
FMUC 2007/2008
Bioquímica I
Equilíbrio Ácido-Base e Respiração
Acidose
Alcalose
Normal
Normal
Asfixia Acidose
Hiperventilação Alcalose (pH 7,4 – 7,7)
FMUC 2007/2008
Bioquímica I
Regulação renal do equilíbrio ácido-base
1. Quando o pH decresce
o H+ combina-se com o
HCO3-, para formar
ácido carbónico que se
converte em CO2 e
H2O. O CO2 difunde-se
para as células
tubulares.
2. Nas células tubulares o
CO2 combina-se com a
H2O e forma H2CO3
que se dissocia em H+
e HCO3-.
3. Um mecanismo de
contra-trasporte secreta
H+ para o filtrado por
troca com Na+. Em
resultado o pH do
filtrado diminui.
4. Através do co-trasporte, o HCO3- e o Na+
entram no líquido intersticial, de onde se difundem
para os capilares.
5. Nos capilares o HCO3- combina-se com o H+ o
que aumenta o pH sanguíneo.
FMUC 2007/2008
Bioquímica I
Regulação renal do equilíbrio ácido-base
• As células dos túbulos renais
regulam directamente o equilíbrio
ácido-base, aumentando ou
diminuindo a secreção de H+ e a
reabsorção de HCO3-.
• A secreção de H+e a reabsorção
de HCO3- aumentam quando o
pH dos líquidos orgânicos desce
e este processo torna-se mais
lento quando o pH dos líquidos
orgânicos sobe.
FMUC 2007/2008
Bioquímica I
Regulação renal do equilíbrio ácido-base
Normalmente, o H+
secretado para o
nefrónio excede a
quantidade de HCO3- que
entrou nos túbulos
renais por filtração. Uma
vez que o H+ se combina
com o HCO3-, quase todo
o HCO3- é reabsorvido
dos túbulos renais.
A secreção para o
filtrado diminui o pH
deste. Quando a
concentração de H+
aumenta no filtrado, a
capacidade de as células
tubulares em secretar H+
torna-se limitada. Por
isto, o H+ é tamponado e
assim estas células
readquirem a capacidade
de secretar H+ adicional.
FMUC 2007/2008
Bioquímica I
Regulação da concentração de H+ nos
sistemas biológicos
Tipo de regulação
Função
Tempo
1. Tampões químicos
(Proteínas, HCO3-, HPO42-)
Combinam-se com o H+
(Pr (proteína) + H+ PrH)
milisegundos
2. Respiração
Eliminação de CO2 nos pulmões
(H+ + HCO3- H2CO3 CO2 + H2O)
minutos
3. Regulação renal
Secreção de H+
Reabsorção de HCO3- e HPO42-
horas
FMUC 2007/2008
Bioquímica I
Quatro Alterações Principais do
Equilíbrio Ácido-Base
Tipo
Alteração
primária
Resposta
secundária
Mecanismo de
resposta
secundária
ACIDOSE
METABÓLICA
[HCO3-]
pCO2
Hiperventilação
ALCALOSE
METABÓLICA
[HCO3-]
pCO2
Hipoventilação
ACIDOSE
RESPIRATÓRIA
pCO2
ALCALOSE
RESPIRATÓRIA
pCO2
[HCO3
-]
transitório da excreção de
ácido e da reabsorção de
HCO3- pelo rim
[HCO3
-]
transitória da excreção de
ácido e reabsorção de HCO3pelo rim
FMUC 2007/2008
Bioquímica I
Equilíbrio Ácido - Base
SISTEMAS
TAMPÕES
Alcalose
Respiratória
Alcalose
Metabólica
EVITAM
DISTÚRBIOS DO
EQUILÍBRIO
ÁCIDO - BASE
FMUC 2007/2008
Bioquímica I
Acidose
Metabólica
Acidose
Respiratória
Bibliografia
Campos, Luís,(2005),Entender a Bioquímica, Escolar
Editora, p.p.68-72;
Seeley, Stephens,Tate,(2003), Anatomia & Fisiologia
,Lusociência, p.p. 1017-1023.
FMUC 2007/2008
Bioquímica I