Câncer da Próstata
PSA
INTRODUÇÃO
O antígeno específico da próstata foi inicialmente descoberto no plasma seminal . O
mesmo antígeno foi isolado do tecido prostático e purificado, demonstrando-se ser específico do
tecido prostático . Embora identificado em todos os tipos de tecido prostático (normal, hiperplástico
benigno e maligno), não pode ser encontrado em nenhum outro tecido humano. Portanto, ficou
conhecido como o antígeno específico da próstata. Para o antígeno específico da próstata entrar
na circulação geral, primeiro deve atravessar várias barreiras fisiológicas, incluindo a camada
celular basal, a membrana da base dos ácinos, o estroma prostático, a membrana da base capilar
e as células endoteliais capilares. A deterioração dessas barreiras, permitindo a elevação das
concentrações séricas de PSA, pode ser causada por várias condições. Entre essas condições
estão o infarto prostático (um fenômeno comum associado à retenção urinária aguda), a prostatite,
a hiperplasia prostática benigna e o câncer de próstata. Portanto, o PSA sérico em níveis elevados
não é patognomônico de câncer de próstata.
Considerável trabalho vem sendo efetuado para o aperfeiçoamento da precisão
diagnóstica dos testes de PSA. A especificidade (probabilidade do teste ser negativo se o paciente
não tem a doença) é importante na interpretação do nível de PSA, pois quanto maior a
especificidade do teste, menor será o número de biópsias desnecessárias a serem efetuadas. A
sensibilidade é definida como a probabilidade do teste ser positivo se o paciente tem a doença. A
maioria dos testes individuais efetuados demonstram uma relação inversa entre especificidade e
sensibilidade. Se um teste de acompanhamento não for efetuado a fim de determinar a
especificidade, será muito difícil que um único exame de sangue apresente elevada sensibilidade e
especificidade. 0 PSA já foi analisado de acordo com a densidade do PSA, velocidade do PSA e
PSA especificado por idade.
O antígeno específico da próstata é uma glicoproteína com atividade de protease sérica
do tipo calicreína, produzido pelas células epiteliais que se encontram ao longo dos ácinos e dutos
da glândula prostática. Esse antígeno é secretado no sistema de dutos prostáticos e causa a
liquefação do coágulo seminal no momento da ejaculação-Encontra-se no plasma em duas formas:
a conjugada, unido a proteínas como a alfa-1 antiquimiotripsina (ACT) e PSA livre.
De uma maneira geral considera-se alto um valor maior do que 4 ng/ml no soro. As
concentrações de PSA por grama de tecido não diferem significativamente entre tecidos
prostáticos normais, hiperplásticos e cancerosos. O antígeno específico da próstata pode ser
detectado no soro de homens jovens com próstatas pequenas não-hiperplásticas, de homens mais
velhos com hiperplasia prostática benigna e de homens com câncer de próstata localizado ou
metastático. Nos homens que não sofrem de nenhuma doença prostática (prostatite, hiperplasia
prostática benigna ou câncer de próstata), a concentração sérica desse antígeno é extremamente
baixa. Recentemente foi demonstrado que o nível sérico médio nesse tipo de paciente é de 0,07
+/- 0,4 ng/ml.
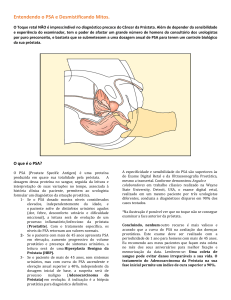
Quando este se situa entre 4 e 10 ng/ml, há uma possibilidade de CaP em cerca de 30%
dos casos e, se estes níveis são superiores a 10 ng/ml, esta aumenta para 70%.
Um PSA dentro da faixa de referência (até 4.0 ng/ml) não afasta a possibilidade de câncer.
Aproximadamente 20% dos pacientes com CaP podem apresentar nível de PSA sérico dentro dos
valores de referência.
A dificuldade do diagnóstico está em pacientes que têm níveis de PSA entre 4,0 e 10,0
ng/ml. Trata-se de uma zona limítrofe, sendo que uma porcentagem de pacientes tem apresentado
câncer em biópsias subseqüentes, e outros apenas hipertrofia prostática benigna. Geralmente,
nesse intervalo de 4,0 - 10,0, um intervalo de cada quatro biópsias será positiva para câncer. No
intervalo de 10,0 - 20,0 ng/ ml de PSA, mais da metade será positiva para câncer.
CURIOSIDADE: Até recentemente acreditava-se que o PSA era ausente nas mulheres.
No entanto, com métodos altamente sensíveis este foi detectado em diversos tecidos como
mamas, ovários e endométrio, assim como em líquidos biológicos como líquido amniótico e leite.
Assim como no homem sua produção parece obedecer à regulação pelos hormônios esteróides,
como androgênios e corticosteróides e pela progesterona.
Sua vida média oscila entre dois e três dias, portanto requer várias semanas após uma
prostatectomia radical para se tornar indetectável.
É importante ressaltar que o toque retal, a biópsia prostática, a prostatectomia e a massagem
prostática podem elevar os níveis de PSA por até 3-4 semanas.
Relação PSA livre/total (PSA L/T).
0 PSA existe em várias formas moleculares. 0 antígeno em si é uma protease sérica e a
sua função é a liquefação do fluido seminal. 0 antígeno liga-se a inibidores da protease
extracelular. Apresenta afinidade à antiquimotripsina alfa I (ACT) e macroglobulina alfa II (AMG) e,
em menor medida, à inter-alfa-tripsina e antripsina alfa I. Também pode existir em estado livre. Há
cinco regiões imunológicamente reativas específicas na molécula do PSA. Quando
transformada em complexo ACT (PSA-ACT), três dessas regiões são cobertas, deixando apenas
duas disponíveis para reação com anticorpos. Quando transformada em complexo AMG
(macroglobulina alfa II), todas as cinco regiões são cobertas, e não há nenhum imunoensaio
convencional que possa detectar o complexo. Portanto, ao se medir o nível de PSA livre e total,
está se medindo o PSA livre e o PSA ligado à ACT, ou antiquimotripsina, sem nenhuma medição
disponível da assim chamada forma complexa ou do PSA ligado à macroglobulina alfa II.
A medição da relação entre PSA livre e PSA total tem sido muito útil na seleção de
pacientes para biópsia da próstata, quando o nível total de PSA é constatado variar entre 4,0 e
10,0.
Três pesquisadores diferentes, Christerisson, Luderer e Catallona, têm estudado a relação
PSA livre para PSA total como indicação para biópsia de próstata. A vantagem de escolher um
valor de relação PSA livre/PSA total, abaixo do qual uma biópsia seria indicada, é aumentar a
especificidade sem perda de sensibilidade.
Christerisson tem recomendado que o limite da relação PSA livre para PSA total deveria
ser de 0, 18 ou 1 ng/ml.
Luderer já sugeriu que o limite seja de 0,20 ou 20%.
Catallona tem recomendado uma taxa de PSA livre/PSA total de 0,20 ou 20%, se a
glândula prostática for maior que 40 g, ou de 0, 13 (13%) se a glândula prostática for menor que 40
g, de acordo com estudo ultra-sonográfico transretal.
Em próstatas menores de 40 gramas com uma relação abaixo de 13,7% foi detectados
90% de CAP. Em próstatas maiores, com uma relação L/T menor que 20,5%, detectou-se 90%
CAP.
RELAÇÃO PSA LIVRE E PSA TOTAL (PSAL/PSAT): Mais recentemente tem se
demonstrado que pacientes com CaP têm proporção significativamente menor de PSAL que
pacientes com HPB ou homens normais. As razões pela diminuição do PSAL no CaP não estão
nos dias atuais estabelecidas.
Temos pois que valores da relação PSAL/TPSA maiores que 0,18 sugerem HPB enquanto
valores menores que 0,18 sugerem CaP. Em resumo, a utilidade de medir a relação PSA livre/PSA
total já foi comprovada por vários, investigadores como sendo particularmente útil quando o nível
de PSA varia entre 4,0 e 10,0 ng/ml em termos de PSA total. Ainda precisa ser determinada qual a
relação mais apropriada ou significativa para o caso, embora a maior parte dos investigadores
estejam considerando uma relação que varia de 18% a 25%. Trata-se de uma relação inversa,
portanto, quanto mais baixa for a razão PSA livre/PSA total, maior será a probabilidade de
detectar-se câncer de próstata. Embora a modificação da relação limite altere a especificidade e
sensibilidade, a maior parte dos valores relatados acima de fato apresentam uma sensibilidade
próxima de 90%, o que é excelente. Entretanto, a especificidade varia de 38% até 76% - média de
56%. Embora a relação de PSA livre para PSA total represente um avanço significativo rio
diagnóstico do câncer de próstata, o teste ou os testes precisa ter, em última instância, Lima
precisão de 95% em termos de sensibilidade e especificidade para que possam ser amplamente
aceitos como teste de triagem para a detecção de câncer de próstata.
PSA e a idade
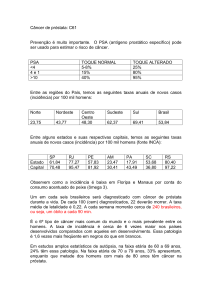
ESTRATIFICAÇÃO DO PSA POR IDADE: Existe uma variação normal do PSA de acordo
com a idade (ver tabela abaixo). Percebemos assim, que valores considerados normais, quando
corrigidos para idade passam a ser rotulados como suspeitos.
Os níveis de PSA constatados por faixa etária têm sido os seguintes:
40-49 anos: - 2,5;
50-59 anos: 2,5 - 3,5;
60-69 anos: 3,5 - 4,5;
70-79 anos: 4,5 - 6,5 ng/ml.
A velocidade do PSA tem sido o indicador isolado mais útil, sendo que uma variação
superior a 0,75 ng/ml durante um período de 12 meses sugere anormalidade.
Idade
PSA
40-49
0-2,5
50-59
0-3,5
60-69
0-4,5
70-79
0-6,5
Densidade do PSA (PSAD)
A DENSIDADE DO PSA: corresponde ao quociente entre PSA sérico e o volume da próstata
determinado pelo ultra-som. Quando a densidade é maior que 0,15, a probabilidade de CaP é
significativa e estes pacientes devem ser submetidos à biopsia.
Podemos considerar uma unidade de PSA para cada 10 gramas de tecido prostático
Dividir o PSA pelo volume prostático (medico por USG transretal), resultando a densidade
do PSA: PSAD=PSA/Vol=ng/cc.
Encontrou-se em todos os pacientes com CAP (CANCER DA PRÓSTATA) uma PSAD
superior a 0,12
Produção de PSA para CAP de 3,5 ng/ml por grama de tecido e de 0,3 ng/ml para HPB
Níveis Séricos de PSA e Hiperplasia Prostática Benigna Uma percentagem significativa de
homens com hiperplasia prostática benigna histologicamente comprovada apresenta níveis séricos
elevados de PSA > 4,0 ng/ml.
Velocidade do PSA (PSAV)
A VELOCIDADE do PSA: reflete o aumento em relação ao PSA basal por ano, sendo um aumento
superior a 20% ao ano fortemente sugestivo de CaP.
Ficou determinado que um aumento superior a 0,75 ng/ml por ano ou de 20% nos níveis
prévios do PSA sugerem CAP e indicam biópsia.
PSA e o seguimento dos pacientes com câncer de próstata
Prostatectomia radical:
Após a prostatectomia os fatores prognósticos são o escore de Gleason, o estadiamento
patológico e os valores de PSA.
Considera-se prognóstico favorável quando níveis de PSA indetectáveis ou inferiores a
0,4 ng/ml até três meses após a cirurgia.
A elevação progressiva dos valores de PSA é indício de recorrência da neoplasia. Para
se definir o padrão de recorrência - se local ou desenvolvimento de metástases - o melhor método
(segundo Review de Polascik, Oesterling e Partin publicado em agoso de 1999 na Journal of
Urology) é a associação do tempo de recorrência de PSA*, escore de Gleason e acometimento de
linfonodos ou vesícula seminal na cirurgia.
PSA e radioterapia:
A dosagem de PSA deve ser feita três meses após a radioterapia. Espera-se uma
diminuição progressiva de valores até um ano ou mais após o tratamento.
Se os níveis de PSA forem superiores a 4 ng/ml em seis meses após a radioterapia há
alta chance de insucesso do tratamento.
Ainda não se sabe a capacidade dos tecidos prostáticos maligno e benigno de produzir
PSA depois da radiação e valor sérico deste marcador tumoral nos pacientes curados ainda é
controverso, variando de 0,5 a 4 ng/ml.
Hormonioterapia:
Espera-se que o PSA seja reduzido a níveis normais ou indetectáveis de três a seis
meses após a ablação androgênica.
Estes valores baixos não implicam em erradicação da doença, já que pacientes com boa
resposta inicial tiveram elevação dos valores de PSA depois de seis meses da ablação.
Entretanto, a manutenção de valores baixos por mais de seis meses após o tratamento é
indício de sucesso da terapia hormonal.
A elevação dos níveis de PSA durante o tratamento revela a ocorrência de escape
hormonal, ou seja, houve desenvolvimento de populações celulares resistentes à hormonioterapia,
que crescem e se proliferam independentemente do hormônio andrógeno. Isto implica em
prognóstico ruim, já que não há alternativa terapêutica efetiva.
*
Tempo de recorrência de PSA é o intervalo de tempo no pós-operatório em que o PSA
volta a ser detectado . Trabalho realizado por Pound demonstrou que quanto mais cedo for a
recorrência de PSA, maior é a probabilidade do desenvolvimento de metástases. Dos pacientes
que tiveram recorrência no primeiro ano pós-operatório 93% tinham metástases , e dos que tiveram
no segundo ano 39% tinham metástases.
Agentes e procedimentos que afetam os níveis de PSA
Biopsia prostática, cirurgia e uretrocitoscopia podem elevar temporariamente o nível sérico
de PSA. Já houve especulações de que a manipulação da próstata durante o exame de toque retal
também pode elevar o nível sérico de PSA. Entretanto, num estudo multicêntrico conduzido em
2.754 homens sadios de 40 anos de idade ou mais, o aumento observado após o exame de toque
retal não foi clínica ou estatisticamente significativo em homens com níveis séricos de PSA <10,0
ng/ml (n="2.667)." Nos homens com níveis> 10,0 ng/ml, observou-se uma tendência de aumento
nos níveis séricos de PSA. Nesses já elevados níveis, o aumento do antígeno não iria interferir no
tratamento clínico.
Nível Sérico de PSA em comparação com o Exame de Toque Retal
Recentemente dois estudos de larga escala foram conduzidos para o exame do papel do
antígeno específico da próstata nos testes de detecção de câncer de próstata . Na Universidade de
Washington em St. Louis, Missouri, Catallona e associados avaliaram 1.653 homens sadios
assintomáticos que tinham concentrações séricas de PSA; 37 dos homens foram diagnosticados
com câncer, representando uma taxa geral de detecção de 2,2 por cento. Na Universidade de
Washington em Seattle, Brawer e colegas atingiram uma taxa de detecção de 2,6 por cento num
estudo conduzido em 1.249 homens. Esses valores são um tanto melhores do que o 1,3 a 1,5 por
cento relatado, com o uso de exame de toque retal, por Cupp e Oesterling (1993).
No estudo de St. Louis, 32 por cento dos casos de câncer identificados não teriam sido
detectados se somente o exame de toque retal tivesse sido utilizado. O grupo de Seattle constatou
que 38 por cento dos casos de câncer na população do estudo não teriam sido identificados se
somente o exame de toque retal tivesse sido utilizado. A partir desses estudos, parece ser que
através da medição do nível sérico de PSA podem ser identificados casos de câncer que não
seriam detectáveis por meio de exame de toque retal (lesões impalpáveis) e que, para uma
população dada, as medições de PSA podem resultar na identificação de 50 a 61 por cento de
casos de câncer a mais do que o número de casos identificados por exame de toque retal.
Entretanto, o exame de toque retal também mostrou identificar casos de câncer de próstata
não detectáveis através do critério de elevadas concentrações sérica de PSA. Em outro estudo
onde 300 homens submetidos a biopsia de próstata por vários motivos, mas não necessariamente
devido a elevado nível de PSA sérico. Constataram que 21 por cento dos pacientes com câncer
comprovado por biopsia apresentaram níveis séricos de PSA dentro do intervalo de referência (0,0
a 3,9 ng/ml, utilizando-se o ensaio de PSA de Tandem-R) e teriam sido ignorados se a decisão de
colher uma amostra para biopsia tivesse sido tomada com base apenas no nível de PSA.
Esses dados sugerem (1) que não é possível identificar-se todos os casos de câncer
detectável através de medições de PSA e (2) que no exame de toque retal podem ser detectadas
lesões que passariam desapercebidas com o uso exclusivo do critério de concentração sérica de
PSA. Todos os estudos considerados em conjunto indicam que a estratégia mias sensível de
testes para a detecção de câncer de próstata é o uso do exame de toque retal e das medições dos
níveis
séricos
de
PSA.
PIN (Neoplasia intraepitelial prostática)
A neoplasia intrapitelial prostática é uma lesão na próstata caracterizada por atipia que
não é considerada câncer, porém acredita-se ser precursora dessa doença.
A PIN é dividida em PIN-1 (displasia leve), PIN-2(displasia moderada) e PIN-3 (displasia
grave).
A maioria das autoridades médicas acredita que a PIN-1 não apresenta risco elevado de
desenvolvimento subseqüente de câncer, enquanto a PIN-2 e PIN-3 são associadas a uma
incidência de 30-50%de câncer em biópsias subseqüentes.
Como a PIN de grau elevado (2 e 3) não causam um valor elevado do antígeno específico
da próstata (PSA), várias biópsias são necessárias para descartar a possibilidade de câncer
nesses pacientes. Se uma segunda biópsia não revelar a presença do câncer, os pacientes são
acompanhados com extrema cautela a cada seis meses, ao invés de a cada ano, com o propósito
de observar a taxa de alteração do nível de PSA, assim como o valor absoluto desse antígeno.
Carter já demonstrou que uma elevação superior a 0,75 ng/ml ao ano do nível de PSA
constitui um sinal significativo de perigo de câncer de próstata, indicando a necessidade de uma
avaliação para biópsia de câncer.
Catallona demonstrou que pacientes com determinações de PSA superiores a um valor
absoluto de 10 ng/ml com biópsia prévia negativa apresentam uma probabilidade de 41% de
carcinoma de próstata ser detectado em biópsias subseqüentes.
A maior parte dos urologistas e patologistas concordam em que a detecção de NIP-2 ou 3
através de biópsia indica a necessidade imediata de uma segunda biópsia para poder se descartar
a possibilidade de carcinoma oculto que eventualmente não tenha sido detectado com a primeira
biópsia. Como mencionado, o nível de PSA não permite distinguir entre NIP de grau elevado e
câncer infiltrado, da mesma forma que a determinação da ploidia (DNA) do tecido tampouco
permite essa distinção.
Parece ser que a PIN de grau elevado é uma lesão precursora do adenocarcinoma de
próstata. Entretanto, admite-se que a PIN não precisa estar presente para haver desenvolvimento
de câncer de próstata. Dos casos de câncer de próstata relatados, 95 a 98% são adenocarcinomas
de próstata.
Em resumo, a PIN, ou neoplasia intrapitelial prostática, é um tipo de atipia, e não de
câncer, que pode ser detectada através de biópsia prostática, mas que em sua forma moderada ou
grave acredita-se ser precursora do carcinoma de próstata, justificando um acompanhamento em
geral mais minucioso do que os simples exames anuais e testes de PSA. Repetidas biópsias são
indicadas, assim como medições do nível de PSA pelo menos a cada seis meses para
determinação da velocidade ou taxa de variação desse nível no tempo.
PIN de alto grau
PIN se refere ao final de uma série de modificações morfológicas proliferativas das células
dos ductos e ácinos prostáticos. Sendo dividido em dois grau (alto e baixo), para substituir o sitema
de 3 graus antigos (baixo grau substitui PIN 1, alto grau substitui PIN 2 e PIN 3). O processo de
desenvolvimento da neoplasia prostática inicia-se por PIN de baixo grau, que ao evoluir para PIN
de alto grau, desenvolverá ruptura das camadas de células basais, sobreposição e crescimento
nuclear, e aumentando a proeminência nucleolar, por perda progressiva dos marcadores de
diferenciação secretória, e pela atividade proliferativa, densidade dos microvasos, instabilidade
genética e conteúdo de DNA. Estudos em necrópsias indicam que PIN precede carcinoma de 10 a
mais anos; PIN de baixo grau surge primeiro em homens a partir da terceira década de sua vida.
A incidência de PIN de biópsia de agulha é incerta. PIN e câncer foram identificados em 17
(5,2%) e 58 (15,8%) de homens, respectivamente, numa série de 330 biópsias feitas em homens
participando de uma trabalho de detecção precoce. Lee et al, estudaram 256 biópsias guiadas pelo
ultra-som em lesões hipoecóicas da próstata, identificaram 27 casos de PIN (10,5%) e 103
canceres (40,2%). Interessantemente, os pacientes com PIN tiveram a idade média de 65 anos
enquanto que pacientes com câncer tiveram a média de 70 anos. PIN de alto grau é encontrado
em cerca de 16,5% das biópsias de agulha em consultórios de prática urológica.
PIN de alto grau tem um alto valor de predição para câncer, de 35 a 100%. Além disso,
PIN é um marcador cuja identificação em espécimes de biópsias garantem pesquisas futuras para
adenocarcinoma invasivo simultâneo.
Davidson et al, encontraram adenocarcinoma em 35% das biópsias subseqüentes em
diagnósticos prévios de PIN comparados com 13% das biópsias em grupos de controle sem PIN.
PIN de alto grau, significantemente (p<0,0001) prediz câncer, com risco relativo de 14,9. O índice
de risco foi mais alto do que para a idade (3,5 , p<0,01) ou concentração de PSA (3,6 , p<0,02).
Esses dados reforçam a forte associação entre PIN e adenocarcinoma e indicam que o paciente
precisa ser acompanhado mais amiúde. Biópsia continua sendo o único método definitivo para
detectar PIN e a invasão inicial do câncer.
Biopsia e seguimento dos pacientes é sugerida em intervalos de 3 a 6 meses em dois anos e mais
tarde de intervalo de 12 meses para o resto da vida.
ESCALA DE GLEASON
Há muita confusão em torno da escala de Gleason, já que patologistas, urologistas e
oncologistas baseiam-se para suas avaliações tanto no grau de Gleason como na pontuação ou
soma de Gleason.
Este sistema de avaliação baseia-se no padrão glandular do tumor identificado com baixa
magnificação.
As características citológicas desempenham um papel na determinação do grau do tumor.
Ao se chegar a uma pontuação ou soma de Gleason, tanto os padrões arquitetônicos primários
(predominantes ) e secundários ( o segundo mais prevalecente) são identificados e avaliados com
uma nota de 1 a 5, sendo que 1 representa o mais diferenciado tumor (menos maligno).
Se um tumor apresenta apenas um padrão histológico, para fins de uniformidade, os
padrões primário e secundário recebem a mesma nota. As somas de Gleason variam de um nível
mínimo de 2 (1+1) até 10 (5+5).
Qualquer soma ou pontuação de Gleason maior ou igual a 7 implica que provavelmente
uma das notas de Gleason é 4, indicando um prognóstico relativamente desfavorável. Portanto,
pessoas com uma soma ou pontuação de Gleason inferior a 7 apresentam melhor condição do que
aqueles com pontuação ou soma de Gleason superior a 7.
É raro observar soma de Gleason inferiores a 4 em biópsias por agulhados tumores de
câncer de baixo grau tendem a ser pequenos e eventuais, improváveis de ser detectados
clinicamente (através de biópsia por agulha).
Os tumores de baixo grau também são identificados na zona de transição, onde é mais
difícil de se colher amostras através de biópsia por agulha.
-Dos pacientes com soma de Gleason de 7, de acordo com algumas séries, até 62%
apresentam penetração capsular estabelecida; 48%, margens positivas; 17%, invasão da vesícula
seminal; e 12%, metástase nos nódulos linfáticos. Isso tudo constitui um sinal de prognóstico
desfavorável.
Por outro lado, pacientes com somas de Gleason de 6 apresentam penetração capsular
em apenas 24% dos casos, margens positivas em apenas 29%, invasão da vesícula seminal em
4% e metástase nos nódulos linfáticos em 2% dos casos. Portanto, a soma de Gleason é muito útil
para ajudar pacientes a escolher entre prostatectomia radical e radioterapia com base na
probabilidade da presença de câncer fora da próstata, ou seja de ser incurável cirurgicamente no
momento do diagnóstico original.
Já foi sugerido que pacientes com tumores iniciais de baixo grau podem progredir para
tumores de grau elevado com o tempo. Isso está, em parte, relacionado ao tamanho do tumor.
O uso da soma ou pontuação de Gleason, junto com a estimativa clínica do tamanho do
tumor, constitui uma ferramenta muito poderosa para o cálculo da probabilidade do câncer de
próstata penetrar na cápsula prostática e tornar o tratamento cirúrgico improvável de proporcionar
cura.
É possível combinar a pontuação ou soma de Gleason com o tamanho ou estágio clínico
do tumor para determinação prognostica. Numa série John Hopkins, pacientes com soma ou
pontuação de Gleason de 7 e tamanho clínico de próstata de T2B ou maior (mais da metade de um
lóbulo, mas sem os dois com câncer ) resulta numa probabilidade de penetração capsular de 68%.
Tumores T2A com pontuação de Gleason de 6 apenas apresentam uma probabilidade de 38% de
penetração capsular. Novamente, essas informações são úteis para orientar o paciente e
urologista na escolha entre cirurgia e radioterapia.
ESTADIAMENTO (TNM, 1992)
pT – Tumor primário
pTX
pT0
pT1
Tumor primário não pode ser avaliado
Não há evidência de tumor primário
Tumor é um achado histológico incidental, é impalpável
e invisível por técnicas de obtenção de imagens.
Tumor em 5% ou menos do tecido ressecado
pT1a
Tumor em mais de 5% do tecido ressecado
pT1b
Tumor identificado em biópsia por agulha (p.ex.,
pT1c
pT2
pT2a
pT2b
pT2c
pT3
pT3a
pT3b
pT3c
pT4
pT4a
pT4b
em casos de PSA elevado)
Tumor limitado à próstata
Tumor compromete até metade de 1 lobo, ou
menos
Tumor compromete mais da metade de 1 lobo,
porém não ambos os lobos
Tumor compromete ambos os lobos
Tumor se estende além da cápsula prostática
Extensão extracapsular unilateral
Extensão extracapsular bilateral
Tumor invade vesícula seminal
Tumor adere ou invade outras estruturas adjacentes que
não a vesícula seminal.
Tumor invade qualquer das seguintes estruturas:
colo vesical, esfíncter externo, reto
Tumor invade músculos elevadores do reto e/ou
está aderido à parede pélvica.
PN – Linfonodos regionais
pNX
pN0
pN1
Linfonodos regionais não podem ser avaliados
Ausência de metástases em linfonodos regionais
Metástase em único linfonodo, medindo 2 cm em sua
maior dimensão.
Metástase em único linfonodo, medindo 2 a 5 cm em sua
maior dimensão ou metástases glanglionares múltiplas, nenhuma
> 5 cm em sua maior dimensão.
Metástase em um linfonodo > 5cm em sua maior
dimensão.
pN2
pN3
PM – Metástases à distância.
pMX
pM0
pM1
pM1a
pM1b
pM1c
Presença de metástases à distância não pode ser avaliada.
Ausência de metástases à distância
Metástases à distância.
Linfonodo(s) não regional(is)
Osso(s)
Outras
localizações
CÂNCER DE PRÓSTATA - ESTADIAMENTO E SISTEMAS
DE GRADAÇÃO
Na edição de 1992 (Shröder et al., 1992), o sistema TNM introduz uma nova modalidade
de carcinoma incidental: T1c. Até pouco tempo, os carcinomas incidentais eram diagnosticados em
RTU, prostatectomia aberta ou necrópsias. Com a possibilidade de se dosar no soro o antígeno
específico da próstata (PSA), este exame passou a ser feito de forma mais rotineira. Em casos de
PSA elevado, está indicada biópsia por agulha, podendo assim ser detectado um eventual
carcinoma o qual corresponderia ao estádio T1c.
Esta neoplasia, assim diagnosticada, pode corresponder a carcinoma verdadeiramente
incidental (A1 ou A2) ou ser clínico que, por alguma razão (volume pequeno ou localização
central), não é detectado ao toque retal ou ultra-som. No momento, é difícil prever o
comportamento biológico do carcinoma em estádio T1c em cada caso.
De acordo com Epstein et al., biópsias com agulha de pacientes com PSA elevado e que
mostram carcinoma em mais de 3 fragmentos, extensão tumoral em mais de 50% da área de um
fragmento e Gleason padrão 4 ou 5 teriam comportamento mais agressivo.
Nessa nova versão, há também mudança no que se refere à separação do estádio T1
(carcinoma incidental) em T1a e T1b. Anteriormente, essa separação era feita levando-se em conta
o número de focos carcinomatosos. Na versão de 1992, a separação baseia-se no percentual de
tecido ressecado com carcinoma (T1 até 5% e T1b em mais de 5%). Admite-se que a avaliação da
extensão do tumor como parâmetro preditivo de progressão, independentemente do método
empregado, seja superior ao número de focos positivos e à própria gradação histológica. O método
mais fácil de avaliar a extensão tumoral é estabelecer o percentual de fragmentos com carcinoma
do total de fragmentos examinados.
1.Classificação quanto ao comportamento biológico
Carcinoma latente
Não tem manifestações clínicas, ou seja os homens que o apresentam vão morrer de
outras causas com ele, e não em conseqüência dele. É um achado histológico incidental em
material de necrópsia ou de patologia cirúrgica (RTU, prostatectomia aberta ou biópsia com
agulha). Essa modalidade de neoplasia é uma peculiaridade quase exclusiva da próstata. A
freqüência do carcinoma latente é maior do que a do carcinoma clínico. O conhecimento da
existência do carcinoma latente resultou de estudos em necropsia. Observa-se carcinoma
histológico em 25 a 30% de pacientes autopsiados com mais de 40 anos, freqüência que aumenta
com a idade, atingindo 50% em pacientes com mais de 65 anos.
Comparando-se esses dados de freqüência com a incidência e a taxa de mortalidade do
carcinoma clínico, nota-se que há discrepância, isto é, há muito mais homens com carcinoma
histológico que pacientes com carcinoma clínico. Isto quer dizer que a maior parte (cerca de 80%)
dos carcinomas histológicos encontrados em homens com mais de 40 anos permanece latente, ou
seja, não progride com infiltração local ou metástases à distância.
Carcinoma clínico
É o carcinoma com manifestações clínicas, correspondendo aos estádios B, C ou D
(Whitmore-Jewet).
Carcinoma clínico não diagnosticado. Esta eventualidade não é rara. Nem todos os
carcinomas prostáticos apresentam-se em forma de nódulos endurecidos ao toque retal. A
consistência dura depende do caráter cirroso da neoplasia, que nem sempre está presente. Em
casos de RTU ou prostatectomia aberta, suspeita-se de carcinoma clínico que não foi
diagnosticado quando: (1) o carcinoma está presente em quase todos os fragmentos examinados,
isto é, a positividade é muito superior a 3 fragmentos positivos ou 5% dos fragmentos examinados;
e/ou (2) a gradação histológica no sistema Gleason for igual ou superior a 7 (alto grau).
2. Gradação histológica
A gradação histológica do carcinoma da próstata tem correlação com o estadiamento
clínico tendo, portanto, valor prognóstico. Os vários sistemas existentes refletem as dificuldades
para uma gradação adequada. O sistema de maior aceitação atualmente, em particular nos EUA, é
o Gleason.
Se o anatomopatologista optar por um único sistema de gradação histológica,
aconselhamos que o utilize.
Sistema Gleason
A gradação no sistema Gleason baseia-se na diferenciação glandular e no padrão de
crescimento com relação ao estroma. Neste sistema, não se consideram as atipias nucleares. Ao
contrário. Assim, por exemplo, se o grau histológico de 90% da área examinada for 3 e 10% for 5,
o grau do tecido neoplásico será 3-5, o que daria uma contagem final de 8. Caso o grau histológico
seja 3 em toda a área examinada, repete-se o número. Assim sendo, o grau será 3-3 e a contagem
final, 6. De acordo com esse sistema, o grau histológico poderá ser de 1 a 5 a contagem final, de 2
a 10.
As contagens finais 2-6 são consideradas de baixo grau e as 7-10, de alto grau.
Em casos de biópsias com agulha com mais de um padrão, recentemente, a Association
of Directors of Anatomic and Surgical Pathology recomendou que seja considerado como padrão
secundário o grau maior. Assim, por exemplo, um caso com grau 3 em 60% da área examinada,
grau 2 em 30% e grau 4 em 10%, o grau final será 3-4.
G
Gleason
rau
1
Não
há caractere infiltrativo; a neoplasia é bem delimitada, sendo diagnosticada pelo
desarranjo arquitetural; as margens são precisas e há pouco espaço entre os ácinos
neoplásicos.
Também não há caráter infiltrativo, sendo o diagnóstico feito pelo desarranjo arquitetural;
a2 neoplasia não é tão bem limitada como no grau 1 e há maior distância entre os ácinos
neoplásico.
Há caractere infiltrativo, podendo ocorrer arranjo cribriforme; o último, quando presente,
3
determina que a neoplasia seja, no mínimo, grau 3.
Além do caráter infiltrativo, há proximidade entre os ácinos, conferindo à neoplasia
4
caráter medular e/ou tendência de fusão entre os ácinos.
O arranjo da neoplasia é sólido, não raro observando-se células neoplásicas isoladas ou
5
em arranjo trabecular; inclui-se neste grau histológico o aspecto em comedocarcinoma.
Sistema Mostofi.
O sistema Mostofi leva em conta a diferenciação glandular e a anaplasia (atipia) nuclear, e
o tecido neoplásico poderá ser graus 1, 2 ou 3.
Não considera o arranjo cribriforme como de grau especial, o que é feito nos demais. O
arranjo cribriforme é considerado como tecido que forma glândulas, de modo que, nesses casos, a
gradação final estará na dependência das atipias nucleares apresentadas. A gradação final do
tecido neoplásico é feita com base no padrão predominante; assim sendo, se 90% do tecido
examinado são de grau 2 e 10% de grau 3, a gradação será grau 2.
G
Mostofi
rau
1O tecido neoplásico forma glândulas e as atipias nucleares são leves.
O tecido neoplásico forma glândulas e as atipias nucleares são
2
moderadas.
O tecido neoplásico não forma glândulas (arranjo indiferenciado ou
3
sólido) e/ou as atipias nucleares são intensas.
Sistema Böcking
O sistema Böcking tem ampla aceitação na Alemanha e associa diferenciação glandular
com anaplasia nuclear. A contagem final é a soma dos graus histológicos (diferenciação glandular)
e citológico (anaplasia nuclear), podendo ser de 2 a 7.
Assim, por exemplo, se o grau histológico for 2 e o citológico 1, a contagem final será 3.
Contagens finais de 2 e 3 caracterizam neoplasia como tendo um grau final I, de 4 a 5 um grau
final II e de 6 e 7 um grau final III.
No sistema Böcking, consideram-se somente as áreas mais indiferenciadas, tanto para a
gradação histológica como para a citológica. Assim, por exemplo, se 90% do tecido examinado
mostram grau 2 histológico e 10% grau 3, o grau considerado será 3. Se, o mesmo caso, 90% do
tecido examinado mostram grau citológico 1 e 10% grau 2, o grau considerado será 2. A contagem
desse caso será 5 e o grau final, II.
Böcking
Grau histológico
Bem1 diferenciado; notam-se glândulas bem definidas, uniformemente arredondadas ou
ovaladas e com lúmens amplos.
Pouco
2 diferenciado; as glândulas são menores, há variações de forma e, algumas vezes,
não mostram lúmen.
Arranjo
3 cribriforme
Anaplásico
4
(arranjo sólido)
Grau citológico (anaplasia nuclear)
1 Leve
2
Moderada
3
Intensa
Grau final (contagem dos graus histológico e citológico)
I 2e3
I
4e5
I
6e7
I
II
3. Estadiamento clínico (Whitmore-Jewett )
Whitmore foi o primeiro autor a classificar o carcinoma da próstata em 4 estádios, a saber:
Estádio A
Estádio B
Estádio C
Estádio D
É o carcinoma encontrado incidentalmente em material de necropsia ou durante
exame histopatológico de material retirado cirurgicamente (RTU ou prostatectomia
aberta).
É clinicamente evidente em forma de nódulo palpado ao toque retal e limitado à
próstata.
A neoplasia ultrapassa a cápsula prostática, estendendo-se aos tecidos
periprostáticos, mais freqüentemente para as vesículas seminais.
Há metástases, mais freqüentemente para os ossos da pelve, coluna vertebral e
gânglios linfáticos regionais.
Estádio A1 vs. A2
A grande maioria dos pacientes com estádio A1 tem sobrevida semelhante à da população
em geral e, para a maioria dos urologistas, não necessita de terapêutica adicional, sendo apenas
acompanhados. Os pacientes com estádio A2 têm grande probabilidade de progredir para
carcinoma clínico, estando indicada, inclusive, a prostatectomia radical.
A separação do estádio A em A1 e A2 pode ser feita com base no número absoluto de
fragmentos positivos, no percentual de fragmentos positivos ou na contagem final da gradação de
Gleason:
Parâmetros
Qt. de fragmentos positivos
Percentual de fragmentos positivos
Gleason (contagem final)
Estádio A1
até 3
até 5%
2a6
Estádio A2
>3
>5%
7 a 10
No diagnóstico final, é aconselhável incluir o resultado dos três parâmetros considerados. Se o
resultado nos três parâmetros for concordante, acrescentar no laudo compatível com A1 ou
compatível com A2. Se um dos parâmetros não for concordante, deixar o laudo apenas descritivo.
A decisão final de se considerar o caso como sendo A1 ou A2 será conjunta entre
anatomopatologista e urologista.