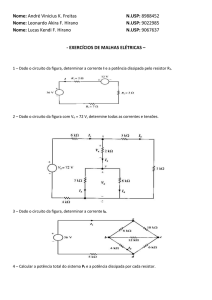
PILHAS
01) Dos fenômenos indicados a seguir, agrupe os que constituem uma oxidação e os que constituem uma redução:
a) Mgo Mg2+ + 2 ed) Al3+ + 3 e- Alo
b) Ago Ag+ + ee) 2 H+ + 2 e- H2
o
2+
c) Ca Ca
+2e
f) 2 I- + 2 e- I2
02) Defina:
a) pilha elétrica
e) redutor
b) ânodo
c) cátodo
f) ponte salina.
d) oxidante
03) Faça um esquema e descreva o funcionamento da pilha de Daniell.
04) Utilizando a tabela de potenciais, descubra quais as reações que podem ser realizadas e indique os agentes
oxidante e redutor, se houver:
a) Sro + Ca2+ Sr2+ + Cao
b) Na+ + Feo Nao + Fe2+
2+
o
o
2+
c) Zn
+ Mg Zn
+ Mg
d) Cu2+ + Sbo Cuo + Sb2+
e) Cu2+ + Ago Cuo + Ag+
f) Cro + Mn2+ Mno + Cr3+
2+
o
o
3+
g) Mn
+ Al Mn
+ Al
h) Al3+ + Beo Alo + Be2+
+
o
o
2+
i) Ag
+ Pt Ag
+ Pt
d) Pt2+ + Ago Pto + Ag+
05) Explique por que a reação representada pela equação
Fe o + 2 H+ Fe2+ + H2 pode ser realizada,
o
+
2+
enquanto que a representada por Cu + 2 H Cu + H2 não pode ser realizada.
06) Prepara-se uma solução de sulfato de zinco (ZnSO4). A seguir, são mergulhadas nessa solução três lâminas:
uma de níquel (Nio), outra de prata (Ago) e a terceira de magnésio (Mgo). Qual(is) dessas lâminas fica(m)
recoberta(s) de zinco?
07) Observe a tabela:
Semi-reação
Al Al3+ + 3 eCo Co2+ + 2 e-
Eooxid
+ 1,66 V
+ 0,28 V
Eored.
- 1,66 V
- 0,28 V
a) Quem se oxida mais facilmente?
b) Quem se reduz mais facilmente?
c) Qual o melhor agente oxidante?
d) Qual o melhor agente redutor?
e) Faça a reação global entre estes metais quando formam uma pilha.
08) Dada a tabela:
Semi-reação
Ni Ni2+ + 2 eCu Cu2+ + 2 e-
Eooxid
+ 0,23 V
- 0,34 V
Eored.
- 0,23 V
+ 0,34 V
a) Quem se oxida mais facilmente?
b) Quem se reduz mais facilmente?
c) Qual o melhor agente oxidante?
d) Qual o melhor agente redutor?
e) Faça a reação global entre estes metais quando formam uma pilha.
09) Com base nos potenciais de oxidação das semi-reações abaixo, responda:
Semi-reação
Fe Fe2+ + 2 eBa Ba2+ + 2 e-
Eooxid
+ 0,44 V
+ 2,90 V
Pb Pb2+ + 2 e-
+ 0,13 V
a) Quem se oxida mais facilmente?
b) Quem se reduz mais facilmente?
c) Qual o melhor agente oxidante?
d) Qual o melhor agente redutor?
e) Faça a reação global entre dois destes metais quando formam uma pilha.
10) Dar a equação global e calcular a diferença de potencial de uma pilha com eletrodos de magnésio e chumbo. A
seguir, fazer um esquema de montagem dessa pilha.
11) Dadas as semi-reações:
Alo Al3+ + 3 eEo = + 1,66 V
o
2+
o
Cu Cu + 2 e
E = - 0,34 V
calcular a ddp da pilha formada por eletrodos de alumínio e de cobre, bem como a reação global.
12) Fazer um esquema de uma pilha com eletrodos de alumínio e crômio. A seguir, identificar o ânodo, cátodo,
calcular a ddp, fazer as semi-reações e a reação global e expressar simbolicamente a pilha.
13) Dadas as semi-reações:
Alo Al3+ + 3 eEo = + 1,66 V
Feo Fe2+ + 2 eEo = + 0,44 V
determinar as semi-reações, a reação global e a ddp da pilha.
14) Dadas as semi-reações:
Mg2+ + 2 e- Mgo
Eo = - 2 ,37 V
Cu2+ + 2 e- Nio
Eo = - 0,23 V
Determine:
a) que lâmina vai diminuir de massa?
b) que lâmina vai aumentar de massa?
c) qual eletrodo constitui o ânodo?
d) qual eletrodo constitui o cátodo?
e) escreva a equação global dessa pilha.
f) determine a ddp.
15) Na pilha de Daniell, durante o seu funcionamento, uma das placas metálicas se dissolve, enquanto a outra tem
sua massa aumentada. Em vista disso, responda:
a) Quais são os metais dessas placas?
b) Em que eletrodo cada uma delas se localiza?
c) Quais os fenômenos químicos que ocorrem para provocar os fatos descritos?
16) Qual a finalidade da parede porosa ou da ponte salina?
17) Corrija, se necessário, a frase seguinte:
“Na pilha de Daniell, os íons circulam pelo fio que liga as placas de zinco e cobre, enquanto os elétrons
circulam pela parede porosa”.
18) Com relação a pilha de Daniell, formada por eletrodos de cobre e zinco, responda:
a) Quem perde elétrons?
b) Quem recebe elétrons?
c) Qual íon tem sua concentração aumentada? d) Qual íon tem sua concentração diminuída?
e) Qual metal tem sua massa diminuída?
f) Qual metal tem sua massa aumentada?
g) Qual metal forma o cátodo?
h) Qual metal forma o ânodo?
i) Determine as semi-reações e a reação global. j) Calcule a ddp desta pilha.
19) Consultando a tabela de potenciais normais, faça o esquema da pilha, identifique o ânodo e o cátodo, calcule a
ddp, descubra a equação da reação global e expresse simbolicamente a pilha constituída por eletrodos de:
a) magnésio e zinco.
b) cobre e prata.
c) crômio e níquel.
d) zinco e prata.
20) Consultando a tabela de potenciais normais, determine a equação da reação global e a ddp das pilhas:
a) Alo/Al3+//Cu2+/Cuo
b) Cuo/Cu2+//Hg2+/Hgo
c) Coo/Co2+//Pb2+/Pbo
d) Feo/Fe2+//Cu2+/Cuo
e) Cuo/Cu2+//Ag+/Ago
21) Verificar se ocorre a seguinte reação:
Cuo + Fe2+ Cu2+ + Feo
22) Descubra se são espontâneas as reações representadas por:
a) Sro + CaSO4 SrSO4 + Cao
b) 2 Na+ + Feo Fe2+ + 2 Nao
c) Zn2+ + Mgo Mg2+ + Zno
d) CuSO4 + 2 Ag Ag2SO4 + Cuo
e) Cuo + Ag2SO4 CuSO4 + 2 Ag
f) Hgo + 2 Ag+
Hg2+
+ 2 Ag
23) Seja a pilha Pb/Pb2+//Ag+/Ag, sabendo que os eletrodos são formados por sais de nitratos, responda:
a) Qual o eletrodo é o cátodo (pólo +)?
b) Qual o eletrodo é o ânodo (pólo -)?
c) Qual a semi-reação no eletrodo de chumbo?
d) Qual a semi-reação no eletrodo de prata?
e) Qual a espécie química que se oxida?
f) Qual a espécie química que se reduz?
g) Qual a reação global da pilha?
h) Qual é a função da ponte salina?
i) Qual o sentido do fluxo dos elétrons?
j) Qual o valor da ddp desta pilha?
l) Qual a placa que apresenta a massa aumentada?
m) Qual a placa que apresenta a massa diminuída?
n) Quais são os íons que se movimentam na ponte salina?
o) Como podemos saber que a reação atingiu o equilíbrio químico?
24) Dadas as pilhas:
I- Al/Al3+//Ag+/Ag
II- Mn/Mn2+//Cr3+/Cr
2+
2+
III- Zn/Zn //Pb /Pb
IV- Cu/Cu2+//Ag+/Ag
VI- Mg/Mg2+//I2/IDetermine o que se pede para cada pilha acima.
a) a reação que ocorre em cada eletrodo, classificando-a em oxidação ou redução.
b) um esquema de cada pilha.
c) qual a placa metálica que diminui e qual a placa metálica que aumenta a sua massa.
d) qual o ânodo (pólo negativo) e qual o cátodo (pólo positivo).
e) qual o sentido do fluxo de elétrons.
f) qual a solução terá sua concentração aumentada e qual terá sua concentração diminuída em relação aos
íons.
g) determine o valor da ddp (F.E.M.).
25) Explique o que ocorre quando mergulhamos uma placa de zinco em uma solução de sulfato de cobre II.
26) Dados os potenciais de redução dos seguintes eletrodos:
Cu2+ + 2e- Cu
E = + 0,34 V
Al3+ + 3e- Al
E = - 1,67 V
2+
Zn
+ 2e Zn
E = - 0,76 V
Ag+ + e- Ag
E = + 0,80 V
2+
Pb
+ 2e Pb
E = - 0,13 V
represente a pilha que fornece a maior força eletromotriz e dar as reações de oxidação e redução nessa pilha.
27) Qual a voltagem das seguintes pilhas e qual é a sua reação global, no estado padrão?
a) Al/Al3+//Ni2+/Ni
b) Mn/Mn2+//Fe2+/Fe
c) Ni/Ni2+//Cu2+/Cu
d) Ca/Ca2+//Pb2+/Pb
e) Li/Li+//Cu2+/Cu
f) Fe/Fe3+//Ag+/Ag
28) Considere o seguinte tipo de pilha: Ao/A+//B+/Bo. Considerando esta pilha, responda:
a) que lâmina vai diminuir de massa?
b) que lâmina vai aumentar de massa?
c) qual eletrodo constitui o ânodo?
d) qual eletrodo constitui o cátodo?
e) escreva a equação global dessa pilha.
29) Calcular a variação de energia livre Go dos seguintes processos espontâneos:
a) Zno/Zn2+//Cu2+/Cuo
b) Alo/Al3+//Cu2+/Cuo
c) Alo/Al3+//Cr3+/Cro
d) Mgo/Mg2+//Ni2+/Nio
e) 2 Fe3+ + Sn 2 Fe2+ + Sn2+
30) Considere NaCl fundido, HCl liquefeito, solução aquosa de NaCl e solução aquosa de HCl. Quando à condução
de corrente elétrica, afirma-se respectivamente:
a) conduz; conduz; não conduz; não conduz. b) não conduz; não conduz; conduz; conduz.
c) conduz, não conduz; conduz; conduz.
d) conduz, não conduz; não conduz; conduz.
e) conduz; conduz; conduz; conduz.
31) O fato de a água pura apresentar uma condutividade elétrica muito baixa é um indício de que:
a) a água é um solvente puro.
b) a água tem caráter ácido.
c) a água é muito ionizada.
d) a água é muito pouco ionizada.
e) o número de íons H3O+ e OH- é o mesmo.
32) Em uma cela eletroquímica, eletrodo é:
a) a lâmina metálica
b) a solução
c) a ponte salina
d) a lâmina metálica e a solução em conjunto
e) o fio que transporta a corrente elétrica
33) Em que condições de temperatura, concentração e pressão é feita a medida convencional do potencial normal
de eletrodo?
a) CNTP
b) 25oC, 0,1 mol/L, 1 atm
c) 0oC, 1 mol/L, 1 atm
o
d) 273 K, 1 mol/L, 1 atm
e) 25 C, 1 mol/L, 1 atm.
34) O eletrodo constituído por uma solução 1 mol/L de ácido, na qual fazemos passar uma corrente de gás
hidrogênio sobre uma lâmina de platina, estando todo o sistema a 25oC e 1 atm, é chamado de:
a) eletrodo normal de hidrogênio.
b) eletrodo-padrão de hidrogênio.
c) eletrodo convencional de platina e hidrogênio.
d) eletrodo-padrão de platina.
e) eletrodo referencial de hidrogênio.
35) O potencial do eletrodo-padrão foi arbitrado em um determinado valor, pois não é impossível determinar o
potencial absoluto de um eletrodo. Esse valor arbitrado como referência, na escala de potenciais normais, é:
a) 110 V
b) 273 V
c) 0 V
d) 1 V
e) 10 V
36) Em uma pilha eletroquímica:
a) o pólo positivo é o cátodo.
b) ocorre oxidação no cátodo.
c) o potencial de oxidação do cátodo é maior que o do ânodo.
d) o potencial de redução do ânodo é maior que o do cátodo.
e) a corrente iônica ocorre através dos fios metálicos que ligam os eletrodos.
37) Dada a pilha Mg/Mg2+//Cr3+/Cr sabendo que:
Mgo/Mg2+
Eoxid. = + 2,37 V
Cro/Cr3+
Eoxid. = + 0,74 V
Podemos afirmar que:
a) o Mgo/Mg2+ é o cátodo.
b) Mgo/Mg2+ é o pólo positivo.
c) os elétrons saem de Mgo/Mg2+ e vão para Cro/Cr3+.
d) os elétrons saem de Cro/Cr3+ e vão para Mgo/Mg2+.
e) o pólo positivo é denominado de ânodo e é formado por Mgo/Mg2+.
38) Dada a pilha Mg/Mg2+//Cr3+/Cr sabendo que:
Mgo/Mg2+
Eoxid. = + 2,37 V
Cro/Cr3+
Eoxid. = + 0,74 V
O valor da ddp desta pilha é:
a) - 1,63 V
b) + 1,63 V
c) + 3,11 V
d) - 3,11 V
e) +2,52 V
39) Na célula eletroquímica Al/Al3+//Fe2+/Fe, podemos afirmar que:
a) o alumínio sofre redução.
b) o ferro é o ânodo.
c) a solução de Al3+ irá se diluir.
d) a solução de Fe2+ irá se concentrar.
e) os elétrons fluem, pelo circuito externo, do alumínio para o ferro.
40) Dadas as semi-reações:
2 Fe3+ + 2 e- 2 Fe2+
E = + 0,77 V
Cl2 + 2 e 2 Cl
E = + 1,36 V
calcule o potencial para a reação:
2 Fe2+ + Cl2 2 Fe3+ + 2 Cl- e diga se ela é espontânea ou não, assinalando a opção
correta:
a) - 0,59 V e a reação não é espontânea.
b) + 0,59 V e a reação não é espontânea.
c) + 0,59 V e a reação é espontânea.
d) - 2,13 V e a reação não é espontânea.
e) + 2,13 V e a reação é espontânea.
41) A ddp (ou fem) da seguinte pilha é: Cao/Ca2+//Pb2+/Pbo. Sabendo-se que:
Ca2+ + 2 e- Cao
E = - 2,76 V
Pb2+ + 2 e- Pbo
E = - 0,13 V
assinale a resposta correta:
a) + 2,89 V
b) + 2,63 V
c) - 2,89 V
d) - 2,63 V
e) + 2,73 V
42) Dados os potenciais de redução:
Pb2+ + 2 e- Pbo
E = - 0,13 V
3+
o
Al
+ 3 e Al
E = - 1,66 V
assinale a resposta correta que contém a ddp inicial da pilha formada pelos pares Al/Al3+ e Pb/Pb2+?
a) + 1,79 V
b) - 1,79 V
c) + 1,53 V
d) - 1,53 V
e) + 2,93 V
43) A pilha formada pelos eletrodos Alo/Al3+//Ag+/Ago
Ago Ag+ + 1 eE = - 0,80 V
Alo Al3+ + 3 eE = + 1,67 V
a) apresenta ddp igual a 0,87 V.
c) impossível, pois apresenta ddp negativa igual a - 0,87 V.
e) impossível, pois apresenta ddp negativa igual a - 4,07 V.
b) apresenta ddp igual a 2,47 V.
d) apresenta ddp igual a 4,07 V.






![a) MnBr2 b) Na2S2O3 c) O3 d) [NO3]-](http://s1.studylibpt.com/store/data/004824294_1-e6644befe23aef65a5e854b9876a94db-300x300.png)