ânions entre os reagentes. Para que ela ocorra, um
dos produtos formados deve ser:
a) Produto Insolúvel ou precipitado
PROFESSOR SOUZA
REAÇÕES INORGÂNICAS
1 - Reação de Síntese ou Adição - Reação em
que dois ou mais regentes formam um único
produto. Exemplos:
NaCl + AgNO3 →NaNO3 + AgCl
b) Produto gasoso
CaCO3 + H2SO4 CaSO4 + H2O + CO2(g)
c) Produto menos ionizável que os reagentes
HCl + NaOH → NaCl + H2O
2H2 + O2 →2H2O
Reação de Óxido-Redução
H2O + CO2 →H2CO3
2- Reações de Análise ou Decomposição Reações em que um reagente se desdobra em dois
ou mais produtos. Exemplos:
H2CO3(aq) CO2(g) + H2O(liq)
Reação de óxido-redução é uma reação
onde
ocorre
transferência
de
elétrons,
evidenciada quando um ou mais elementos
sofrem alterações em seus números de oxidação
durante a reação.
Oxidação – Fenômeno em que existe a perda de
elétrons por uma espécie química, tendo seu número
de oxidação aumentado.
Redução – Fenômeno em que existe o ganho de
elétrons por uma espécie química, tendo seu número
de oxidação diminuído.
CaCO3(s) CaO(s) + CO2(g)
a) Fotólise: Decomposição pela ação da luz.
H2O2 + luzH2O + ½ O2
b) Pirólise: Decomposição pela ação do calor.
CaCO3 CaO + CO2
c) Eletrólise:
Decomposição
passagem de corrente elétrica.
produzida
pela
NaCl(s) Na(s) + ½ Cl2(g)
Agente redutor - Espécie química que provoca a
redução de um elemento. (substância que contém o
átomo que sofreu a oxidação)
Agente oxidante - Espécie química que provoca a
oxidação de um elemento. (substância que contém
o átomo que sofreu a redução)
Vejamos: Uma lâmina de zinco mergulhada em uma
solução de sulfato de cobre.
3 - Reações de Deslocamento ou Simples
Troca – Reação em que um determinado elemento
desloca por maior reatividade outro elemento de
outra substância. Reação obrigatoriamente de
oxido redução. Exemplos:
Reatividade dos Metais
Reatividade dos Ametais
Zn + CuSO4 → ZnSO4 + C u
F > O > Cl > Br > I > S > C
Fe + 2 AgNO3 1 Fe(NO3)2 + 2 Ag
Zn
0
+ Cu
2+
→ Zn
2+
+Cu
0
F2 + 2 NaCl 2 NaF + Cl2
CONCLUSÃO
4- Reações de dupla troca – Reação de
mecanismo iônico, onde existe troca de cátions e
O zinco sofreu oxidação: perdeu elétrons e
seu número de oxidação aumentou.
O íon Cu2+ sofreu redução: recebeu elétrons e
seu número de oxidação diminuiu.
Agente Redutor: Zn
Agente Oxidante: CuSO4
Balanceamento de reções de oxi-redução
1)
Determine o número de oxidação de todos
os elementos da reação.
2)
Determine por meio do número de oxidação
quais foram os átomos que sofreram a oxidação e
redução.
3)
Colocar o número de elétrons perdidos x a
maior atomicidade do átomo oxidado como
coeficiente da substância oxidante (substância
que contém o átomo que se reduz), e o número
de elétrons recebidos x a maior atomicidade do
átomo reduzido como coeficiente da substância
redutora (substância que contém o átomo que
se oxida) da reação.
4)
Determinar os demais coeficientes da
reação pelo método da conservação dos átomos.
Regras para a determinação do nox
01) (UFPR) Balancear uma equação química é
determinar os valores dos seus coeficientes de
modo a satisfazer certas condições. Considere a
equação química não balanceada:
Cr2O72-(aq) + Fe2+(aq) + H+(aq) Cr3+(aq)
+ Fe3+(aq) + H2O(liq)
Com base no exposto, é correto afirmar que a
equação acima, quando balanceada, deve
satisfazer as condições:
01. A soma das massas dos produtos deve ser
igual à soma das massas dos reagentes.
02. O número de átomos de um elemento
químico deve ser conservado durante a reação
química.
04. O número total de íons entre os produtos
deve ser igual ao número total de íons entre os
reagentes.
08. A soma dos coeficientes dos produtos deve
ser igual à soma dos coeficientes dos reagentes.
16. A soma das cargas elétricas dos produtos
deve ser igual à soma das cargas elétricas dos
reagentes.
32. O total de elétrons cedidos pelo agente
redutor deve ser igual ao total de elétrons
recebidos pelo agente oxidante.
02) (UEPG PR)
Sobre a equação abaixo, que
representa a formação da ferrugem, assinale o
que for correto.
4 Fe
+
3 O2
2 Fe2O3
01.
O ferro metálico é reduzido para Fe3+
02.
O ferro metálico é o agente redutor.
04.
O oxigênio é oxidado.
08.
O oxigênio é um agente oxidante.
16. A soma dos estados de oxidação dos
reagentes é zero.
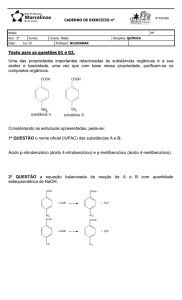
03) Na reação esquematizada pela equação,
não-balanceada:
H2O2 +KMnO4 +H2SO4 K2SO4 +MnSO4 + H2O +
O2
EXERCÍCIOS DE OXIDAÇÃO-REDUÇÃO
a)
O
peróxido
de
hidrogênio
e
o
permanganato
de
potássio
agem,
respectivamente, como oxidante e redutor.
b)
O coeficiente mínimo e inteiro do ácido
sulfúrico é 6, na equação balanceada.
c)
O manganês do permanganato de potássio
perde 5 elétrons.
d)
O manganês do permanganato de potássio
se reduz, enquanto o oxigênio do peróxido de
hidrogênio se oxida.
2ª. H2O2 + KI I2 + KOH
I.
O peróxido de hidrogênio é agente redutor
em ambas as equações.
II.
O peróxido de hidrogênio atua como
agente redutor na primeira reação e como agente
oxidante na segunda reação.
e)
O coeficiente mínimo e inteiro do peróxido
de hidrogênio é 2, na equação balanceada.
III.
O número de elétrons envolvidos na semireação do peróxido de hidrogênio na segunda
reação é 2.
04) Considere-se a equação química
balanceada representada a seguir:
IV.
A soma algébrica dos coeficientes mínimos
inteiros para a primeira reação equilibrada é 26.
MnO4 - H2O2 H
+
Mn
2+
não
H2O O2
Com base nos conhecimentos sobre reações
químicas, funções inorgânicas e fases da matéria
e considerando-se a equação acima, balanceada
com os menores coeficientes estequiométricos
inteiros, pode-se afirmar:
01.
A
soma
estequiométricos
equação é 28.
dos
menores
coeficientes
inteiros que balanceiam a
São necessários 5 mols de
com 118,9g de
MnO 4 (aq)
H (aq)
para reagir
.
08.
O MnO 4 é o agente redutor.
16.
H2O2 é um peróxido molecular.
32.
Todo oxigênio do
MnO 4 (aq)
, nessa reação,
é transformado em O2(g).
64.
a)
I, III e IV.
b) II, III e IV.
d)
I e III.
e) II e IV.
c)II e III.
06) (UFMS) O cobre metálico sofre oxidação na
presença de ácido nítrico, de acordo com a
equação
não
balanceada:
Cu HNO3 Cu(NO3 ) 2 NO H2O . A respeito dessa
reação, é correto afirmar:
02.
O volume de gás desprendido durante essa
reação, nas CNTP, é de 100 L.
04.
São corretas as afirmativas:
MnO 4 (aq) é o ânion permanganato.
05) (UEL PR)
O peróxido de hidrogênio puro é
líquido, incolor, xaroposo e muito reativo. É
comercializado como reagente químico em
solução aquosa e, dependendo da concentração,
pode ser empregado como antisséptico ou como
alvejante.
Considere as duas seguintes equações não
equilibradas, como exemplos de reações que
ocorrem ao se utilizar o peróxido de hidrogênio, e
analise as afirmativas a seguir:
1ª. H2O2 + KMnO4 + H2SO4 KHSO4 + MnSO4 +
H2SO4 + H2O + O2
01.
O cobre recebe dois elétrons.
02.
O nitrogênio é o agente oxidante.
04.
O nitrogênio sofre oxidação.
08.
O cobre é o agente redutor.
16.
A soma dos coeficientes dos reagentes e
produtos da equação é igual a 20.
07) (UEPG PR) A pessoa que é submetida ao
teste do bafômetro assopra num tubo desse
aparelho, que conduz o ar para um analisador
contendo uma solução ácida de dicromato de
potássio. Assim, se houver álcool no ar expirado,
ele é convertido em ácido acético, conforme a
equação química não-balanceada:
H3C–H2C–OH
H3C–COOH
+
+
K2Cr2O7
Cr2(SO4)3 +
+
H2SO4
K2SO4
+
H2O
Sobre esta equação, assinale o que for correto.
01.
Constitui uma reação de auto-redox.
02.
O íon cromo sofre redução.
04. A equação balanceada apresenta, em
seqüência, os seguintes coeficientes para os
reagentes: 3, 2 e 8.
08.
O Nox do carbono permanece invariável.
16.
O oxigênio do K2Cr2O7 recebe elétrons.
a) O hipoclorito de sódio atua como o redutor.
08) (UEM PR)
Dadas as equações químicas
abaixo, não balanceadas, assinale o que for
correto.
I) aKMnO4 + bFeSO4 + cH2SO4 dK2SO4 +
eMnSO4 + fFe2(SO4)3 + gH2O
II) aK2Cr2O7 + bNa2C2O4 + cH2SO4 dK2SO4 +
eCr2(SO4)3 + fNa2SO4 + gH2O + hCO2
01. Na equação I, o agente oxidante é o KMnO4
e o número de oxidação do potássio varia de +7
para +2.
b) O ferro sofre uma oxidação.
c) A soma dos coeficientes das substâncias que
participam da reação é igual a 9.
d) O átomo de cloro do hipoclorito de sódio
ganhou 2 elétrons.
11) (UFPEL) Considerando ambas as reações
(combustão do etanol e a ocorrida no bafômetro),
é correto afirmar que:
02. Na equação II, o número de oxidação do
cromo passa de +6, no K2Cr2O7, para +3, no
Cr2(SO4)3.
04. Na equação II, o carbono é oxidado de +3
para +4.
08. Na equação I, o agente redutor é o sulfato
ferroso e o número de oxidação do ferro varia de
+2 para +3.
a) em ambas, os átomos de oxigênio se reduzem
e os de carbono se oxidam.
16. O somatório dos coeficientes a, b, c, d, e, f,
g e h na equação II, em menores números
inteiros, é 58.
b) na combustão, os átomos que se reduzem são
os de oxigênio e, na reação do bafômetro, os de
cromo.
09) (UNIOESTE-PR) Com relação a reação
química mostrada abaixo podemos afirmar que:
CuSO4 (aq) + Fe (s)
FeSO4 (aq) + Cu (s)
a) O cobre e oxidado.
b) O ferro e reduzido.
c) A variação do numero de oxidação do enxofre e
de +6 a +4.
d) CuSO4 e o agente oxidante.
e) A variação do numero de oxidação do ferro e
de +2 a zero.
10) Em um laboratório, um grupo de estudantes
colocou um pedaço de palha de aço em um prato
cobrindo-o com água sanitária. Após 10 minutos,
eles observaram, no fundo do prato, a formação
de uma nova substância de cor avermelhada, cuja
fórmula é Fe2O3.
A reação que originou esse composto ocorreu
entre o ferro (Fe) e o hipoclorito de sódio
(NaClO), presentes na água sanitária, e pode ser
representada
pela
seguinte
equação
nãobalanceada:
informações,
d) na combustão, os átomos que se oxidam são os
de oxigênio e, na reação do bafômetro, os de
cromo.
e) na combustão, os átomos que se oxidam são os
de carbono e, na reação do bafômetro, os de
cromo.
12) As afirmações a seguir são relativas às reações
de oxirredução:
I - Oxidação é ganho de elétrons, e redução, perda
de elétrons.
II - Elemento oxidante é o responsável pela
oxidação e, portanto, é aquele cujo número de
oxidação aumenta.
III - O número de elétrons cedidos pelo redutor é
igual ao número de elétrons ganhos pelo oxidante.
IV - O elemento reduzido recebe elétrons.
Assinale as alternativas VERDADEIRAS:
Fe(s) + NaClO(aq) → Fe2O3(s) + NaCl(aq)
Considerando-se
essas
INCORRETO afirmar:
c) em ambas, os átomos de carbono se reduzem e
os de oxigênio se oxidam.
é
a) somente I e II.
b) somente I, III e IV.
c) somente II, III e IV.
d) somente III e IV.
13) A imersão de um fio de cobre num recipiente
contendo solução aquosa de cloreto de mercúrio
(II) provoca, depois de algum tempo, o
aparecimento de gotículas de um líquido de brilho
metálico no fundo do recipiente, e a solução que
era inicialmente incolor adquire coloração
azulada.
a) Explique o que ocorreu do ponto de vista do
químico.
b) Escreva a reação do processo, identificando os
produtos formados.
14) Na reação esquematizada pela equação, nãobalanceada:
H2O2 + KMnO4 + H2SO4 K2SO4 + MnSO4 + H2O
+ O2
16.
Ocorre uma reação de deslocamento, que
permite a formação do composto ZnSO4(aq).
16) As reações químicas
I. AgNO3
II. 2 Mg(s)
(aq)
+ NaCl(aq) AgCl(s) + NaNO3(aq)
+
III. C12H22O11(s)
O2(g)
12 C(s)
2 MgO(s)
+
11 H2O(l)
IV. 2 HCl(aq) + Ba(OH)2(aq) BaCl2(aq) + 2 H2O(l)
Podem ser classificadas, respectivamente, como:
a)
reação
de
óxido-redução,
reação de
combustão, reação de decomposição, reação de
precipitação.
b)
reação
decomposição,
precipitação.
de
neutralização,
reação
reação de síntese, reação
de
de
a)
O peróxido de hidrogênio e o permanganato
de potássio agem, respectivamente, como
oxidante e redutor.
c)
reação
de
precipitação,
reação
de
combustão, reação de decomposição, reação de
óxido-redução.
b)
O coeficiente mínimo e inteiro do ácido
sulfúrico é 6, na equação balanceada.
d)
reação de precipitação, reação de óxidoredução, reação de decomposição, reação de
neutralização.
c)
O manganês do permanganato de potássio
perde 5 elétrons.
d)
O manganês do permanganato de potássio
se reduz, enquanto o oxigênio do peróxido de
hidrogênio se oxida.
e)
O coeficiente mínimo e inteiro do peróxido
de hidrogênio é 2, na equação balanceada.
15) Uma placa de zinco foi totalmente mergulhada
em um recipiente contendo 50 mL de solução 4,5
molL–1 de ácido sulfúrico, à temperatura ambiente.
Observou-se,
inicialmente,
que
havia
o
desprendimento de bolhas da superfície da placa e,
após algumas horas, que a placa havia sido
totalmente consumida. Sobre o experimento
descrito, assinale o que for correto.
e)
reação de condensação, reação de óxidoredução, reação de combustão, reação de
neutralização.
17) Em um processo de avaliação experimental,
um
aluno
recebeu
4
rótulos
contendo,
separadamente, informações sobre os seguintes
reagentes: Fe(NO3)2, AgNO3, KCl e Na2CO3.
Recebeu, também, 4 frascos cada um contendo um
desses reagentes, porém, sem identificação. Com o
objetivo de rotulá-los adequadamente, o aluno
numerou-os de 1 a 4, conforme figura a seguir, e
fez alguns testes com amostras das soluções de
cada frasco, obtendo as seguintes informações:
01.
O zinco metálico foi oxidado e liberado na
forma de vapor.
I. Com a adição de ácido clorídrico, houve
desprendimento de gás na amostra do frasco 1 e
formação de um precipitado na amostra do frasco
2.
02.
O processo de dissolução da placa metálica
em ácido forte é um fenômeno físico.
II. Com adição de cloreto de sódio, observou
formação de precipitado na amostra do frasco 2.
04.
Na reação entre a placa e o ácido ocorre
variação do nox do zinco, que passa de (0) a (+2).
III. Com adição de hidróxido de sódio, observou
formação de precipitado nas amostras dos frascos
2 e 4.
08.
As bolhas observadas se devem à formação
e desprendimento de H2(g).
IV. Com a adição de ácido clorídrico, cloreto de
sódio e hidróxido de sódio, nenhuma reação de
precipitação ocorreu em amostras do frasco 3.
I.
A substância contida no frasco 1 reagiu com
a substância contida no frasco 4, produzindo
efervescência.
De acordo com os resultados dos testes realizados,
os frascos 1, 2, 3 e 4 contêm, respectivamente:
II.
a) Fe(NO3)2, AgNO3, KCl, Na2CO3
Com base nos dois experimentos realizados, é
correto afirmar que os frascos 1, 2, 3 e 4 contêm,
respectivamente, soluções aquosas de:
b) Na2CO3 , AgNO3 , Fe(NO3)2, KCl
c) KCl, Na2CO3 , Fe(NO3)2 , AgNO3
A substância contida no frasco 1 não reagiu
com a substância contida no frasco 3.
a)
Ácido clorídrico, nitrato de prata, cloreto
férrico e carbonato de sódio.
d) Na2CO3 , AgNO3 , KCl, Fe(NO3)2
e) Fe(NO3)2 , KCl, AgNO3 , Na2CO3
b)
Cloreto férrico, ácido clorídrico, nitrato de
prata e carbonato de sódio.
18) Verifique as equações abaixo e assinale a
alternativa que indica somente aquelas que
representam reações que realmente ocorrem
espontaneamente:
c)
Ácido clorídrico, cloreto férrico, nitrato de
prata e carbonato de sódio.
I.
2 Ag + 2 HCl 2 AgCl + H2
e)
Carbonato de sódio, cloreto férrico, nitrato
de prata e ácido clorídrico.
II.
Mg + 2 HCl MgCl2 + H2
III.
2 Al + 6 HCl 2 AlCl3 + 3 H2
IV.
Al + 3 KCl AlCl3 + 3 K
V.
Cu + MgCl2 2 CuCl2 + Mg
a)
somente I e IV
c)
I, II e V
e)
I, II, IV e V
b) somente II e III.
d)
II, IV e V
19) A reação de hidratação de um certo óxido é
representada pela equação: X2O + H2O 2 XOH,
onde X é um elemento desconhecido.
a)
d)
Ácido clorídrico, nitrato de prata, carbonato
de sódio e cloreto férrico.
Classifique o óxido X20.
b)
A reação de neutralização de XOH com um
acido produz sal e água. Sabendo que 112g de
XOH reagem com 73g de ácido clorídrico,
apresente o nome do sal formado nesta
neutralização.
20) Em uma bancada de laboratório encontram-se
4 frascos, numerados de 1 a 4. Cada um deles
contém apenas uma das quatro soluções aquosas
das seguintes substâncias: nitrato de prata
(AgNO3), cloreto férrico (FeCl 3), carbonato de sódio
(Na2CO3)
e
ácido
clorídrico
(HCl),
não
necessariamente na ordem apresentada. Um
estudante, com o objetivo de descobrir o conteúdo
de cada frasco, realizou alguns experimentos no
laboratório de química, à temperatura ambiente, e
verificou que:
GABARITO
01)
02)
03)
04)
05)
06)
07)
08)
09)
10)
11)
12)
13)
14)
15)
16)
17)
18)
19)
20)
V-V-F-F-V-V
26
D
01 + 16 + 64
C
24
06
14
D
A
B
D
a) Reação de deslocamento
b) HgCl2 + Cu → CuCl2 + Hg
CuCl2 - cloreto de cobre II (azul)
Hg - mercúrio metálico
D
28
D
D
B
a) Óxido básico
b) KCl
A