Provas de anos anteriores - 2011 e 2012
2011
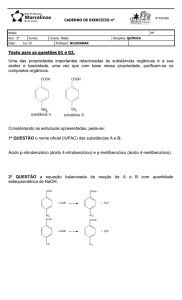
1. (PUCRJ-2010) Considere o aquecimento de óxido de estanho na presença de gás hidrogênio para
formar o metal estanho e vapor de água, como mostrado na equação balanceada que descreve
essa reação de oxirredução:
SnO2(s) + 2H2(g) = Sn(s) + 2H2O(g)
Sobre essa reação, está correto afirmar que
a) o estanho se oxida, pois ganha elétrons do oxigênio.
b) o oxigênio cede dois elétrons para o hidrogênio.
c) o hidrogênio se oxida ao perder elétrons para o estanho.
d) o oxigênio se reduz ao ganhar elétrons do hidrogênio.
e) os números de oxidação de hidrogênio, estanho e oxigênio não se alteram.
2. (UFRGS-2010) Em fogo provocado por sódio metálico não devem ser utilizados extintores de
incêndio à base de gás carbônico, pois esse gás pode reagir com o metal aquecido, conforme a
equação química a seguir.
4 Na + 3 CO2 2 Na2CO3 + C
Assinale a afirmação correta sobre essa reação e as substâncias nela envolvidas.
a) Essa é uma reação de auto-oxirredução.
b) Na reação, os átomos de sódio sofrem oxidação, enquanto a totalidade dos átomos de oxigênio
sofre redução.
c) No sódio metálico, os átomos de sódio apresentam estado de oxidação + 1.
d) Na reação, a totalidade dos átomos de carbono sofre redução.
e) Os átomos de carbono presentes no CO2 apresentam o mesmo estado de oxidação que os
átomos de carbono presentes no Na2CO3.
3. (ITA-2010-modificada) A seguinte reação não balanceada e incompleta ocorre em meio ácido:
(Cr2O7)2─ + (C2O4)2─ + H1+ = Cr3+ + CO2 + H2O
A soma dos coeficientes estequiométricos da reação completa e balanceada é igual a
a) 11.
b) 22.
c) 33.
d) 44.
e) 55.
4. (UFF-2010) Na presença de ar úmido ou de água que contém Oxigênio dissolvido, o Ferro é
transformado num produto denominado ferrugem que não tem fórmula conhecida, mas que pode
ser representada por Fe2O3 • xH2O.
A reação que se processa é:
2Fe + 3/2 O2 + xH2O Fe2O3 • xH2O
A ferrugem formada não adere à superfície do Ferro, mas separa-se na forma de flocos, deixando
o metal exposto o que permite a continuação da reação. À medida que o Ferro vai se
transformando em ferrugem, ele vai sofrendo corrosão. No caso de outros metais, quando
expostos ao ar úmido, também ocorre reação semelhante, mas os óxidos formados aderem à
superfície do metal e produzem uma película que protege o material.
Considerando essa reação do Ferro, pode-se afirmar que:
a) o produto da reação é o óxido ferroso hidratado.
b) o Oxigênio sofre um processo de redução.
c) o Ferro sofre um processo de redução.
d) a água sofre um processo de oxidação.
e) o óxido hidratado formado é classificado como um óxido neutro.
5. (UNESP-2010) A hidrazina (N2H4) e o tetróxido de dinitrogênio (N2O4) formam uma mistura
autoignitora que tem sido utilizada em propulsores de foguetes. Os produtos da reação são
nitrogênio e água. Forneça a equação química balanceada para essa reação e a estrutura de Lewis
para a molécula do reagente redutor.
6. (UFRJ-2008) A análise da água de uma lagoa revelou a existência de duas camadas com
composições químicas diferentes, como mostra o desenho a seguir.
Indique o número de oxidação do nitrogênio em cada uma das camadas da lagoa e apresente a
razão pela qual alguns elementos exibem diferença de NOx entre as camadas.
7. (UEG-2007) Considere o processo de obtenção do fluoreto de potássio representado a seguir e
responda ao que se pede.
KMnO4 + HF KF + MnF2 + H2O + F2
a) Pelo método de oxidação e redução, obtenha os coeficientes para os compostos da reação, de
forma que ela fique devidamente balanceada.
b) Indique os agentes oxidante e redutor na reação.
2012
1. (VUNESP) - A bateria de níquel-cádmio (pilha seca), usada rotineiramente em dispositivos
eletrônicos, apresenta a seguinte reação de oxirredução
Cd(s) + NiO2(s) + 2 H2O(ℓ) = Cd(OH)2(s) + Ni(OH)2(s)
O agente oxidante e o agente redutor dessa reação, respectivamente, são:
a) H2O , Cd OH2 s
b) NiO2 s , Cd OH2 s
c) NiO2 s , Cd s
d) Cd s , Cd OH2 s
e) NiO2 s , Ni OH2 s
2. (ESPCEX - AMAN) - Dada a seguinte equação de óxido-redução:
Cr(OH)3(aq) + IO31−(aq) + OH1−(aq) = CrO42−(aq) + I1−(aq) + H2O(ℓ)
Considerando o método de balanceamento de equações químicas por oxirredução, a soma total
dos coeficientes mínimos e inteiros das espécies envolvidas, após o balanceamento da equação
iônica, e o agente oxidante são, respectivamente,
a) 15 e o íon iodato.
b) 12 e o hidróxido de crômio.
c) 12 e o íon hidroxila.
d) 11 e a água.
e) 10 e o íon hidroxila.
3. (UERJ) - A ferrugem contém uma substância que é formada pela reação do oxigênio do ar com o
ferro presente em uma superfície metálica. Esse processo pode ser representado pela seguinte
equação química:
4 Fe(s) + 3 O2(g) = 2 Fe2O3(s)
Nesse processo, o oxigênio sofre a transformação química denominada:
a) redução
b) oxidação
c) esterificação
d) neutralização
4. (UFPR-modificada) - Um dos principais mecanismos de degradação de compostos orgânicos
(aqui representado pela forma genérica de hidrato de carbono “CH2O”) em ambientes na
ausência de oxigênio é expresso pela equação química não-balanceada abaixo:
CH2O + SO42− + H1+ = CO2 + HS1− + H2O
Com base nas informações fornecidas, considere as seguintes afirmativas:
1. O agente oxidante da reação é SO42−.
2. O agente redutor da reação é H1+.
3. O número de oxidação do elemento enxofre no íon HS 1− é igual a +2.
4. A reação acima é de oxirredução na forma iônica.
5. A equação corretamente balanceada é:
2CH2O + SO42− + H1+ = 2CO2 + HS1− + 2H2O
Assinale a alternativa correta.
a) Somente as afirmativas 3 e 5 são verdadeiras.
b) Somente as afirmativas 1, 3 e 4 são verdadeiras.
c) Somente as afirmativas 1, 2 e 3 são verdadeiras.
d) Somente as afirmativas 1, 4 e 5 são verdadeiras.
e) Somente as afirmativas 2, 4 e 5 são verdadeiras.
5. (UFU-modificada) - Um dos problemas do crescimento das cidades é a distribuição de água
tratada para todos os seus moradores. Para o tratamento da água, pode-se utilizar o gás cloro
borbulhado diretamente nos tanques d’água em tratamento. Na produção desse gás em
laboratório, promove-se uma reação do ácido clorídrico aquoso (HCℓ) com dióxido de manganês
sólido (MnO2), formando o cloro gasoso (Cℓ2), o óxido de manganês (MnO) e água, de acordo
com o esquema abaixo.
A partir das informações extraídas do texto e de seus conhecimentos em Química, responda o que
se pede.
a) Escreva a equação balanceada de formação do gás cloro a partir do dióxido de manganês e do
ácido clorídrico.
b) Identifique o agente oxidante e o agente redutor.
6. (VUNESP-modificada) - A hidrazina (N2H4) e o tetróxido de dinitrogênio (N2O4) formam uma
mistura autoignitora que tem sido utilizada em propulsores de foguetes. Os produtos da reação
são nitrogênio e água. Forneça a equação química balanceada para essa reação e a estrutura de
Lewis (fórmula eletrônica) para a molécula do reagente redutor.
7. (UFRJ-modificada) O Fósforo pode ser produzido industrialmente por meio de um processo
eletrotérmico no qual fosfato de cálcio é inicialmente misturado com areia e carvão; em seguida,
essa mistura é aquecida em um forno elétrico onde se dá a reação representada a seguir:
Ca3(PO4)2 + 3SiO2 + 5C
3CaSiO3 + 5CO + P2
a) Calcule a variação do número de oxidação do elemento que sofre redução.
b) Determine a quantidade máxima, em mols, de fósforo formado quando são colocados para
reagir 8 mols de Ca3(PO4)2.