USO DE PROVAS BIOQUÍMICAS PARA CARACTERIZAÇÃO DAS BACTÉRIAS:
Shigella sp, Proteus sp, Streptococcus sp e Citrobacter sp
2000
INTRODUÇÃO
Alguns microorganismos para poderem crescer utilizam moléculas orgânicas e
inorgânicas como fonte de carbono e energia (Lieber, 2000).
Os nucleotídeos geralmente não conseguem penetrar em quantidades
apreciáveis, porém, a matéria orgânica presente nos mais variáveis meios é
predominantemente macromolecular. Existe, portanto, a necessidade de uma hidrólise
extracelular, obtida através de exoenzimas, as quais são lançadas ao meio sob a
forma de enzimas extracelulares. Essas enzimas compreendem proteases e
peptidases; polissacaridases (amilase, celulase, pectinase); nucleases, lipases e
fosfolipase. A formação de proteases, pode ser reprimida pela concentração elevada
de aminoácidos do meio (Pelczar, 1996).
Além da quebra de moléculas através de suas enzimas celulares, alguns
microorganismos dependem, para que possam realizar a metabolização das
substâncias citadas acima, da presença de um meio que permita que elas penetrem
na célula, uma vez que é no interior delas que ocorre essa metabolização das
moléculas pela ação das endoenzimas. Isto porque, a membrana plasmática
representa uma barreira que isola o interior da célula do meio ambiente, permitindo
uma passagem seletiva de substâncias, portanto, a presença de proteínas é de vital
importância no metabolismo bacteriano.
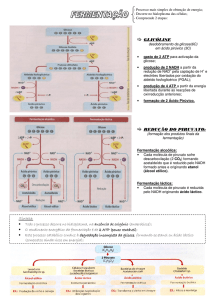
O catabolismo é a fase degradativa do metabolismo, onde moléculas e
nutrientes relativamente grandes e complexos, como os carboidratos, lipídeos e
proteínas, provenientes do meio ambiente celular ou de seus próprios depósitos de
nutrientes, são degradados com objetivo de produzir moléculas menores e mais
simples, tais como o ácido lático, o ácido acético, a amônia e a uréia.
Os diversos microorganismos comportam-se de diferentes maneiras em relação
aos substratos, sendo que alguns atacam determinado açúcar, e outros são capazes
de produzir ou não diferentes produtos resultantes do catabolismo de aminoácidos. O
fato de alguns deles utilizarem ou não certos tipos de nutrientes é de grande utilidade
para o microbiologista na identificação do microorganismo (Lieber, 2000).
Os carboidratos ou sacarídeos são simplesmente definidos como
poliidroxialdeidos ou cetonas e seus derivados. Os monossacarídeos, também
chamados de açúcares simples, consistem em uma só unidade poliidroxialdeidica ou
cetônica. Já os oligossacarídeos contem de duas a dez unidades de monossacarídeos
unidas por longas cadeias lineares ou ramificadas.
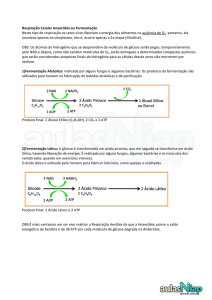
Para se estudar a fermentação de carboidratos, utiliza-se o meio liquido purple
broth, que consiste em um meio originalmente sem carboidratos o qual se adiciona
1% do açúcar em estudo. Esse meio contém um indicador de pH correspondente a
6,8. A fermentação do açúcar é evidenciada pela alteração do meio; pois no caso da
produção de ácidos, o meio passa de purpura para amarelo. A presença de CO2 pode
ser evidenciada pela observação de gás no tubo de Durhan invertido.
O meio TSI (Triple Sugar Iron), permite a prova de fermentação de carboidratos
e catabolismo protéico, pois este meio possui vermelho de fenol como indicador de pH
e, sulfato ferroso que indica a presença de H2S através da formação de um precipitado
preto. A produção de CO2 resultante da fermentação pode ser observada através da
presença de rachaduras ou elevação do ágar.
Neste meio, a glicose é adicionada em menor quantidade do que os outros
açúcares e, quando os microorganismos fermentam a glicose, tanto a base como a
superfície do meio ficam amareladas. como a superfície do tubo tem oxigênio em
grande quantidade, o microorganismo permanece em crescimento e catabolizando as
peptonas presentes, produzindo produtos alcalinos que levam a alteração no meio
para róseo. Nesse caso, a base do tubo permanece amarela, pois o crescimento
ocorre apenas anaerobicamente. Se o microorganismo for capaz de fermentar a
lactose ou a sacarose, a quantidade de ácidos produzidos será muito maior, chegando
a superar os produtos alcalinos da superfície produzidos em conjunções de aerobiose,
tornando todo o meio amarelo. Ao ser degradada, a sacarose resulta em glicose e
frutose, o que leva a um aumento do teor de glicose no tubo que fica mais ácido.
A semeadura em ágar MacConkey, é um meio seletivo diferencial, pois permite
detectar as colônias que fermentam lactose, apresentando coloração vermelho-tijolo
quando isso ocorre. Este meio nos permite diferenciar a bactéria é gram-positiva da
gram-negativa, pois inibe o crescimento de bactérias gram-positivas (Lieber, 2000)
O Enterokit é composto por três diferentes meios:
Meio MILI ( meio solidificado) que contém os testes de motilidade, indol e
lisina;
Meio EPM (ágar inclinado, que contém os testes de fermentação , produção
de gás glicose, H2S hidrólise da uréia e desanimação do triptofano. Algumas bactérias
são capazes de converter o triptofano em indol pela triptofanase e a presença de indol
pode ser detectada pela adição de reativo de KOVACS que torna vermelha a
superfície do meio;
Meio CIT ( meio sintético) que contém citrato de Simmons como única fonte de
carbono e azul bromo tinol como indicador de pH que se torna azul escuro em pH
maior que 7,6 ( quando há produção de amônia. Se o microorganismo for capaz de
utilizar o citrato, o meio permanece inalterado.
OBJETIVOS
Evidenciar através do metabolismo bacteriano, a fermentação de carboidratos, o
catabolismo de proteínas e a utilização de substratos inorgânicos por meio de prova
bioquímicas, utilizando-se de meios seletivos, diferenciais e sintéticos, indicadores de
pH, produção de ácido e gás e motilidade nas bactérias Proteus sp, Shigella sp,
Citrobacter sp e Streptococcus sp.
METODOLOGIA
Prova de fermentação de carboidratos em meio líquido: Purple Broth Base
Com o auxílio de uma alça bacteriológica, devidamente esterilizada, transferiu-se
um inóculo das soluções com cada um dos microorganismos estudados para
diferentes tubos de ensaio contendo, em cada um, glicose, sacarose e lactose. Em
seguida, os tubos foram encubados em estufa à 37 º C e os resultados obtidos
analisados após os períodos de 24 e 48 horas seguintes à incubação.
Prova de fermentação de carboidratos e catabolismo protéico em meio TSI
Foram incubados com o auxílio da agulha bacteriológica esterilizada, com os
diferentes microorganismos estudados. A semeação do meio foi feita através de uma
picada com agulha bacteriológica no meio, seguida da formação de estrias na
superfície. Os meios foram incubados a 37ºC e os resultados colhidos nos intervalos
de 24 e 48 h após o procedimento.
Provas metabólicas utilizando-se a bactéria de Enterokit B ( meios MILI, CIT e
EPM)
Inicialmente foi retirado um inóculo do meio contendo os microorganismos em
estudos com o auxílio da agulha bacteriológica estéril. Este inóculo foi então semeado
primeiro no meio EPM onde foi feita uma picada até o fundo do tubo e estriação da
superfície. Em seguida, semeou-se o meio MILI com uma picada até o fundo, sem a
estriação na superfície e sem reintroduzir a agulha na cultura bacteriana. Por fim, a
mesma agulha foi utilizada para semear o meio CIT, que recebeu apenas um risco
central em sua superfície. Os meios foram incubados a 37ºC e os resultados
observados 24 e 48h após o procedimento.
Semeadura em placa de isolamento contendo ágar MacConkey
Primeiramente foi feito o isolamento das colônias seguindo-se o método de
esgotamento de inóculo por estrias sucessivas no meio; em seguida o meio foi
incubado a 37ºC e os resultados observados 24 e 48h após o procedimento.
OBS: É importante ressaltar que durante esta aula, cada grupo de alunos ficou
responsável pelas provas bioquímicas de uma espécie de bactéria.
RESULTADOS
Streptococcus sp
A prova de fermentação de carboidratos em meio Purple Broth apresentou
crescimento , bacteriano nos três meios (glicose, sacarose e lactose), tornando os
meios amarelados, sem liberação de gases.
Na prova de fermentação de carboidratos e catabolismo protéico em meio TSI
ocorreu crescimento bacteriano tanto na base quando na superfície, mas não houve
produção de gases.
No meio EPM, a presença de coloração esverdeada mostrou a presença de
urease e uma coloração azulada em 48 horas mostrou a presença de LTD.
No meio MILI, houve crescimento bacteriano perpendicular a picada,
descarboxilação da lisina e a superfície tornou-se vermelha ao utilizar o reativo de
KOVACS.
O meio CIT, não apresentou crescimento bacteriano em presença do citrato e
não houve formação de colônias no meio ágar MacConkey.
Shigella sp
Na prova de fermentação por meio Purple Broth houve alteração de pH tornando
a coloração meio amarela, com desprendimento de gás (CO2) e produção de ácido
nos três meios diferentes.
Na prova de fermentação de carboidratos e catabolismo protéico apresentou
crescimento na superfície sem a presença de gases.
No meio EPM, ocorreu a presença uma de coloração amarelada no fundo e
esverdeada em 24 horas evidenciando a presença de LTD.
No meio MILI, houve crescimento bacteriano perpendicular a picada,
descarboxilação da lisina (meio ficou roxo) e a superfície tornou-se amarela ao utilizar
o reativo de KOVACS.
O meio CIT, não apresentou crescimento bacteriano em presença do citrato
Houve a formação de colônias no meio ágar MacConkey, com formação de
halos cor de laranja ao redor dos colônias.
Proteus sp
Em meio Purple Broth ocorreu o crescimento bacteriano apenas no meio
contendo glicose, com desprendimento de gás.
No meio TSI não foram observadas alterações no meio. A base apresentou
coloração preta e houve desprendimento de H2S.
No meio EPM houve a presença de um precipitado preto, indicando
desprendimento de gás e a produção de LTD, mas não ocorreu a fermentação da
glicose. No meio MILI observou-se motilidade e na presença do reativo de KOVACS o
meio ficou vermelho. Em meio CIT a bactéria não cresceu no citrato.
No ágar MacConkey não houve o crescimento de colônias.
Não foram observados os resultados de Citrobacter sp.
DISCUSSÃO E CONCLUSÃO
Ao analisar os resultados, obtidos no teste de fermentação de carboidratos em
meio Purple Broth Base, foi possível observar que as bactérias Proteus sp, Shigella
sp e Streptococcus sp cresceram no meio contendo glicose pois houve alteração de
coloração do meio devido a fermentação de glicose seguida da alteração de ácidos
que alteram o pH. Pelczar (1996) afirma que a glicose possui a maior fonte de carbono
para muitos organismos e todas as bactérias utilizadas possuem genes que codificam
a glicose.
A utilização da lactose pelos microorganismos também corresponde à literatura,
pois segundo Pelczar (1996), as bactérias que utilizam a lactose apresentam um gene
que codifica tal síntese. Sabendo-se que a lactose é constituída de glicose e
galactose, todas as bactérias que utilizam a lactose podem utilizar a glicose, mais o
inverso nem sempre é verdadeiro.
A desaminação do triptofano, observada através da coloração verde no meio, foi
observada na Streptococcus sp em 48 horas.
A presença de crescimento transversal evidencia motilidade por presença de
flagelo, resultado esse que de acordo com a literatura deveria ser positivo para todas
as bactérias, como pode ser comprovado nas culturas de Proteus sp, Shigella sp e
Streptococcus sp .
A conversão do triptofano em indol pela ação da triptofanase foi observada em
todas as bactérias.
A utilização de amônia e citrato se dá pela coloração azul escuro do meio e mas
este fato não foi observado nos experimentos.
Segundo Pelczar (1996) a utilização de carboidratos na fermentação leva à
produção de ácidos orgânicos que alteram o meio e CO2 que promove o aparecimento
de gás no tubo de Durhan invertido, fato este observado nos experimentos com
Shigella sp.
Os resultados obtidos no meio TSI levaram a concluir que Streptococcus sp é
anaeróbia facultativa, pois apresentou crescimento tanto na base como na superfície
do tubo. Essas bactérias fazem respiração aeróbica a presença de oxigênio, mas em
sua ausência realizam respiração anaeróbica ou fermentação.
Já a Shigella sp apresentou crescimento na base e na superfície do tubo, fato
não confirmado pela literatura, pois esta é uma bactéria anaeróbica, que realiza
respiração a partir da oxidação de compostos químicos orgânicos ou inorgânicos, com
ausência de oxigênio e portanto deveria crescer apenas na base do tubo, onde não
ocorre a presença de oxigênio,
Quanto ao meio seletivo contendo ágar MacConkey, Proteus sp, Shigella sp e
Streptococcus sp não fermentam a lactose ficaram incolores. Além disso, este meio
inibe o crescimento das bactérias gram-positivas devido a presença de sais biliares e
violeta genciana, como observado em Shigella sp e Streptococcus sp.
Com relação ao Enterokit a bactéria Shigella sp utilizou a glicose na
fermentação, o que não foi observado as outras. Proteus sp, no meio EPM e Shigella
sp, no meio CIT produziram H2S, confirmado pela presença de um pequeno
precipitado preto.
A desaminação do triptofano, observada através da coloração verde no meio foi
observada em Proteus sp, Shigella sp e Streptococcus sp .
A conversão do triptofano em indol foi observado em Proteus sp, Shigella sp e
Streptococcus sp, confirmando Pelczar, que afirma que todas as bactérias deveriam
apresentar este resultado.
A utilização de amônia e citrato se dá pela coloração azul escuro do meio e
deveria ter sido observada em todas as bactérias, fato que não ocorreu nos
experimentos.
BIBLIOGRAFIA
PELCZAR, G. & MICHEL J.
Macron Books.
1996. Microbiologia: conceitos e aplicações. Vol. I.
JAWETZ, E. ;MELNICK, J. L. & ALDEBERG, E. A.. 1984. Microbiologia Médica. Vol
II. Guanabara Koogan.
LIEBER, S. R.
2000. Roteiro de aula prática 09: Metabolismo bacteriano.