P6. Determinação da temperatura de desnaturação (Tm) e do
conteúdo G+C de um ácido desoxirribonucleico
A desnaturação de ácidos nucleicos é acompanhado por um aumento da absorvância no comprimento
de onda a 260 nm. Este aumento de absorvância é denominado por “Efeito hipercrómico”, o qual devese à separação das bases de cadeias complementares. Esta separação (desnaturação) permite uma maior
absorção de fotões de radiação ultravioleta pelas orbitais das bases, que já não se encontram
“emparelhadas” com as respectivas bases complementares. Existem vários métodos para promover a
desnaturação de ácidos nucleicos, nomeadamente por aquecimento, aumento de pH, métodos químicos
(por ex., utilização de formaldeído que promove a formação de bases Schiff, as quais, por sua vez,
impedem a formação de pontes de hidrogénio), adição de formamida e abaixamento da força iónica.
No entanto, o método mais utilizado é indubitavelmente através do aumento da temperatura da amostra
do ácido nucleico.
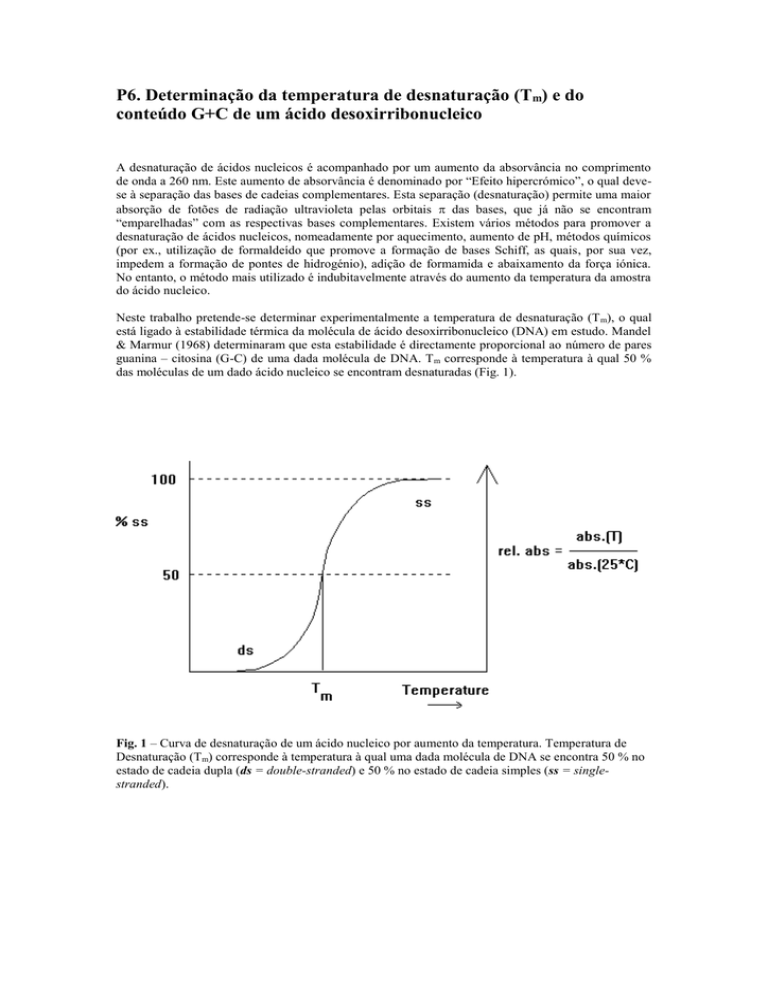
Neste trabalho pretende-se determinar experimentalmente a temperatura de desnaturação (T m), o qual
está ligado à estabilidade térmica da molécula de ácido desoxirribonucleico (DNA) em estudo. Mandel
& Marmur (1968) determinaram que esta estabilidade é directamente proporcional ao número de pares
guanina – citosina (G-C) de uma dada molécula de DNA. T m corresponde à temperatura à qual 50 %
das moléculas de um dado ácido nucleico se encontram desnaturadas (Fig. 1).
Fig. 1 – Curva de desnaturação de um ácido nucleico por aumento da temperatura. Temperatura de
Desnaturação (Tm) corresponde à temperatura à qual uma dada molécula de DNA se encontra 50 % no
estado de cadeia dupla (ds = double-stranded) e 50 % no estado de cadeia simples (ss = singlestranded).
Procedimento experimental
1) Prepare uma solução de SSC (NaCl 0,15 M; Citrato de sódio 0.015 M; pH = 7,0).
2) Dissolva a sua amostra de DNA em SSC de modo a obter uma concentração final de 20 µg mL -1.
3) Coloque a sua amostra em uma célula e tape-a com Parafilm. Verifique que a membrana plástica que
colocou como tampa não interfere nas leituras espectrofotométricas a realizar.
4) Calibre o espectrofotómetro com a respectiva solução de referência (branco) a um comprimento de
onda de 260 nm.
5) Coloque as células com a sua amostra e o branco num banho a 25ºC.
6) Aguarde alguns minutos para que seja atingido o equilíbrio térmico entre o exterior e o interior das
células.
7) Seque o exterior das células do branco e da amostra; calibre novamente o espectrofotómetro com o
branco e leia a absorvância da sua amostra. Este passo deve ser feito o mais rapidamente possível
para impedir que as amostras arrefeçam.
8) Coloque novamente as células no banho.
9) Aumente a temperatura para 50ºC e repita os passos 6-8.
10) Repita o passo 9 para as seguintes temperaturas: 60, 65, 70, 75, 80ºC.
11) Aumente, sucessivamente, a temperatura 2ºC até observar um aumento da absorvância, repetindo
os passos 6-8; quando a absorvância começar a aumentar, faça leituras aumentando a temperatura em
apenas 1ºC.
12) Corrija os valores de absorvância devido à expansão do solvente em relação ao valor obtido a 25ºC,
usando os valores da Tabela 1. Estes valores são designados por At (A = absorvância; t = temperatura).
13) Elabore um gráfico em que o eixo das abcissas corresponde à temperatura em ºC e o eixo das
ordenadas, à razão At / A25.
14) Determine o Tm das respectivas amostras de DNA. Determine também o conteúdo G+C da sua
amostra utilizando a seguinte fórmula:
%GC = 2,44 (Tm – 69,3)
Bibliografia:
Mandel, M. & J. Marmur. (1968). Use of ultraviolet absorbance-temperature profile for determining
the guanine plus cytosine content of DNA. Methods Enzymol. 12(B):195-206.
Tabela 1 – Quociente entre o volume de água a uma dada temperatura (Vt)
em relação ao volume de água a 25ºC (V25).
Temperatura (ºC)
Vt / V25
Temperatura (ºC)
Vt / V25
25
26
27
28
29
30
31
32
33
34
35
36
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
1,0000
1,0003
1,0005
1,0008
1,0011
1,0014
1,0017
1,0020
1,0024
1,0027
1,0030
1,0034
1,0037
1,0041
1,0045
1,0049
1,0053
1,0057
1,0061
1,0065
1,0069
1,0073
1,0078
1,0082
1,0087
1,0091
1,0096
1,0100
1,0105
1,0110
1,0115
1,0120
1,0125
1,0131
1,0135
1,0141
1,0146
1,0152
1,0157
1,0162
1,0168
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
87
88
89
90
91
92
93
94
95
96
97
98
99
100
101
102
103
104
105
1,0174
1,0180
1,0185
1,0191
1,0197
1,0203
1,0209
1,0215
1,0221
1,0228
1,0234
1,0240
1,0247
1,0253
1,0260
1,0268
1,0273
1,0280
1,0287
1,0293
1,0300
1,0308
1,0314
1,0321
1,0329
1,0336
1,0343
1,0351
1,0358
1,0365
1,0373
1,0380
1,0388
1,0396
1,0404
1,0411
1,0419
1,0426
1,0433
1,0441
Material:
- Espectrofotómetro
- Cloreto de sódio
- Citrato de sódio
- Medidor de pH
- Células
- Micropipetas
- Pontas amarelas e azuis
- Tubos de microcentrífuga
- 4 Tubos com tampa com um volume não inferior a 5 mL (por turma)
- Parafilm
- Banho-maria com termóstato
- Papel higiénico