Os mandamentos da Estequiometria
10 - Balancearás a equação química
20 - Destacararás os substâncias envolvidas
30 - Calcularararás os valores molares das
substâncias envolvidas
Os infiéis que não seguirem os
mandamentos,
serão severamente punidos pelo
SENHOR
CANABIS TATIVA
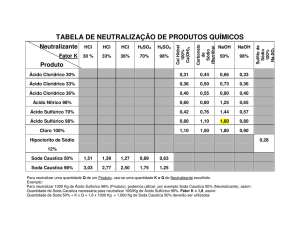
01. (UNI-GIL) Um aluno “acidentalmente” deixou cair sobre os
olhos de seu colega 196g de ácido Sulfúrico. Rapidamente, seu
professor corre para calcular a quantidade, em massa, de soda
cáustica necessária para neutralizar o ácido derramado. Qual
será a quantidade calculada pelo professor? Dados: (H:1; O:16 ;
S:32 Na: 23)
massa
massa
1 H2SO4 + 2 NaOH 1 Na2SO4 + 2 H2O
98g
x2 196g
280g
x 40
m x2
m . 98g = 196g . 80g
m = 160g
Cálculo com impureza.......
02. Uma massa de calcário de 2500g com 80% de pureza, ao
ser calcinado, forneceu quantos litros de CO2 medidos nas
condições normais de temperatura e pressão? Dados: H:1;
O:16 ; Ca: 40 ; C:12
massa
Primeiramente removemos
a impureza.
2500g
x
100%
80%
1CaCO3 1CaO
x20
100g
2000g
x = 2000g
V = 448 L
Depois fazemos o cálculo
Com o valor puro.
volume
+ 1CO2
22,4 L
V
x20
Cálculo com rendimento.......
03. Determine a quantidade de hidróxido de sódio, em massa,
necessária para neutralizar 392 g de ácido sulfúrico com
rendimento de 90%. Dados: (H:1 ; O:16 ; S:32 ; Na: 23)
massa
massa
1 H2SO4 + 2 NaOH 1 Na2SO4 + 2 H2O
98g
x4
392g
280g
x 40
x4
X
X x 98g = 392g x 80g
X = 320g
Y
100%
90%
Y = 288g
Cálculo com reagente limitante e em excesso.......
04.(UNI-Gil) Um caminhão, carregado com 2 toneladas de
ácido sulfúrico, não consegue vencer a curva da cigana e tomba.
Rapidamente o IAP é acionado para controlar o derramamento.
Um técnico químico leva um carregamento de 0,5 toneladas de
cal virgem para neutralizar o ácido. A quantidade de cal
empregada será suficiente? Dados: H:1 ; O:16 ; S:32 ; Ca: 40
1 H2SO4 + 1 CaO 1CaSO4 + 1H2O
98g
2 ton.
56g
0,5
X ton.
X x 98g = 56g x 2 ton.
X = 1,14 ton.