FÍSICA E QUÍMICA A
10º A
Lição nº
Sumário: - Modelo quântico
- Configuração electrónica
de outubro de 2011
Modelo quântico
Evolução do modelo atómico:
John Dalton, em 1808, propôs a teoria do modelo atómico,
onde o átomo é uma minúscula esfera maciça, impenetrável,
indestrutível e indivisível. Seu modelo atómico foi apelidado
de “modelo atómico da bola de bilhar”.
Todos os átomos de um mesmo elemento químico são idênticos:
- Átomos de elementos diferentes possuem propriedades diferentes entre si.
-Átomos de um mesmo elemento possuem propriedades iguais e de peso
invariável.
Nas reacções químicas, os átomos permanecem inalterados.
Na formação dos compostos, os átomos entram em proporções numéricas fixas
1:1, 1:2, 1:3, 2:3, 2:5 etc.
Em 1897, Joseph John Thomson formulou uma
teoria segundo a qual o átomo era como uma
esfera de carga positiva que continha corpúsculos
(eletrões) de carga negativa distribuídos
uniformemente à semelhança de um pudim de
passas.
O "modelo atómico do pudim com passas", substituiu então ao
"modelo da bola de bilhar", mas não eliminou totalmente as
deduções de Dalton, apenas foram acrescentadas mais informações.
Ernest Rutherford, em 1911, comprovou
que o átomo era constituído por um núcleo,
de carga positiva (onde se localizava quase
toda a massa do átomo), em torno do qual se
distribuíam os eletrões de carga negativa.
Dada a semelhança com o modelo do sistema solar, este modelo ficou
conhecido por modelo planetário.
Em 1920, Niels Bohr os eletrões não se
encontravam em qualquer posição:
movimentavam-se à volta do núcleo em
órbitas circulares, fixas e definidas. Bohr
definiu também o número de eletrões
presentes em cada camada e mostrou que
apenas algumas órbitas seriam possíveis,
correspondendo cada uma delas a um nível
bem definido de energia.
Descobriu ainda que as propriedades químicas dos elementos eram
determinadas pela camada mais externa.
O modelo actual aceite é o da nuvem eletrónica, onde
não se representam as trajetórias (orbitas), já que não são
conhecidas, mas as zonas onde há maior probabilidade
de encontrar os electrões (orbitais).
A ideia de órbita eletrónica acabou por ficar desconexa, sendo substituída
pelo conceito de orbital - determinada região do espaço onde há maior
probabilidade de se encontrar um dado eletrão num instante qualquer.
É sabido que os eletrões possuem carga negativa, massa muito pequena e
que se movem em órbitas ao redor do núcleo atómico.
O núcleo atómico é situado no centro do átomo e constituído por protões
que são partículas de carga positiva, cuja massa é aproximadamente 1.837
vezes superior a massa do eletrão, e por neutrões, partículas sem carga e
com massa ligeiramente superior à dos protões.
O átomo é electricamente neutro, por possuir números iguais de eletrões e
protões.
Números quânticos
Caracterização das orbitais:
• Número quântico principal (n) – relaciona-se com a energia e o
tamanho da orbital (o tamanho da energia é tanto maior quanto maior
for o valor de n).
n = 1, 2, 3, …
n=1
n=2
n=3
• Número quântico de momento angular, secundário ou azimutal (
relaciona-se com a forma da orbital.
= 0,… , n-1
Tipo de orbital
orbital s
s
p
d
f
g
h
0
1
2
3
4
5
orbital p
orbital d
)–
• Número quântico magnético (
) – relaciona-se com a orientação da
orbital no espaço.
=-
,…,
Caracterização do eletrão:
• Número quântico de spin (ms) – relaciona-se com o sentido do
movimento de rotação do eletrão sobre si próprio.
Para caracterizar uma orbital são necessários três números quânticos:
n, ,
Para caracterizar um electrão são necessários quatro números
quânticos:
n, ,
, ms
n
1
2
orbital
Nº de orbitais
1
0
0
1s
0
0
2s
1
-1
0
1
2px
2py
2pz
3
0
0
3s
1
-1
0
1
-2
-1
0
1
2
3px
3py
3pz
3d
3d
3d
3d
3d
1
3
2
1
4
3
9
3
(3,2, -2) (3,2, -1) (3,2, 0) (3,2, 1) (3,2, 2)
- - - -
- - - -
- -
- - 3d
- 3p
3s
(3,0, 0)
(2,1, -1) (2,1, 0)
- -
- - -
(2,1, 1)
- -
2p
2s
(2,0, 0)
- -
(1,0, 0)
1s
(3,1, -1) (3,1, 0)
(3,1, 1)
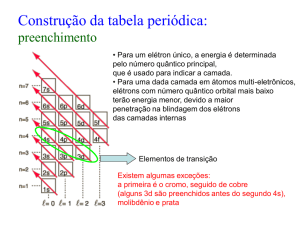
Configuração eletrónica
A forma como os eletrões se distribuem nas orbitais dos átomos –
configuração electrónica – deve conferir ao átomo o estado de menor
energia possível. Para isso deve obedecer ás seguintes regras e
princípios:
• Princípio de exclusão de Pauli: na mesma orbital não podem coexistir
dois eletrões com o mesmo número quântico de spin.
• Princípio de energia mínima: quando um átomo está no estado
fundamental, os seus eletrões ocupam as orbitais disponíveis de menor
energia.
• Regra de Hund: no preenchimento das orbitais da mesma energia
(orbitais degeneradas), distribui-se primeiro um eletrão por cada
orbital, ficando todos com o mesmo spin, e só depois se completam
com sipns opostos – emparelhamento.
1s
2s
2p
3s
3p
4s
3d
4p
5s
4d
…