Funções
Inorgânicas
Funções químicas
Função química corresponde a um conjunto de
substâncias que apresentam propriedades químicas
semelhantes.
As
substâncias
inorgânicas
podem
ser
classificadas em quatro funções:
Ácidos
Bases
Sais
Óxidos
Assim, numa reação química, todos os ácidos, por
exemplo, terão comportamento semelhante.
HCl( aq)
H O
2 H
3O( aq)
Cl( aq)
Substâncias que, em solução aquosa, liberam como cátions somente
íons H3O+.
HNO3 + H2O H3O+ + NO3H2CO3 + 2 H2O 2 H3O+ + CO32H3PO4 + 3 H2O 3 H3O+ + PO43-
De acordo com Arrhenius, apenas se pode definir uma substância
como ácido se, em solução aquosa, ela produzir, como cátions,
somente íons H3O+ (ou simplificadamente H+) .
Quanto ao Grau de Ionização (a)
Ácidos fracos: 0< a < 5%
Ácidos moderados: 5% £ a £ 50%
Ácidos fortes : 50% < a < 100%
α = Nº de Mol Ionizados
=
Nº Inicial de Mols
Ácido fraco: HClO
Ácido moderado: H3PO4
Ácido forte : H2SO4
HClO4
Oxiácidos: HxEOy
0 fraco Ex.: HClO
y-x
1 moderado Ex.: H3PO4
2 forte Ex.: H2SO4
Nomenclatura Oficial:
Hidrácidos:
Seguem a seguinte regra:
Ácidos
+ ídrico
Radical do Elemento
Oxiácidos
Seguem a seguinte regra:
ico (+ oxigênio)
Ácido __________________ +
Radical do Elemento oso (- oxigênio)
Nomenclatura Oxiácidos:
Clube dos 6:
-H2SO4
Ácido Per.....ico
Ácido
.....ico
Menos
.....oso
Oxigênios
-HNO3
Ácido
-H3PO4
Ácido Hipo.....oso
-H2CO3
-H3BO3
-HClO3
Ex: H3PO2 – ác. Hipofosforoso
HClO4 – ác. Perclórico
H2SO3 – ác. Sulfuroso
Exemplo:
H2S
Ácido sulfídrico
H2SO3
Ácido sulfuroso
H2SO4
Ácido sulfúrico
*Para ácidos do enxofre
usamos o radical em
latim “sulfur”.
Ácidos importantes:
1) H2SO4 – Ác. Sulfúrico
É um líquido incolor e oleoso de densidade 1,85 g/cm3,
é um ácido forte que reage com metais originando sulfatos
além de ser muito higroscópico.
Pode ser obtido a partir das seguintes reações:
S + O2 SO2
SO2 + ½O2 SO3
SO3 + H2O H2SO4
*É usado para medir o desenvolvimento industrial de um país.
Ácidos importantes:
2) HCl – Ác. Clorídrico (ácido muriático)
Solução de hidreto de cloro em água. Apresenta forte
odor, além de ser sufocante. É utilizado na limpeza de peças
metálicas e de superfícies de mármore. É encontrado no suco
gástrico humano.
*A limpeza de superfícies com ácido clorídrico é chamada de
decapagem.
Exemplos:
1) Dê nome aos seguintes ácidos:
a) HBr
b) HF
c) HNO3
d) HNO2
2) Dissolvendo-se 600 moléculas de uma substância
em água, verificou-se que delas, 15 moléculas
sofreram ionização.
a) Qual o grau de ionização da substância em
questão?
b) Ela poderá ser considerada um eletrólito forte ou
fraco? Por quê?
Bases
De acordo com Arrhenius, base ou hidróxido é toda
substância que, dissolvida em água, dissocia-se fornecendo como
ânion exclusivamente OH- (hidroxila ou oxidrila).
NaOH Na+ + OHCa(OH)2 Ca2+ + 2OH-
Al(OH)3 Al3+ + 3OH-
Possuem OH- (direita);
Metais;
Lig. Iônicas;
Sólidas;
Fixas.
Bases (exceção)
* NH3 + H2O NH4OH
Ametais;
Lig. covalentes;
Solução aquosa;
Volátil.
Nomenclatura
Hidróxido de _________________
Nome do Elemento
NaOH
hidróxido de sódio
Fe(OH)2
hidróxido de ferro II
Fe(OH)3 hidróxido de ferro III
Classificação
Quanto ao Número de Hidroxilas
- Monobases:
- Dibases:
- Tribases:
- Tetrabases:
NaOH; NH4OH
Ca(OH)2; Mg(OH)2
Al(OH)3; Fe(OH)3
Pb(OH)4; Sn(OH)4
Quanto ao Grau de Dissociação Iônica
- Fortes: Os hidróxidos de metais alcalinos (G1) e metais
alcalinos terrosos (G2).
- Fracas: Nesse grupo incluem-se o hidróxido de amônio
(NH4OH) e as demais bases.
Classificação
Quanto à Solubilidade em Água
- Totalmente solúveis: os hidróxidos dos metais alcalinos
(G1) e o hidróxido de amônio (NH4OH).
- Parcialmente solúveis: hidróxidos dos metais alcalinoterrosos (G2).
- Insolúveis: todos os demais hidróxidos.
KOH
Monobase
Forte
Solúvel
Al(OH)3
Tribase
Fraca
Insolúvel
Características gerais das bases
Apresentam sabor caústico;
Estriam a matéria orgânica;
Deixam vermelha a solução alcoólica de fenolftaleína;
Neutralizam ácidos formando sal e água;
Bases importantes:
2) Ca(OH)2 – Hidróxido de cálcio (cal apagada,
hidratada ou extinta)
É uma suspensão aquosa de aparência leitosa, obtida a
partir do CaO (cal virgem).
É usada na caiação de paredes e muros, na neutralização
de solos ácidos e na fabricação de doces.
CaO + H2O Ca(OH)2
Cal
Virgem
Cal
Apagada
Bases importantes:
3) Mg(OH)2 – Hidróxido de magnésio (Leite de magnésia)
É uma suspensão leitosa, obtida a partir do MgO.
É usada como antiácido estomacal e também como laxante.
*Antigamente era aplicada nas axilas para impedir a ação dos ácidos que
causam odores indesejáveis.
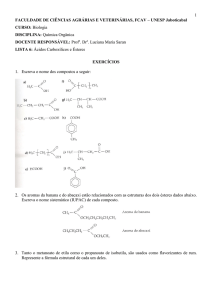
1) Escreva os nomes dos compostos cujas fórmulas são:
a) Mg(OH)2
b) NH4OH
c) Fe(OH)3
d) KOH
e) CsOH
f) RbOH
Sais
Sal é todo composto que em água dissocia liberando um
cátion de H+ e um ânion de OH-.
A reação de um ácido com uma base recebe o nome de
neutralização ou salificação.
Ácido + Base Sal + Água
HCl + NaOH NaCl + H2O
Neutralização
Nomenclatura
Obedece à expressão:
(nome do ânion) de (nome do cátion)
Sufixo do ácido
Sufixo do ânion
ídrico
ico
oso
eto
ato
ito
H2SO4 + Ca(OH)2 CaSO4 + 2 H2O
Sulfato de cálcio (gesso)
Sais importantes:
1) NaHCO3 – Bicarbonato de sódio (ENO,Sonrisal)
É um pó branco que perde CO2 com facilidade
(efervescência).
É usado como antiácido estomacal , fermento químico e
nos extintores de incêndio.
H2CO3
NaHCO3 + H2O NaOH + H2O+ CO2
*Pode ser usado para neutralizar os ácidos graxos na manteiga rançosa.
Sais importantes:
3) NaNO3 – Nitrato de sódio (Salitre do Chile)
É um sólido cristalizado no sistema cúbico, além de ser
um ótimo oxidante para reações químicas.
É usado na fabricação de fertilizantes e explosivos.
*Nos Andes era utilizado na conservação da carne por ser higroscópico.
Dê todos os nomes possíveis aos seguintes sais:
a)
b)
c)
d)
e)
f)
Sr(CN)2
ZnCl2
AgNO3
PbS
Fe(NO3)2
NaF
Óxidos
Óxido é todo composto binário oxigenado, no
qual o oxigênio é o elemento mais eletronegativo.
Fórmula geral dos óxidos:
Ex+2 O2-X
Exemplos:
CO2, H2O, Mn2O7, Fe2O3
Nomenclatura
Regra geral:
(Prefixo) + óxido de (prefixo) + elemento
CO -monóxido de monocarbono
N2O5 -pentóxido de dinitrogênio
P2O3
-trióxido de difosforo
H2O -monóxido de dihidrogênio
Para metais:
Na2O
Al2O3
FeO
Fe2O3
óxido de elemento
-óxido de sódio
-óxido de alumínio
-óxido de ferro II (óxido ferroso)
-óxido de ferro III (óxido férrico)
Dê nome aos seguintes óxidos, segundo a regra geral
(dos prefixos):
a) CO
b) b) NO
c) SO2
d) SiO2
e) Na2O
f) BaO2
g) MnO2
CARÁTER ÁCIDO E BÁSICO DE UMA SOLUÇÃO
• Entre uma solução muito ácida e uma solução muito básica, a
acidez e a basicidade (ou alcalinidade) podem variar
gradativamente.
• Existem certas substâncias, capazes de adquirir diferentes
colorações se colocadas em soluções ácidas ou em soluções básicas
e que são denominadas de indicadores ácido– base. São utilizadas
para que se possa reconhecer o caráter de uma solução.
• A medida quantitativa da acidez ou da alcalinidade de uma solução
pode ser feita através da comparação com uma escala, denominada
de escala de pH, introduzida na química pelo dinamarquês
Sörensen, em 1909.
• Nessa escala, que vai de zero até quatorze:
uma solução neutra tem pH = 7,
uma solução ácida tem pH < 7,
e uma solução básica tem pH > 7.
Os indicadores são ácidos ou bases (orgânicos) muito
fracas, de estrutura complexa, que mudam de cor em
determinados intervalos de pH, denominados zonas
(ou intervalos) de viragem.
• Além dos indicadores em solução, existem papéis impregnados com
indicador. O papel de tornassol vermelho e o papel de tornassol azul são
exemplos desses papéis. O tornassol vermelho permanece vermelho em
soluções ácidas ou neutras e muda para azul em soluções básicas e o
tornassol azul permanece azul em soluções básicas ou neutras e muda
para vermelho em soluções ácidas.
• Existe um papel, denominado papel indicador universal, impregnado com
uma mistura de indicadores e que adquire diferentes colorações para cada
pH. Mergulhando-se esse papel indicador numa solução-problema e
comparando-se a cor adquirida com a de uma escala de cores, pode-se
avaliar o valor numérico do pH da solução-problema.
Função “p”
px = - (log10x)
ou seja
px = - (logx)
como H representa a concentração dos
íons H+ em solução([H+]) :
logo, pH = - (log [H+])
Simplificando, pH = -log[H+]
[H+] = 1.10-3
pH = - log(1.10-3) = - log1 - log10-3
pH = 0 - log 10-3 = 0 - (-3) log 10 = 0 + 3 = 3
Resumindo,
[H+] = 1.10-3
pH = 3
pH
Indicadores ácido-base
• A Hortênsia tem flores rosa ou azuis
dependendo do pH do solo.
Em solos ácidos as flores são azuis,
enquanto em solos alcalinos são cor-de-rosa
• indicador ácido-base natural, tornando-se
rosa em solução ácida e verde em solução básica
Indicadores ácido-base
O azul de bromotimol é um indicador de pH
que em solução ácida fica amarelo,
em soluçao básica fica azul e
em solução neutra fica verde.
Video: indicadores 1
Video: indicadores 2
EXERCÍCIOS
1. Calcule o pH das soluções abaixo e classifique-as em ácidas ou
básicas:
a) [H+] = 1.10-3
b) [H+] = 1.10-1
c) [H+] = 1.10-6
d) [H+] = 1.10-10
e) [H+] = 0,021.10-3
f) [H+] = 0,8.10-1
g) [H+] = 0,144.10-6
h) [H+] = 1,8.10-10
2. Dos valores de pH encontrados no exercício anterior, indique a
solução mais ácida e a mais básica.