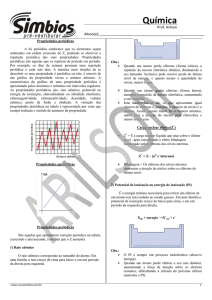
Tabela Periódica
Tabela Periódica e a configuração eletrônica
• O número do periodo é o valor de n.
• Os grupos 1A e 2A têm o orbital s preenchido.
• Os grupos 3A -8A têm o orbital p preenchido.
• Os grupos 3B -2B têm o orbital d preenchido.
• Os lantanídeos e os actinídeos têm o orbital f preenchido.
Principais modos de representar as configurações
Notação spdf
exemplos
Notação de caixas orbitais
Configurações eletrônica condensadas
• O neônio tem o subnível 2p completo.
• O sódio marca o início de um novo período.
• Logo, escrevemos a configuração eletrônica condensada
para o sódio como
Na: [Ne] 3s1
• [Ne] representa a configuração eletrônica do neônio.
• Elétrons mais internos: os elétrons no [Gás Nobre].
• Elétrons de valência: os elétrons fora do [Gás Nobre].
Metais de Transição
• Depois de Ar, os orbitais d começam a ser preenchidos
Depois que os orbitais 3d estiverem preenchidos, os orbitais
4p começam a ser preenchidos
Metais de transição são os elementos nos quais os elétrons d
são os elétrons de valência
Lantanídeos e actinídeos
Do Ce em diante, os orbitais 4f começam a ser
preenchidos.
Observe: La: [Kr]6s25d14f1
Os elementos Ce -Lu têm os orbitais 4f preenchidos e são
chamados lantanídeos ou elementos terras raras.
Os elementos Th -Lr têm os orbitais 5f preenchidos e são
chamados actinídeos.
A maior parte dos actinídeos não é encontrada na
natureza.
TENDÊNCIAS PERIÓDICAS
×
CONFIGURAÇÃO ATÔMICA
Carga Nuclear Efetiva (Zeff)
Muitas propriedades atômicas podem ser racionalizadas
pelo conceito de carga nuclear efetiva
É a carga nuclear sentida por determinado elétron em um
átomo multieletrônico, modificada pela presença dos outros
elétrons.
Eletrons 2s PENETRAM a região ocupada pelos elétrons
1s e sentem uma carga positiva maior do que a esperada
ns > np > nd > nf
Cargas Nucleares Afetivas
Li
Be
B
C
N
O
F
Ne
Z
3
4
5
6
7
8
9
10
1s
2,69
3,68
4,68
5,67
6,66
7,66
8,65
9,64
2s
1,28
1,91
2,58
3,22
3,85
4,49
5,13
5,76
2,42
3,14
3,83
4,45
5,10
5,76
Na
Mg
Al
Si
P
S
Cl
Ar
Z
11
12
13
14
15
16
17
18
1s
10,63
11,61
12,59
13,57
14,56 15,54
16,52
17,51
2s
6,57
7,39
8,21
9,02
9,82
11,43
12,23
2p
6,80
7,83
8,96
9,94
10.96 11,98
12,99 14,01
3s
2,51
3,31
4,12
4,90
5,64
6,37
7,07
4,07
4,29
4,89
5,48
6,12
6,76
2p
3p
10,63
7,76
Tendências Periódicas Gerais
• Raios atômico e iônico
• Energia de ionização
• Afinidade eletrônica
Raio atômico
• Considere uma molécula diatômica simples.
• A distância entre os dois núcleos distância de ligação.
• Se os dois átomos são os mesmos metade da distância
de ligação é o raio covalente do átomo.
Raio atômico
Nos grupos raio atômico aumenta com o número atômico
Elétrons entram em orbitais maiores, mais longe do núcleo,
e sofrem menos atração
Nos períodos raio atômico diminui com o número atômico
Elétrons externos são sujeito a maior carga nuclear efetiva,
sendo mais fortemente atraídos
Z* aumenta e- externos
mais fortemente atraídos
n aumenta tamanho do
orbital mais externo aumenta
Tendências nos Raios Atômicos nos Metais de Transição
Nos metais de transição (bloco d), os raios atômicos variam
pouco no período !!! Por que????
Raios Iônicos × Raios Atômicos
Li,152 pm
3e + 3p
Li +, 78 pm
2e + 3 p
Formando um cátion
+
CATIONS são MENORES que os átomos neutros
atração dos e- pelo núcleo aumenta raio DIMINUI.
F, 71 pm
9e + 9p
F- , 133 pm
10e + 9 p
Formando um ânion
-
ANIONS são MAIORES que os átomos neutros atração
dos e- pelo núcleo diminui raio AUMENTA.
Tendências Periódicas dos Raios Iônicos são similares às
dos raios atômicos
Energia de Ionização (E.I)
medida da tendência a formar cátions quantidade de
energia necessária para retirar 1 mol de elétrons de 1 mol
de átomos no estado gasoso
exemplo:
Cu(g) Cu+(g) + e−(g), I1 = 785 kJ · mol−1 (1a. E.I)
Cu+(g) Cu2+(g) + e−(g), I2 = 1955 kJ · mol−1
(2a. E.I)
Carga positiva Aumenta EI aumenta
energia de ionização baixa =) elementos formam cátions
(metais; bons condutores elétricos)
Variação da E.I no período
DE MODO GERAL: E.I aumenta ao longo do período
Fatores que influencias as energias de
ionização
• tamanho do átomo
• carga do núcleo
• eficiência com que os níveis eletrônicos blindam a carga
nuclear
• tipos de elétrons envolvidos (s,p,d.f)
Variação da Energia de Ionização no Grupo
• EI diminui com o número atômico no grupo
• Elementos se tornam agentes redutores mais fortes
Energia de Ionização
No geral 1ª. E.I decresce de cima para baixo nos grupos
No grupo 13 – regular para B até Al
irregular para Ga,In e Tl
No Ga
• são precedidos pelos 10 elétrons da primeira série de
transição
•Subnível 3d estão sendo preenchidos Ga menor do que
esperado
•Mesmo ocorre para a segunda e terceira série de transição
efeito acentuado
Sobre Ga, In e Tl e também nos grupos 14 e 15
O que esperar para os lantanídeos?
Variações de energia de ionização sucessivas
Tendências periódicas nas primeiras energias
de ionização
• A energia de ionização diminui à medida que descemos
em um grupo.
• Isso significa que o elétron mais externo é mais facilmente
removido ao descermos em um grupo.
• À medida que o átomo aumenta, torna-se mais fácil
remover um elétron do orbital mais volumoso.
• Geralmente a energia de ionização aumenta ao longo do
período.
• Ao longo de um período, Zef aumenta.
Consequentemente, fica mais difícil remover um elétron.
• São duas as exceções: a remoção do primeiro elétron p e
a remoção do quarto elétron p. (explique o porquê)
Exercício
1 - Explique, por meio do raio atômico, por que a energia
de ionização do lítio é maior do que do sódio
2 - Justifique o decréscimo da primeira E.I entre N e O
3 – Justifique porque a 1ª. E.I do B é menor do que do Be,
apesar do primeiro ter carga nuclear maior
4 – Explique porque a 2ª E.I de ionização de um elemento é
maior do que a primeira
5 – Explique porque os elementos do grupo 1 possuem
2ª.E.I bem maior do que do grupo 2
6 – Explique porque os gases nobres possuem E.I alta.
Afinidade Eletrônica (A.E)
Energia liberada quando um átomo recebe um elétron
formando um ânion
A(g) + e- A-(g)
A.E. = ΔE da reação
O (g) + e- O-(g)
O [He]2s22p4
O- [He]2s22p5
AE = - 141 kJ/mol
Δ E é Exotérmica = energia da atração (e- + núcleo) maior
que a da repulsão entre 2e- no mesmo orbital p
• é uma medida da tendência a formar ânions estáveis
• afinidade eletrônica grande e positiva =) ânion é estável
(não-metais)
Variação da Afinidade Eletrônica no Grupo e Período
• Afinidade eletrônica aumenta com número atômico no
período
• Afinidade eletrônica diminui com número atômico nos
grupos (aumento do raio atômico = menor interação com o
núcleo)
Átomo
F
Cl
Br
I
AE
-328 kJ
-349 kJ
-325 kJ
-295 kJ
A E depende principalmente da carga nuclear efetiva
Exercício
1 – Justifique o decrécimo da AE entre Li e Be, apesar do
aumento da carga nuclear
2 – Justifique o decréscimo da AE entre C e N
Eletronegatividade
Eletronegatividade poder de um átomo de um elemento
de atrair elétrons quando faz parte de um composto
Em geral
• átomos pequenos são mais eletronegativos
•Átomos com níveis eletrônicos quase preenchidos são mais
eletronegativos que átomos com níveis eletrônicos pouco
preenchidos
Valores de eletronegatividade de Pauling
Exercício
1 – Discuta a tendência nas eletronegatividades ao longo do
período 2 do lítio ao flúor.