Universidade Federal do Paraná
Setor de Tecnologia
Depto de Engenharia Química
Prof. Dr. Mário José Dallavalli
BIOMATERIAIS E BIOMECÂNICA
TQ-064
Biomateriais Metálicos
1 Metais como Materiais Biocompatíveis
• Aplicações dos Metais
– Substituição de ossos
– Reparação de ossos
– Placas metálicas para fraturas, etc.
– Implantes dentários, enchimento e pinos
– Parafusos e grampos
Partes de outros dispositivos
–
–
–
–
Corações artificiais – bombas
Marca-passos
Cateteres
Extensores (stents)
Biomateriais Metálicos
Obtenção e processamento dos Metais
• Mineração e purificação do minério
• Metais brutos e formas de estocagem
• Tarugos e chapas – usinagem,
conformação, estampagem, etc
• formas e dispositivos preliminares
• Processamento
• Acabamento e tratamento de superfície
Biomateriais Metálicos
2 Metais mais usados como Biomateriais
• Assuntos relacionados aos Metais como
Biomateriais
– Identidade química (ligas)
– Cristalografia
– Fases presentes na microestrutura
– Grãos e tamanho de grão
– Quantidade, distribuição e orientação das fases
- Propriedades dos metais
Biomateriais Metálicos
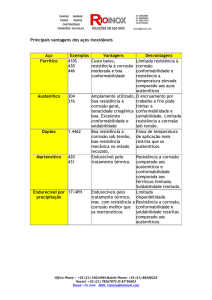
• Aço Inoxidável
• Ligas a base de Cobalto
– Sempre misturado com cromo
• Ligas a base de Titânio
– Muito leve com relativa alta resistência
– Conteúdo de oxigênio afeta a resistência
– Relativamente puro
Biomateriais Metálicos
• Metais nobres - Au, Au, Pt, Pd, Ir
– Caros e com propriedades pobres como materiais
– Usados em eletrodos – elevada resistência a corrosão
• Mercúrio – Amalgama dentário
– Amalgamas - é toda liga metálica em que um dos metais
envolvidos está em estado líquido, geralmente o mercúrio
– Metais formadores - mercúrio, prata e
estanho, podendo haver também o zinco e
cobre
Biomateriais Metálicos
3 Aço Inoxidável
• Inúmeras variedades existentes
• Ligas de baixo teor de carbono mais usadas
– Altos teores de carbono causam corrosão do ferro
• Misturas de Fe, Cr, e Ni
• O cromo oxida para limitar a corrosão
– Por que a corrosão é indesejada?
– Lixiviação para o corpo
– Formação de trincas e fadiga
AÇOS
Aços - ligas Fe-C que podem conter outros
elementos.
– Propriedades mecânicas dependem da %C.
%C < 0.25% => baixo carbono
0.25% < %C < 0.60% => médio carbono
0.60% < %C < 1.4% => alto carbono
Aços carbono
– Baixíssima concentração de outros elementos.
Aços liga
– Outros elementos em concentração apreciável.
Biomateriais Metálicos
• Presença de altos teores de cromo reduz
a resistência
• Níquel adicionado para aumento de
resistência
– Estabiliza a austenita
• Quanto menores os grãos, maior a
resistência
– Como ajustar o tamanho de grão?
Biomateriais Metálicos
4 Corrosão
• Metais degradam a óxidos, hidróxidos e outros
compostos
• Fenômeno oposto a de uma bateria
• Fluidos biológicos contem água, oxigênio
dissolvido, íons, etc.
- Mistura muito agressiva
• Corrosão é um dos aspectos mais importantes
da Biocompatibilidade dos metais
Corrosão
Corrosão em superfície
Biomateriais Metálicos
• Mecanismo da corrosão
– O estado de menor energia é o estado oxidado
– Átomos dos metais ionizam, entram em solução e
combinam com o oxigênio
Equação geral da formação da ferrugem
Fe (s) ---> Fe2+ + 2e- (oxidação do ferro)
O2 + 2H2O + 4e- ---> 4OH- (redução do oxigênio)
2Fe + O2 + 2H2O ---> 2Fe(OH)2
– Similarmente a ferrugem no ferro: os metais “escamam”
• A tendência a corrosão é baseada na série
eletroquímica
Biomateriais Metálicos
• Série eletroquímica (H=0)
– Au > Ag > H > Fe > Ti > Al > Na > Li
– Metais nobres possuem potencial de Nernst positivo,
sendo imune a corrosão
• Metais com potencial negativo se tornam
anodos
• Corrosão galvânica envolve dois metais
similares
– O processo é muito mais rápido do que se utilizado um
único metal
– Devemos evitar metais misturados!!!!!!
Série Eletroquímica
Element
Reaction
Electrode
Potential (V)
Gold
Au++e- = Au
1.692
Gold
Au3++3e- = Au
1.498
Platinum
Pt2++2e- = Pt
1.18
Palladium
Pd2++2e- = Pd
0.951
Silver
Ag++e- = Ag
0.7996
Copper
Cu++e- = Cu
0.521
Copper
Cu2++2e- = Cu
0.3419
Hydrogen (acid)
2H++2e- = H2
0
Iron
Fe3++3e- = Fe
-0.037
Lead
Pb2++2e- = Pb
-0.1262
Tin
Sn2++2e- = Sn
-0.1375
Nickel
Ni2++2e- = Ni
-0.257
Cobalt
Co2++2e- = Co
-0.28
Cadmium
Cd2++2e- =
-0.403
Iron
Fe2++2e- = Fe
-0.447
Chromium
Cr3++3e- = Cr
-0.744
Zinc
Zn2++2e- = Zn
-0.7618
Chromium
Cr2++2e- = Cr
-0.913
Manganese
Mn2++2e- =Mn
-1.185
Titanium
Ti3++3e- = Ti
-1.37
Corrosão galvânica
Um exemplo de uma reação eletroquímica é a pilha galvânica, que gera energia elétrica
a partir da reação entre ácido sulfúrico, cobre e zinco
Biomateriais Metálicos
• Potencial galvânico em um único metal
• Filmes passivadores podem limitar a corrosão
(camadas de óxidos), mas também podem ser
trincadas
• Os diagramas de Pourbaix mostram regiões de
corrosão, passivação e imunidade e como elas
dependem do potencial de eletrodo e do pH
– Logo regiões diferentes do corpo afetam o processo da
corrosão diferentemente
– Feridas e infecções podem mudar dramaticamente o pH
Diagrama de Pourbaix para
Corrosão
Biomateriais Metálicos
Corrosão e fadiga podem ser efeitos sinérgicos
– Testes devem sempre ser realizados em meios e
condições fisiológicas
• Impressão na superfície do metal pode quebrar a
passivação
• Pitting é corrosão em uma área localizada (variação
da conc. de oxigênio – corrosão galvânica)
• Problema importante é assegurar que parafusos,
porcas e chapas sejam do mesmo metal (corrosão
galvânica)
• Os cirurgiões devem ter extremo cuidado para não
arranhar a superfície do metal
Fim
Até a próxima aula