Introdução
Glicogénese, glicogenólise e
gliconeogénese
Piruvato
Oxaloacetato
Glicerol
Gliconeogénese
Glicogénese
Glicose 6-P
Glicogénio
Glicogenólise
– sequência e regulação coordenada –
Glicogénio
Polissacárido;
Pouco solúvel (não provoca aumento da pressão osmótica);
Bastante ramificado;
Constituído exclusivamente por monómeros de glicose unidos entre
si por ligações 1,4 (e 1,6 nas ramificações):
Glicogénese, glicogenólise e
gliconeogénese
Piruvato
Oxaloacetato
Glicerol
Gliconeogénese
Glicogénese
Glicose 6-P
Glicogénio
Glicogenólise
Glicogenólise
– Esquema geral –
Glicogenólise
1ª Reacção
Remoção de um resíduo de glicose
terminal de um ramo do glicogénio:
Glicogenólise
2ª Reacção
Desramificação do glicogénio:
Glicogenólise
3ª Reacção
Remoção do resíduo de glicose final
Glicogenólise
4ª Reacção
Conversão da glicose 1-P em glicose 6-P:
fosfoglicomutase
Glicogénese
1ª Reacção
Conversão da glicose 6-P em glicose 1-P:
fosfoglicomutase
Glicogénese
2ª Reacção
Conversão da glicose 1-P em UDP-glicose:
Glicogénese
3ª Reacção
Ligação da UDP-glicose a uma molécula de glicogénio:
glicogénio sintase
Glicogénese
Formação de uma molécula nova de
glicogénio
• Adição de UDP-glicose ao grupo
hidroxilo do Tyr da glicogenina;
• Adição de mais 6 resíduos de
glicose;
Glicogénese
A ramificação das cadeias de glicogénio é feita por uma enzima “ramificadora”
(amilo (1,4) para-(1,6)-transglicosilase ou glicosil-(4–>6)-transferase)
Glicogénese
– Estrutura do Glicogénio –
Glicogénese e Glicogenólise
– Regulação –
A regulação dá-se essencialmente a nível da glicogénio
sintase (glicogénese) e da glicogénio fosforilase
(glicogenólise).
Glicogenólise
– Regulação –
Glicogénio fosforilase é…
…activada por:
• Epinefrina
• Glicagina (fígado)
• Ca2+ (músculo)
• [AMP] (músculo)
…inibida por:
• [ATP]
• PP1
• [Glicose] (fígado)
Glicogénese
– Regulação –
Glicogénio sintase é…
…activada por:
• Insulina
• [Glicose 6-P]
• [Glicose]
…inibida por:
• Glicagina (fígado)
• Epinefrina
Síntese do glicuronato
Glicose
Ocorre no figado
ATP
É uma alternativa à oxidação da glicose,
mas não leva à formação de ATP
Hexocinase
ADP
Glicose 6P
Mutase
O UDP-glicuronato é a forma activa do
glicuronato nas reacções que envolvem
a incorporação de glicuronato em
proteoglicanos ou em reacções em que
é conjugado a substractos.
O glicorunato pode formar xilulose e
consequente xilulose 5-P que é um
intermediário da via das fosfopentoses
A UDP-xilose controla a actuação da
desidrogenase
Glicose 1P
UTP
PPi
UDP-glicose
pirofosforilase
UDP-glicose
(-)
2NADH +
H+ + CO2
2NADH + 2H+
UDP-xilose
UDP- glicose Desidrogenase
UDP-glicuronato
CO2
H2O
UDP
Glicuronato
Proteoglicanos
Glicurono-conjugados
Xiulose P
(destoxificação)
Xiulose 5P
(via das fosfopentoses)
Glícidos conjugados
São oligossacarídios ligados covalentemente a outras
biomoléculas (proteínas e lípidos) dando origem a
uma biomolécula activa.
Glicosaminoglicanos (GAG)
Glícidos complexos de elevado peso molecular, constituídos
por aminoaçúcares e uronatos, em sequências repetitivas de
dissacáridos;
Um ou mais dos grupos hidroxilo do aminoaçúcar estão
esterificados com sulfato (GAG sulfatado), com excepção do
hialuronato;
Hialuronato é também excepção porque não se liga
covalentemente a proteínas.
Glicosaminoglicanos
Exemplos de Glicoseaminoglicanos:
Hialuronato;
Sulfato de Condroitina;
Sulfato de Queratano;
Heparina
Proteoglicanos
Mucopolissacáridos;
Proteínas unidas por ligação covalente a uma ou mais
cadeias de glicosaminoglicanos;
Existem associados aos elementos estruturais dos
tecidos (ósseo e conjuntivo);
macromoléculas da superfície celular ou da matriz
extracelular.
Proteoglicanos
Síntese
Formam-se através de uma ligação covalente
indirecta através de uma ponte de trissacáridos
(azul) entre o glicosaminoglicano (condroitinosulfato) e um resíduo de serina da cadeia
peptídica.
O resíduo de serina liga-se a um dos terminais
da ponte
O glicosaminoglicano liga-se ao outro terminal
Biossíntese de Proteoglicanos
Síntese da proteína central no retículo endoplasmático (RE)
Ligação à proteína central, no RE pode ser de 3 tipos:
Ligação O-glicosídica entre xilose (Xyl) e serina (Ser) → transfere-se uma Xyl
da UDP-Xyl para a serina e adicionam-se mais 2 galactose (Gal) → Gal-GalXyl-Ser
Ligação O-glicosídica entre GalNAc (N-acetilgalactosamina) e Ser (ou treonina
(Thr)) (presente no sulfato de queratano II) → transfere -se uma GalNAc da
UDP-GalNAc para a Ser (ou thr)
Ligação N-acetilglicosamina entre GlcNAc e o grupo amina da asparagina
(Asn) (síntese usa oligossacárido-PP-dolicol)
Biossíntese de Proteoglicanos
No Aparelho de Golgi (AG), alongamento da cadeia, com açúcares de
nucleótidos e glicosil-transferases específicas → existe uma enzima para cada
ligação criada.
Terminação da cadeia: progressão e sulfatação da cadeia GAG em crescimento.
Depois de formados os GAG, no AG, outras modificações ocorrem:
adição de grupos sulfato a N-Acetilgalactosamina (GalNAc) (por sulfotransferases,
usando 3’-fosfoadenosina-5’-fosfosulfato (PAPS) como dador de grupos sulfato);
epimerização de ácido glicorónico (GlcUA) a ácido idurónico (IdUA) (por uma
epimerase).
Glicoproteínas
são proteínas unidas por ligações covalentes a quantidade
variável de oligossacáridos (com menos de 15 resíduos glicídicos
cada) isolados ou dispersos ao longo da molécula proteica.
Existem em quase todos os seres vivos nos meios intracelular
(complexo de golgi, no retículo endoplasmático (onde são
formadas), nos lisossomas e em glândulas secretórias) e
extracelular na folha externa da membrana, no sangue e na
matriz extracelular.
Exemplos de glicoproteínas: maioria das plasmáticas, na
membrana celular (ex.: determinantes dos grupos sanguíneos),
hormonas,…
Classificação das Glicoproteínas
Classificação é feita de acordo com as ligações entre os péptidos e os
oligossacáridos:
1.Ligação O-glicosídica entre o OH de um resíduo de serina ou treonina e
um açúcar como a N-acetilgalactosamina (GalNAc-Ser[Thr]), ligando-se
neste caso ao oxigénio;
Serina ou Treonina + N-Acetilgalactosamina
2.Ligação N-glicosídica: entre o NH2 de um resíduo de asparagina (Asn) e
N-acetilglicosamina (GlcNAc-Asn), ligando-se neste caso ao azoto.
Asparagina + N-Acetilglicosamina
Biossíntese de Glicoproteinas com ligações
O-glicosídicas
Proteína
nxNDP-monossacáridos
Transferência de açúcares provenientes
de
açucares-nucleótidos
(NDP-Gi)
apropriados, envolvendo um conjunto
de glicosiltransferases de glicoproteina
ligadas à membrana actuando de forma
sequencial;
cada
transferase
é
geralmente específica para um tipo
particular de ligação
As enzimas envolvidas estão localizadas
em vários subcompartimentos do
aparelho de Golgi
A O-glicosilação ocorre pós-tradução,
em determinados resíduos de Ser ou
Thr.
Glicosiltransferases
de glicoproteína
Glicoproteína
Remodelação e alongamento dos olidossacáridos
Localização intracelular ou exocitose
Biossíntese de Glicoproteinas com
ligações N-glicosídicas
Glicoproteínas N-ligadas possuem uma ligação Asn-GlcNAc
É a maior classe de glicoproteínas
Inclui glicoproteínas de membrana e circulantes
A sua síntese é diferente da das glicoproteínas O-ligadas.
Principais classes das N-ligadas:
complexas
híbridas
ricas em manose
Estas classes possuem em comum um pentassacárido Man3GlcNAc2, mas diferem
nas restantes ramificações → no início, todas estas classes começam pela síntese deste
pentassacárido
Fases da biossíntese:
A. Síntese e transferência do
oligossacárido-PP-dolicol
Dolicol
ATP
ADP
Dolicol cinase
Dolicol P
O) O Dolicol deve ser fosforilado, pela dolicol cinase,
usando ATP como doador de fosfato
1 ) Forma-se GlcNAc-PP-dolicol a partir de Dol-P e
UDP-GlcNAc como doador. Este é um lípido que actua
como aceptor de glícidos na síntese de oligossacáridoPP-dolicol, sendo sintetizado na membrana do RER
2) Um 2º resíduo de GlcNAc é adicionado ao primeiro,
utilizando a UDP-GlcNAc
3) 5 resíduos de Man são adicionados, utilizando GDPManose como doador
4) 4 resíduos de Man são adicionados utilizando Dol-PMan como doador.
5) 3 resíduos de glicose são doados pelo Dol-P-Glc
6)Forma-se Glc3Man9GlcNAc2-PP-dolicol
UDP-N-acetilglicosamina
Glicosil transferase
UMP
N-Acetilglicosamina-dolicol PP
UDP-N-acetilglicosamina
UDP
2(N-Acetilglicosamina)-dolicol PP
5(GDP-Manose)
5 UDP
5(manose) 2(N-Acetilglicosamina)-dolicol PP
4(Dolicol P-Manose)
4 Dolicol-P
9(manose) 2(N-Acetilglicosamina)-dolicol PP
3(Dolicol P-Glicose)
3 Dolicol-P
3(glicose) 9(manose) 2(N-Acetilglicosamina)-dolicol PP
Proteína
Dolicol PP
Glicoproteína
Remodelação e alongamento dos olidossacáridos
Localização intracelular ou exocitose
Biossíntese de Glicoproteinas com
ligações O-glicosídicas e N-glicosídicas
Glicolípidos
Folha exterior da membrana celular
Reconhecimento e contacto entre as células
Equilíbrio da estrutura
gangliósidos
Síntese de Ceramida
sintetizada no retículo endoplasmático,
a partir do aminoácido serina
sinalização molecular
constituinte dos gangliósidos
Síntese de Gangliósidos
– sequência, regulação não hormonal e pontos comuns –
e diferentes com a glicólise
Glicogénese, glicogenólise e
gliconeogénese
Piruvato
Oxaloacetato
Glicerol
Gliconeogénese
Glicogénese
Glicose 6-P
Glicogénio
Glicogenólise
Gliconeogénese
- Precursores do piruvato -
Gliconeogénese
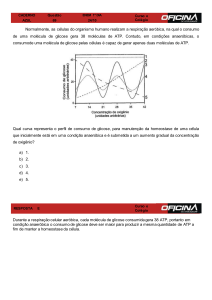
- comparação com Glicólise A gliconeogénese e glicólise não são exactamente
idênticas:
• A gliconeogénese não ocorre só no citosol;
• Sete das dez reacções da glicólise são reversíveis
(∆G ≈ 0) e inversas às da gliconeogénese;
• As restantes três são irreversíveis (∆G << 0 – muito
exergónicas) => são necessárias enzimas e reacções
diferentes ;
Gliconeogénese
- comparação com Glicólise Reacções globais:
Gliconeogénese
Glicólise
Gliconeogénese
- Reacções Irreversíveis 1) Conversão do piruvato em fosfoenolpiruvato (PEP);
2) Conversão frutose 1,6-bisfosfato em frutose 6-fosfato;
3) Conversão da glicose 6-fosfato em glicose.
Gliconeogénese
- Reacções Irreversíveis Conversão do piruvato em
fosfoenolpiruvato (PEP):
1)
Via
principal:
inicia-se
na
mitocôndria; o piruvato provém do
citosol ou da transaminação da
alanina;
Gliconeogénese
- Reacções Irreversíveis 1ª Reacção:
Piruvato
carboxilase
A piruvato carboxilase é uma enzima da
mitocôndria que requer a biotina como
coenzima (transportador de HCO3–
activado).
2ª Reacção:
Malato
desidrogenase
mitocondrial
Necessita de NADH mitocondrial.
Gliconeogénese
- Reacções Irreversíveis 3ª Reacção (no citosol):
Malato
desidrogenase
citosólica
É formado NADH citosólico
4ª Reacção:
PEP
carboxicinase
citosólica
A PEP carboxicinase citosólica requer
Mg2+.
Gliconeogénese
- Reacções Irreversíveis Via principal:
Reacção global:
∆G = -25 kJ/mol => reacção irreversível
Permite que NADH seja “transportado” da
mitocôndria para o citosol
Gliconeogénese
- Reacções Irreversíveis Via Alternativa:
Utiliza o lactato como precursor.
1.
Lactato é convertido a piruvato pela
lactato desidrogenase (com formação de
NADH);
2.
Piruvato entra na mitocôndria e é
convertido a oxaloacetato pela piruvato
carboxilase;
3.
Oxaloacetato é convertido em PEP pela
PEP carboxicinase mitocodrial e passa para o
citosol.
Gliconeogénese
- Reacções Irreversíveis Conversão frutose 1,6-bisfosfato
em frutose 6-fosfato:
Frutose
2)
1,6-bisfosfatase
A Frutose
dependente.
1,6-bisfosfatase
é
Mg2+
Gliconeogénese
- Reacções Irreversíveis Conversão da glicose 6-fosfato
em glicose:
3)
Glucose
6-fosfatase
A Glucose 6-fosfatase é activada por Mg2+ e só
se encontra nas células hepáticas e
renais.
Gliconeogénese
- Reacções Irreversíveis -
Gliconeogénese
- Casos especiais Os ciclos da glicose ‐ lactato (ciclo de Cori) e glicose ‐
alanina são casos especiais da gliconeogénese, entre
tecidos especialmente carenciados em glicose e o tecido
hepático;
Gliconeogénese
- Ciclo da glicose – alanina -
Gliconeogénese
- Ciclo da glicose – lactato (ciclo de Cori)
Gliconeogénese
- regulação alostérica Piruvato carboxilase
Promovida pela acetil-CoA
[acetil-CoA] :
• Devido à degradação de AG em grande quantidade ;
• As necessidades energéticas da célula estão satisfeitas
fosforilação oxidativa
[NADH]
ciclo Krebs
Inibida por ADP
Frutose 1,6-bisfosfatase
Inibida por AMP
Inibida por frutose 2,6-fosfato