BIOSSEGURANÇA EM
LABORATÓRIO DE
PARASITOLOGIA
BIOSSEGURANÇA
É um conjunto de medidas para a
segurança, minimização e controle de riscos
nas atividades de trabalho biotecnológico
das diversas áreas das ciências da saúde e
biológicas.
NÍVEL DE BIOSSEGURANÇA DOS
LABORATÓRIOS DE PARASITOLOGIA
Nível 2 de Biossegurança (NB-2)- agentes de risco
moderado, podendo ser manipulados em bancadas
abertas (potencial de produção de aerossóis e
gotejamento das culturas baixo).
Precauções primárias contra acidentes com objetos
perfurocortantes, exposições cutâneas ou ingestão de
material infeccioso.
Uso de equipamentos de contenção primária: protetor
facial, jaleco e luvas além de disponibilidade de uso de
barreiras secundárias: lavar as mãos e descontaminação
de resíduos.
CLASSE DE RISCO DOS LABORATÓRIOS DE
PARASITOLOGIA
Classe de Risco II. Risco individual moderado e baixo
risco coletivo ou comunitário.
Microorganismos que têm a probabilidade de causar
doença nos homens e em animais, mas com o risco de
propagação limitado; atualmente existem medidas de
prevenção e tratamento.
Exemplos:
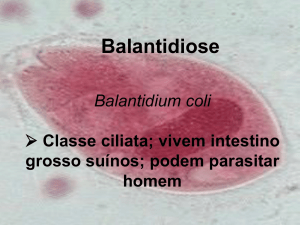
parasita (protozoário) - Leishmania sp, Plasmodium sp,
Trypanosoma sp.
parasita
(helminto)
–
Ancylostoma,
Ascaris,
Schistosoma, Trichuris, Wuchereria, Hymeolepis.
PRODUTOS INDISPENSÁVEIS PARA LIMPEZA DE
MATERIAL DE PARASITOLOGIA CLÍNICA:
- Sabonete e detergente.
- Desinfetante ou Solução de hipoclorito a 50%; Etanol
96% ou Fomaldeido a 1%
- Frasco para descarte de material, contendo
desinfetante ou solução de hipoclorito a 50%;
EQUIPAMENTOS DE PROTEÇÃO INDIVIDUAL
(EPI)
LUVAS
As luvas são usadas como barreira de proteção prevenindo contra
contaminação das mãos ao manipular material contaminado,
reduzindo a probabilidade de que microrganismos presentes nas
mãos sejam transmitidos durante procedimentos.
O uso de luvas não substitui a necessidade da LAVAGEM DAS
MÃOS.
Usar luvas de látex SEMPRE que houver CHANCE DE CONTATO
com sangue, fluídos do corpo, dejetos, trabalho com microrganismos
e animais de laboratório.
Lavar instrumentos, roupas, superfícies de trabalho SEMPRE
usando luvas.
NÃO usar luvas fora da área de trabalho, NÃO abrir portas, NÃO
atender telefone.
NUNCA reutilizar as luvas, DESCARTÁ-LAS de forma segura.
JALECO
Os jalecos são usados para fornecer uma barreira de proteção e
reduzir a oportunidade de transmissão de
microrganismos.
Previnem a contaminação das roupas do pessoal, protegendo a pele
da exposição a sangue e fluidos corpóreos, salpicos e
derramamentos de material infectado.
São de uso constante nos laboratórios.
Devem sempre ser de mangas longas, confeccionados em algodão
ou fibra sintética (não inflamável).
Uso de jaleco é PERMITIDO somente nas ÁREAS DE TRABALHO.
NUNCA EM REFEITÓRIOS, ESCRITÓRIOS, BIBLIOTECAS,
ÔNIBUS, ETC.
Jalecos NUNCA devem ser colocados no armário
onde são guardados objetos pessoais.
Devem ser descontaminados antes de serem lavados.
NORMAS DE BIOSSEGURANÇA EM
LABORATÓRIO DE PARASITOLOGIA
devem ser usadas luvas e uma cobertura protetora ou
avental quando se manipulam fezes ou outras
amostras;
as mão devem ser lavadas com sabão desinfetante ao
entrar no laboratório e após a retirada das luvas;
as vestes de laboratório jamais devem ser usadas fora
dele;
nada deve ser levado à boca quando se está no
laboratório;
NORMAS DE BIOSSEGURANÇA EM
LABORATÓRIO DE PARASITOLOGIA
evitar tocar o rosto com as mãos, e não colocar
objetos de uso pessoal, como óculos ou livros, sobre a
bancada de trabalho;
deve-se tomar cuidado para deixar toda a área de
trabalho limpa e desimpedida. A bancada de trabalho
deve ser limpa com desinfetante ou uma solução de
hipoclorito a 50% antes e depois do trabalho;
todos os materiais contaminados devem
imediatamente colocados em desinfetante
recipiente adequado para descarte;
ser
ou
MANUSEIO DAS AMOSTRAS
Amostras de Fezes
Evitar o contato com a pele;
Após o exame do material colocar a amostra em
solução desinfetante e posteriormente recipiente de
descarte.
Lâminas utilizadas em exames microscópicos
Descartar em recipiente com solução de hipoclorito
ou em recipiente para descarte se não puder ser limpa
para reutilização.
MANUSEIO DAS AMOSTRAS
Amostras de Sangue
Evitar derrubar sangue na pele ou nas mucosas;
Cubra
qualquer
impenetrável;
machucado
com
curativo
Não pipetar com a boca;
Agulhas ou lancetas usadas devem ser descartadas
em recipiente que possa ser incinerado;
Não deixar lancetas e agulhas jogadas sobre a
superfície de trabalho
DIAGNÓSTICO
PARASITOLÓGICO DE FEZES
EXAME PARASITOLÓGICO DE FEZES - EPF
Objetivo
Diagnosticar os parasitos intestinais do homem (e
animais) através da pesquisa das diferentes formas
parasitárias:
Helmintos – ovos e/ou larvas
Protozoários – trofozoitos, cistos ou oocistos.
IDENTIFICAÇÃO
PARASITA:
SEGURA
E
CORRETA
DE
UM
Critérios morfológicos –
Colheita bem-feita e
Boa preservação das amostras fecais.
Material fecal inadequadamente colhido, velho ou
mal preservado - pequeno valor diagnóstico
Exame macroscópico das fezes deve sempre preceder
ao exame microscópico.
COLHEITA DE MATERIAL:
Qualquer evacuação do dia.
Colher: diretamente no frasco ou
urinol, jornal ou papel limpo e transferi-lo
FEZES EMITIDAS ESPONTANEAMENTE:
Tipo de recipiente: limpo e seco, boca larga, 100ml,
vedação hermética (impede o derrame e preserva a
umidade).
Volume: exames macro e microscópico satisfatórios –
enviar ao laboratório todo o bolo fecal – ou 20 a 30g –
diferentes técnicas.
Cuidados
Drogas e compostos químicos:
Antibóticos Tetraciclinas- flora intestinal normal diminuição ou ausência temporária de organismos nas
fezes - parasitas alimentam-se de bactérias intestinais intervalo de 2 a 3 semanas após a administração.
Bário ou bismuto (contraste radiológico sulfato de
bário) - ação abrasiva - destruição de trofozoítos.
Somente após 7 a 10 dias
Informações necessárias:
- Nome do paciente.
- Número de identificação.
- Nome do médico.
- Data e horário da coleta.
- Requisição médica – sintomas clínicos e procedimento
laboratorial.
*OBS Amostras fecais de pacientes imunodeprimidos
(AIDS) - protegidos por um invólucro de plástico e
identificados com etiqueta vermelha ou HIV positivo.
FICHA DE IDENTIFICAÇAO
EXAME PARASITOLÓGICO DE FEZES
MODELO DE FICHA DE IDENTIFICAÇÃO DO MATERIAL
FICHA
NO______
NOME:____________________________________________________________
_____
DATA DE EMISSÃO DAS FEZES:_____/_____/_______
DATA DE RECEBIMENTO DAS FEZES:_____/_____/_______
CONSISTÊNCIA DAS FEZES:
___FORMADAS ___PASTOSAS ___DIARRÉICAS
ACONDICIONAMENTO: ____GELADEIRA _____FORMOL
____MIF
MÉTODOS DE EXAMES
SOLICITADOS:___________________________________
. Números de amostras:
*Qualidade de amostra.
*Análise realizada.
*Gravidade da parasitose.
AMOSTRAS MÚLTIPLAS:
Em amostras múltiplas a possibilidade de encontrar
parasitas aumenta, em razão:
A . da distribuição não uniforme dos ovos de helmintos.
B . dos estágios dos protozoários.
C . das limitações das técnicas de diagnósticos.
D. da intermitência da passagem de certos parasitas.
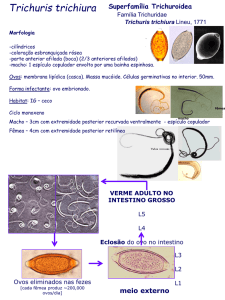
Ex: - A. lumbricoides, Ancilostomídeos e T. trichiura
emitem ovos com certa continuidade – detectados
diariamente nas fezes.
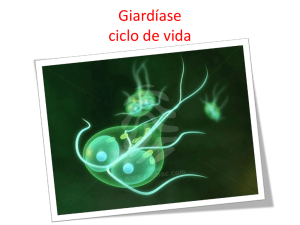
Protozoários: emissão dos estágios é irregular – cistos
de G. lamblia: intermitência de passagem com intervalos
de 2 a 8 dias.
Procedimento ideal: Coletar, em dias separados, uma
série de 3 amostras em 10 dias ou uma série de 6
amostras, em dias alternados, dentro de 14 dias.
* antes de iniciar o tratamento: coleta de 3 amostras – 2
evacuações normais e 3ª , depois da administração de
um laxante.
* após o tratamento:
Para protozoários: coletar 3 amostras de 3 a 4 semanas
após o tratamento.
Para helmintos: controle 1 a 2 semanas após o
tratamento. Para tênias: novo exame após 5 a 6
semanas.
FEZES EMITIDAS ATRAVÉS DE LAXANTES
Objetivo: Fezes liquefeitas (administração de laxantes) –
estabelecer e confirmar diagnóstico de amebíase, giardíase e
estrongiloidíase.
Indicação: (solicitação médica) – série de exames negativos –
pesquisa-se ovos, larvas, cistos e trofozoítas.
Laxantes indicados: laxantes salinos: fosfato de sódio e
sulfato de sódio – menos danos morfológicos aos parasitas.
Procedimento: Fezes induzidas por laxantes – coletar todo
o bolo fecal – envio imediato ao laboratório; caso contrário –
uma fração da amostra em APV (álcool polivinílico).
Prática do uso de laxantes: Indicada para clínicas e
hospitais onde as amostras fecais são recebidas pelo
laboratório imediatamente após a coleta.
ESTABILIDADE DAS AMOSTRAS:
Amostras líquidas: 30 minutos após a evacuação.
Amostras pastosas: examinar uma hora após a
evacuação.
Não sendo possível observar a orientação: o material
deverá ser preservado.
Amostras pastosas: 24 h após evacuação.
MÉTODOS DE PRESERVAÇÃO
Objetivo: Preservar a morfologia dos protozoários e
prevenir um contínuo desenvolvimento de alguns ovos e
larvas de helmintos.
Tipos de Preservação:
*Temporária: refrigeração (3–5°C) em recipientes
hermeticamente fechados - evita o dessecamento - ovos ,
larvas e cistos viáveis vários dias.
Exceção: larvas de S. stercoralis e dos ancilostomídeos
poderão sofrer alterações morfológicas.
* Permanentes: (trofozoitas , cistos, ovos e larvas).
fixadores: solução de formaldeído 5 ou 10% (formalina),
MIF (mertiolato-iodo-formaldeído), SAF (acetato de
sódio-ácido acético-formaldeído), álcool polivinílico
(APV).
Métodos de Preservação mais comuns :
1 – Frio: as fezes são mantidas em geladeira ou em
caixas contendo gelo e serragem. Enquanto a
temperatura permanecer baixa (5 a 10ºC) não haverá
putrefação. As fezes podem vir a ser examinadas em até
2 ou 3 dias após a sua emissão.
2 – Formol a 10%, MIF, SAF
Homogeneizar as fezes em solução de formol a 10%,
MIF ou SAF (colocar as fezes num vidro de boca larga e
adicionar
o
dobro
do
volume
em
formol,
homogeneizando).
Os
cistos,
ovos
ou
larvas
permanecem conservados por mais de um mês.
OBS: Qualquer conservador é usado na proporção
de 2 a 3 partes para uma parte de fezes.
3 – MIF (Mertiolato ou Mercúrio-cromo + Iodo = Formol).
SOLUÇÃO
água destilada..........................................250 ml
sol. de mercúrio-cromo a 1 500..............250 ml
formol 10% ............................................. 25 ml
glicerina ................................................... 5 ml
4 – SAF (Sódio + Ácido Acético + Formol):
acetato de sódio .......................................1,5 g
ácido acétido ...........................................2,9 g
formol 40% .............................................4,0 ml
água destilada ........................................92,5 ml
PREPARAÇÃO E EXAME DE AMOSTRAS FECAIS:
EXAME MACROSCÓPICO: Amostras não preservadas
Determinar: consistência, odor, cor, presença ou ausência
de sangue, muco, proglotes e vermes adultos.
Material fecal varia quanto a sua consistência e é
classificada em:
Fezes formadas. Pastosas. Líquidas (diarréia).
Estágios morfológicos x consistência das fezes:
Trofozoítas de protozoários – fezes líquidas, pastosas ou nas
mucossanguinoletas.
Cistos de protozoários – fezes formadas.
Ovos e larvas de helmintos – todos os tipos de amostras
fecais.
Realização do exame macroscópico:
Simples observação: Examinar e revolver com bastão
de vidro todo o material fecal evacuado – anotar as
características, coletar vermes adultos ou proglotes de
tênias desejadas .
Tamisação: Emulsionar as fezes com água. Coar a
emulsão através de peneira metálica - pia - com jato
fraco de água corrente.
vantagens: demonstração e coleta de vermes adultos
(pequenos helmintos), proglotes e escólices.
EXAME MICROSCÓPICO:
Método Direto: esfregaços a fresco – mais fácil e usado
na rotina do laboratório- permite visualizar:
protozoários (trofozoítas e cistos) e helmintos (ovos,
larvas e pequenos adultos).
Técnicas de Concentração: melhores resultados.
- Aumenta o número de cistos, oocistos , ovos e larvas;
- Elimina a maioria de detritos fecais;
- facilita a identificação (organismos inalterados)
Tipos: Sedimentação
Flutuação
TÉCNICAS DE SEDIMENTAÇÃO:
-Princípio: Os organismos são sedimentados pela
gravidade ou centrifugação. Os cistos, ovos e larvas são
retidos no fundo do tubo, enquanto os detritos são
suspensos para a superfície, não interferindo no
diagnóstico.
-Objetivos: Aumento do número de ovos larvas ou
cistos, e a separação das gorduras da maioria dos
detritos.
-Desvantagens: Grande quantidade de detritos fecais
no sedimento – identificação dos parasitas mais difícil.
-Técnicas de sedimentação mais usadas: Lutz, Hoffman, Pons & Janer (HPJ);
Ritchie (formalina – éter); - Blagg (MIF).
TÉCNICAS DE FLUTUAÇÃO:
-Princípio: Baseado na diferença de densidade
específica entre os ovos de helmintos, cistos de
protozoários e o material fecal, organismos flutuam na
superfície dos reagentes (reagentes de alta densidade) .
-Vantagens: formação na superfície do tubo de uma
membrana clara com poucos detritos fecais e a
remoção seletiva de ovos e cistos, mesmo quando em
pequeno número no bolo fecal.
- Desvantagens: Alta densidade dos reagentes –
alteração na parede dos ovos e dos cistos – dificulta a
identificação.
- Técnicas de flutuação mais usadas: - solução
saturada de NaCl (WILLIS); - sulfato de zinco (Faust)
MÉTODOS QUALITATIVOS X QUANTITATIVOS
Métodos qualitativos - demonstra a presença das
formas parasitárias, sem, entretanto quantificá-las.
Métodos quantitativos - contagem dos ovos nas fezes,
avalia a intensidade do parasitismo.
Ex: o Kato-katz - levantamentos epidemiológicos de
Esquistossomose.
EXAME PARASITOLÓGICO DE FEZES
Paciente _________________________________________ Data _______
Médico ___________________________________________N0 _________
RESULTADO
“Positivo”
Ovos de Ascaris lumbricoides
Lavas de Strongyloides tercoralis
Cistos de Giardia lamblia
“Negativo”
Não foram vistos ovos, larvas e cistos de parasitos
Observação: a técnica usada não é indicada para a pesquisa de
ovos de Enterobius vermicuralis
EXAME PARASITOLÓGICO DE FEZES
MODELO DE FICHA DE IDENTIFICAÇÃO DO MATERIAL
FICHA NO______
NOME:_________________________________________________________________
DATA DE EMISSÃO DAS FEZES:_____/_____/_______
DATA DE RECEBIMENTO DAS FEZES:_____/_____/_______
CONSISTÊNCIA DAS FEZES: ___FORMADAS ___PASTOSAS ___DIARRÉICAS
ACONDICIONAMENTO: ____GELADEIRA _____FORMOL
____MIF
MÉTODOS DE EXAMES SOLICITADOS:___________________________________
RESULTADO DO EXAME
□NEGATIVO
□POSITIVO
RESULTADO POSITIVO PARA:
TROFOZOÍTAS DE PROTOZOÁRIOS
□Giardia lamblia
□Entamoeba histolytica
□Entamoeba coli
□Endolimax nana
□Iodamoeba bütschlii
CISTOS DE PROTOZOÁRIOS
□Giardia lamblia
□Entamoeba histolytica
□Entamoeba coli
□Endolimax nana
□Iodamoeba bütschlii
LARVAS DE NEMATELMINTOS
□ Strongyloides stercoralis
□ Ancylostomatidae
OVOS DE PLATELMINTOS/NEMATELMINTOS
□ Schistosoma mansoni
□ Taenia sp.
□ Hymenolepis nana
□ Ascaris lumbricoides
□ Trichuris trichiura
□ Enterobius vermicularis.
□ Strongyloides stercoralis
□ Ancylostomatidae
OUTROS:________________________________________________________________
FUNCIONÁRIO RESPONSÁVEL:____________________________________________
RESPONSÁVEL TÉCNICO:_________________________________________________