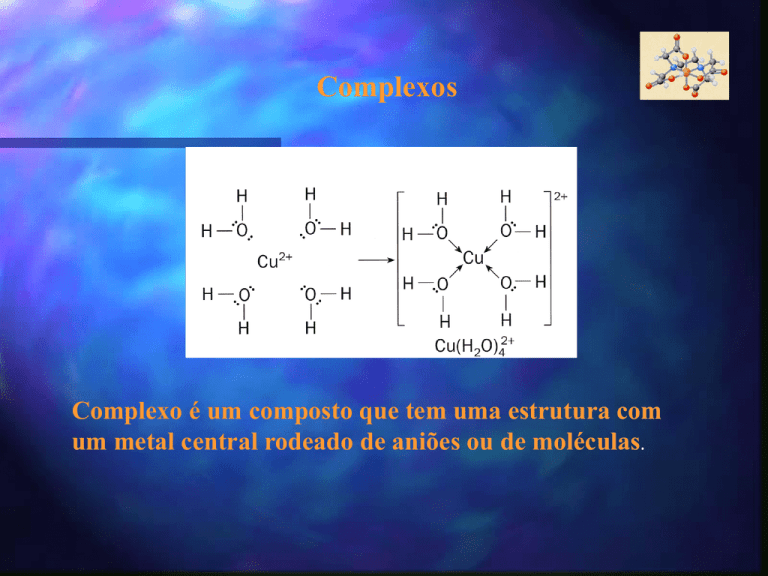
Complexos
Complexo é um composto que tem uma estrutura com
um metal central rodeado de aniões ou de moléculas.
Formação de um complexo
Um ião metálico central é rodeado de moléculas de água
As moléculas de água orientam – se de acordo com a
atracção electrostática entre a carga do ião ( positivo) e os
pares de electrões não partilhados da molécula de água que
é o ligando
Nos iões complexos :
Designa –se por ligando as moléculas ou iões que
possuem pares de electrões não ligantes
O átomo central é um ião do metal (aceita electrões )
A ligação coordenada envolve pares de electrões
não ligantes dos ligandos
Designa – se por nº de coordenação o nº de pares
electrónicos aceites pelo átomo central
Cu ( H2O )42+
Ião central – Cu2+
Ligando – H2O
Nº coordenação - 4
Co Cl ( NH3 )52+
Ião central – Co+
Ligandos – Cl - e NH3
Nº coordenação - 6
Classificação dos ligandos
• monodentados – ligandos que partilham apenas um par
de electrões com o átomo central
• polidentados – (bidentado , tridentado ,..) - ligandos que
partilham mais do que um par de electrões
com o átomo central
• Sempre que um ião complexo contém um ou mais
iões polidentados designa – se por quelato
A molécula 1,2 – diaminoetano
liga – se ao metal central por
dois pares de electrões ( um de
cada átomo de azoto ) N desta
molécula – é um ligando
bidentado
e
EDTA
EDTA é o acrónimo em inglês: EthyleneDiamineTetrAcetic
acid.(ácido etilenodiamino tetra-acético).
É um composto orgânico que age como ligando
polidentado, formando complexos muito estáveis com
diversos iões metálicos.
Geometria dos iões complexos
Linear – corresponde a nº coordenação dois , 2
Tetraedrica – corresponde a nº coordenação quatro, 4
Quadrangular plana – corresponde a nº coordenação
quatro, 4
Octaédrica – corresponde a nº coordenação seis, 6
Geometria dos iões complexos
Ag(NH3)2+
Zn(NH3)42+
Pt(NH3)42+
Ni(NH3)62+
Aplicações dos complexos
Química
Produtos de limpeza – O EDTA é um agente complexante
capaz de formar quelatos com metais como Ca2+ Mg2+, criando
um complexo iónico solúvel evitando a fixação cálcio em
tubagens e materiais
Limpar ferrugem – o oxido de ferro é insolúvel em água, mas
dissolve – se na presença de ácido oxálico dando origem ao
ião complexo trioxalato ferrato (III) [ Fe ( C2O4)3 ]3 – solúvel
Metalurgia
Processos de extracção de metais nobres , prata e ouro , a
partir do minério
4 Au(s) + 8 CN – (aq) + O2 (g) 4 [ Au ( CN)2 ] – ( aq) + 4HO – (aq)
Zn(s) + 2 [ Au ( CN)2 ] – ( aq) [ Zn ( CN)4 ]2 – ( aq) + Au(s)
Medicina
Um dos complexos de maior
sucesso na área da terapêutica é a
cisplatina [Pt(NH3)2Cl2]
cisplatina [Pt(NH3)2Cl2]
Este complexo tem a capacidade de se introduzir nas
cadeias de ADN do núcleo das células .Como
consequência desta introdução anómala na cadeia ADN
, a célula deixa de se replicar o que permite que a
cisplatina seja um instrumento eficaz na cura do cancro
É injectada nas células tumorais o que as impede de se
replicarem.
Possui no entanto grandes efeitos secundários a nível renal
Medicina
EDTA é um composto orgânico que age como ligante
polidentado, formando complexos muito estáveis com
diversos iões metálicos. Devido a isso, é usado como
preservante do sangue, pois "inactiva" os iões de cálcio,
que promovem a coagulação sanguínea.
Esta habilidade de complexar e
assim "inactivar" iões metálicos é
também usada como antídoto para
envenenamento por chumbo
Medicina
Complexos de gadolínio utilizam –
se na Imagiologia Médica formando
o complexo DOTA
DOTA – ácido 1,4,7,10 –tetraazaciclododecano-1,4,7,10teraacético – gadolínio , que actua como agente de contraste na
ressonância magnética nuclear - RMN
Industria
Complexos de európio podem ser usados em sistemas
luminescentes
Complexos de európio e térbio são usados em
pigmentos para tintas
Bioquímica
A molécula de hemoglobina
(C2952H4664O832N812S8Fe4) é um
complexo de ferro , podendo ser
dividida em mais de 500 aminoácidos.
A parte principal da molécula é um
anel heterocíclico contendo um átomo
de ferro. Este átomo de ferro é o
responsável por manter o oxigénio
ligado à molécula e assegurar o
transporte de oxigénio no sangue .
A Cor
A cor resulta da absorção
selectiva de radiação visível
• Quando a luz branca incide
sobre um material, algumas
radiações são absorvidas
outras podem ser transmitidas
e outras reflectidas
Componente da luz branca . Vermelho,
verde,azul; reflectidas pelo branco, absorvidas
pelo preto e transmitidas por objectos
transparentes incolores
A Cor
A Cor
cor
comprimento de onda frequência
vermelho
~ 625-740 nm
~ 480-405 THz
laranja
~ 590-625 nm
~ 510-480 THz
amarelo
~ 565-590 nm
~ 530-510 THz
verde
~ 500-565 nm
~ 600-530 THz
ciano
~ 485-500 nm
~ 620-600 THz
azul
~ 440-485 nm
~ 680-620 THz
violeta
~ 380-440 nm
~ 790-680 THz
Espectro Contínuo
A cor dos complexos está relacionada com a absorção de radiações
em zonas específicas do espectro visível devido a transições
electrónicas entre as orbitais d .
A Cor nos complexos
A cor dos complexos dos metais de transição pode ser
relacionada com a presença de orbitais d
As orbitais a vermelho orientam
– se na direcção dos eixos
As orbitais a azul orientam – se
na direcção entre os eixos
O conjunto das orbitais d apresenta simetria esférica
A Cor nos complexos
A cor dos complexos dos metais de transição pode ser
relacionada com a presença de orbitais d vazias ou semi
preenchidas e com a presença de electrões não
emparelhados no metal
Nos complexos as orbitais d não apresentam todas a
mesma energia, embora a energia total permaneça
constante
Teoria do campo cristalino dá uma explicação de
como se processa a distribuição energética das orbitais d
Foi utilizada com sucesso para explicar a cor,
propriedades magnéticas, espectro electrónico (Uv-Vis)
e de ressonância paramagnética electrónica (RPE) de
compostos de coordenação de metais detransição.
Teoria do campo cristalino
Quando os pares de electrões dos ligandos se aproximam
do átomo central para estabelecer ligação coordenada, as
orbitais d do metal, que se orientam preferencialmente para
receber os pares de electrões dos ligandos, sofrem um
aumento de energia
O aumento de energia deve – se ao aumento de repulsões
entre um electrão do metal nessa orbital e o par electrónico
do ligando
A energia total das orbitais d tem de se manter constante ,
assim as restantes orbitais d sofrem um decréscimo de energia
para compensar o aumento sofrido pelas outras orbitais d
Complexo octaedrico
Os ligandos aproximam – se ao logo
dos eixos x , y e z
Esta aproximação afecta
principalmente as orbitais
x2-y2 e z2
As orbitais afectadas vão depender da distribuição espacial
dos ligandos – da geometria do complexo
Geometria octaedrica – maior diferença de energia entre as
orbitais de maior e menor energia
Geometria tetraedrica – menor diferença de energia entre as
orbitais de maior e menor energia
A cor nos complexos é consequência de absorções de radiação
visível que ocorrem normalmente entre orbitais d do metal
Complexo octaedrico
As orbitais d desdobram – se em orbitais de maior e de
menor energia
A diferença de energia entre
estas orbitais é representado
por o
Energia das orbitais d
antes da aproximação
do ligando
Energia das orbitais d
depois da aproximação
do ligando
Complexo tetraedrico
Neste tipo de complexos os ligandos aproximam – se das
orbitais dxy , dxz ´e dzy
A separação das orbitais
d é oposta à observada
para os complexos
octaedricos
A diferença de energia entre estas orbitais é representado por T e
tem valor inferior a o
A Cor em conclusão
A cor de um ião complexo depende :
Do nº de electrões presentes nas orbitais d do ião metálico
central
Do arranjo dos ligandos à volta do ião central ( geometria do
complexo ) , pois isso afecta a separação das orbitais d
Da natureza do ligando , já que diferentes ligandos têm
diferentes efeitos nas energias relativas das orbitais d
Das transições entre orbitais d de diferentes energias