O ELEMENTO CARBONO
1
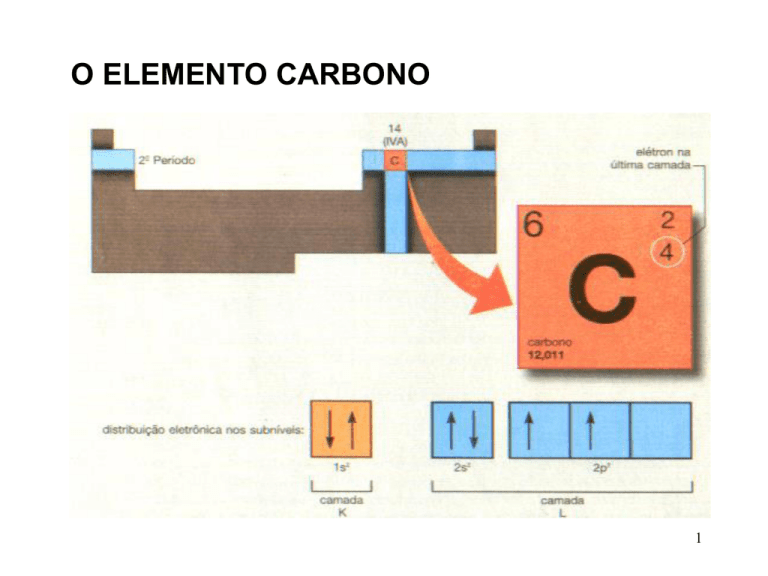
A DISTRIBUIÇÃO DOS ELÉTRONS NO
ÁTOMO DE CARBONO
2
Hibridização de orbitais atômicos
• É a mistura de orbitais pertencentes a um mesmo
átomo, originando novos orbitais iguais entre si,
mas diferentes dos orbitais originais.
• A diferença destes novos orbitais atômicos,
denominados orbitais híbridos, acontece tanto na
geometria(forma) como no conteúdo energético.
• O número dos orbitais híbridos obtidos será o
mesmo dos orbitais existentes antes de serem
misturados.
3
Hibridização
3
sp
• É a mistura de 3 orbitais p “puros” com um
orbital s “puro”, formando 4 novos orbitais
“híbridos” denominados sp3.
• A geometria dos 4 orbitais sp3 é tetraédrica (os 4
orbitais partem do centro do tetraédro e dirigemse, cada um, para um dos vértices do tetraédro).
• O ângulo entre os orbitais sp3 será de aprox.109°
• Acontece no C que se liga através de 4 ligações
simples ( o C é tetravalente).
4
2p
hibridação
2s
sp3
5
Fórmula molecular do metano: CH4
H
Fórmula estrutural do metano: H
C
H
H
Lembrando, 4 ligações simples sp3 ( 4 orbitais híbridos).
Hidrogênio possui 1s orbital não hibridizado.
6
FORMA DAS MOLÉCULAS
sp3 - tetraédrica
H
C
N
H
H
H
sp3
H
H
O
H
H
sp3
H
sp3
7
Hibridização
2
sp
• É a mistura de um orbital s com dois orbitais p
(pertencentes a um mesmo átomo), resultando em
3 novos orbitais denominados híbridos sp2.
• Os três orbitais híbridos sp2 situam-se num mesmo
plano formando ângulos de 120° entre si
(geometria plana triangular).
• Acontece com C que possua uma dupla ligação.
• Num C do tipo sp2 existirá um orbital p “puro”
que será responsável pela ligação covalente do
tipo pi.
8
HIBRIDIZAÇÃO DO CARBONO sp2
Etileno
H
H
C
C
H
H
Cada carbono é hibrido sp2 . O hidrogênio é 1s.
Uma ligação da dupla é sp2 - sp2. A outra é p - p.
2p
2p
hibridação
2s
sp2
9
C
C
Observe que a dupla ligação consiste numa ligação
do tipo s e outra do tipo p.
10
H
H
C C
H
H
H
H
C
H
C
H
11
Exemplo de hibridação sp2 H2C=CH2
• Molécula de eteno (etileno).
• Os dois átomos de C encontram-se ligados
por uma dupla ligação Uma ligação sigma
sp2-sp2 e uma ligação pi).
• Cada átomo de C encontra-se ligado a dois
átomos de H (duas ligações sigma s-sp2).
12
A Molécula de C2H4
13
Os ângulos de ligações no C2H4
• Como os átomos centrais são dois carbonos
de hibridação sp2 o ângulo entre as ligações
sigma será de 120. observe que a ligação
p é perpendicular ao plano que contém a
molécula.
• C com uma dupla ligação hibridação sp2
Numa dupla ligação uma ligação s e uma ligação p
14
HIBRIDIZAÇÃO sp2
sp2 - trigonal planar
p ligação
H
H
C
H
H
C
H
C
H
eteno
(etileno)
H
H
120°
C
C
H
H
H
C
H
sligação
15
16
OUTRAS MOLÉCULAS PLANAS
TRIGONAIS
hibridação sp2 geometria trigonal planar
H
C O
H
H
C N
H
H
H
H
H
H
H
H
neste exemplo, cada
carbono é sp2
17
Hibridação sp
• É a mistura de um orbital s com 1 orbital p,
produzindo dois novos orbitais denominados
híbridos sp.
• Os orbitais híbridos sp formam um ângulo de 180
entre si.
• A geometria molecular será linear.
• Surge em C com duas duplas ou C com uma tripla
ligação.
• Numa tripla ligação ter-se-á uma ligação sigma e
duas pi.
18
Exemplo de hibridação sp C2H2
• Etino (acetileno)
• Em torno dos átomos de C existem dois orbitais híbridos sp
e dois orbitais p “puros”.
• Os dois orbitais híbridos se ligarão através de ligações
sigma s-sp (H-C) e sigma sp-sp(C-C).
• Os dois orbitais p de cada carbono se ligarão produzindo
duas ligações pi entre os carbonos (resultando numa tripla
ligação entre os dois carbonos).
• Liga tripla uma ligação s e duas ligações p
19
Fórmula estrutural do acetileno
H C
C
H
Cada átomo de carbono é um híbrido sp.
Os hidrogênios possuem orbitais 1s, não hibridizados.
2p
2p
hibridação
sp
2s
Observe que a tripla ligação consiste de uma s e 2p .
As duas ligações pprovem dos orbitais p, não hibridizados.
20
A Molécula de C2H2
21