Unidade 4 – Metabolismo de Carboidratos
Introdução
Carboidratos (C, H, O) = nutrientes mais abundantes na
natureza e representam a fonte primária de energia para os
organismos vivos
Solúveis (Extrativo Não Nitrogenado)
Monossacarídeos
Trioses (C3H6O3)
Tetroses (C4H8O4)
Pentoses (C5H10O5)
Hexoses (C6H12O6)
Heptoses (C7H14O7)
Aldoses
Gliceraldeído
Eritrose
Xilose
Ribose
Arabinose
Glicose
Galactose
Manose
-
Cetoses
Dihidroxiacetona
Eritrulose
Xilulose
Ribulose
Frutose
Sorbose
Sedoheptulose
Dissacarídeos
• Sacarose (-d-glicose 1-5 -d-frutose)
• Lactose (-d-galactose 1-4 -d-glicose)
• Maltose (-d-glicose 1-4 -d-glicose)
• Celobiose (-d-glicose 1-4 -d-glicose)
Trissacarídeos
• Rafinose (frutose-glicose-galactose)
Polissacarídeos
• Amido (amilose, amilopectina)
• Glicogênio
• Polissacarídeos não amiláceos solúveis - PNAS (arabinoxilanos,
galactomananos, galactoglucomananos e galactoglucanos)
Insolúveis
FDN - Fibra detergente neutro (celulose + hemi-celulose
+ lignina)
FDA - Fibra detergente ácido (celulose + lignina)
Monômeros ligados por ligações ß1 4
Celulose : Polissacarídeo linear formado por moléculas de glicose
unidas entre si por ligação ß1,4
Monogástricos não produzem enzimas capazes de
hidrolisar
Enzimas dos microrganismos
Digestão microbiana nos cecos e cólon
Amido reserva energética dos vegetais
•Amilose cadeia linear. Ligações (14)
•Amilopectina cadeia ramificada. Ligações (14) e (16)
Glicogênio reserva de energia
dos animais
Ramificações: ligações (14) e
(16)
Celulose parede celular
das células vegetais
Cadeia linear de glicose:
ligações (14)
enzimas dos animais
vertebrados não hidrolisam
fermentação microbiana
FIBRA DETERGENTE NEUTRO
(Van Soest & Moore, 1965)
PAREDE CELULAR
CONTEÚDO CELULAR
• CELULOSE
• HEMICELULOSE
• LIGNINA
• PECTINA
• AMIDO
• AÇÚCARES
• PROTEÍNAS
• LIPÍDIOS
• SAIS MINERAIS
• ÁCIDOS NUCLÉICOS
Tipo
Nome
Fonte
MONOSSACARÍDEOS
Trioses (C3H6O3)
Dihidroxiacetona
Gliceraldeído
Produtos de fermentação e da glicólise.
Pentoses (C5H10O6)
Arabinose
Xilose
Ribose
Hidrólises e arabanos
Hidrólises de xilanos
Ácidos nucléicos
Hexoses (C6H12O6)
Glicose
Manose
Galactose
Frutose
Hidrólise de amino, glicogênio, e maltose.
Suco de frutas
Leite (hidrólise de lactose) e galactosídeos.
Hidrólise de sacarose
DISSACARÍDEOS
(C12H22012)
Sacarose
Maltose
Trealose
Lactose
Açúcar de cana, beterraba, etc
Amido
Cogumelo
Leite
TRISSACARÍDEOS
(C18H32O18)
Rafinose
Gossipose
Suco de beterraba
Semente de algodão
POLISSACARÍDEOS – grupos compostos de cadeias longas de sacarídeos.
Amido, glicogênio, celulose, dextrose, pectinas, galactosídeos, entre outras.
DIGESTÃO
NÃO RUMINANTES
RUMINANTES
X
Digestão Microbiana
Digestão Microbiana
Digestão Enzimática
Digestão Enzimática
Digestão Microbiana
BOCA
ESTÔMAGO
INTESTINO DELGADO
Amilase (PAN)
Sacarase (ID)
Amilase
Na
AMIDO
AMIDO
AMIDO
Amilose
maltose
maltotriose
maltose
Amilopectina
maltotriose
GLICOSE
Dextrina
SACAROSE
FRUTOSE
Sacarase (ID)
Na
LACTOSE
GALACTOSE
Lactase (ID)
CELULOSE
CELOBIOSE
SGLT1 (Sodium dependent GLucose Transporter 1) – Transporta a glicose do
lúmen intestinal para dentro do enterócito - Cotransporte ativo sódio dependente
GLUT1 – transporta glicose do enterócito para o sangue a favor do gradiente
de concentração
Captação de glicose nos tecidos
Difusão facilitada – transportadores de glicose (GLUT 1 a 4)
GLUT1 – Alta afinidade pela glicose responsável pelo
nível basal de glicose atividade não é alterada pela
insulina
GLUT1 e GLUT 3 – transporte de glicose para o cérebro
não é dependente de insulina
GLUT2 – Fígado, pâncreas, mucosa intestinal e rins não é
dependente de insulina
GLUT4 – Transportador de glicose insulino-sensível
tecido adiposo e muscular
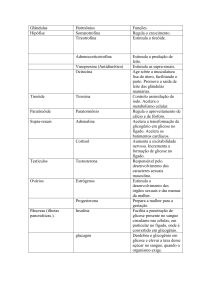
REGULAÇÃO DA GLICEMIA
Hormônios: Insulina e glucagon
Açúcar no sangue regulado pela Insulina e Glucagon;
Glicose alta
pâncreas libera insulina
Glicose baixa
pâncreas libera glucagon
Somatostatina – regula liberação de insulina e glucagon
Glicose
alta
Glicose
baixa
Liberação da Insulina
• Após detectar excesso de glicose (HIPERGLICEMIA);
• Exerce três efeitos principais:
• Estimula captação de glicose pelas células;
• Estimula a glicogênese;
• Estimula armazenamento de aa e ácidos graxos.
GLUCAGON
•
•
•
•
Efeito antagônico à insulina;
Formado pelas células pancreáticas;
Liberado na HIPOGLICEMIA;
Função:
• Estimula degradação de glicogênio hepático e
muscular;
• Estimula mobilização de aa e ácidos graxos;
• Estimula lipólise.
Metabolismo dos carboidratos
Vias catabólicas:
1 - Glicólise aeróbica (piruvato)
2 - Glicólise anaeróbica (ac. láctico)
Vias anabólicas:
1 - Glicogênese
2 – Ciclo das pentoses
3 – Cadeia respiratória
4 - Gliconeogênese
Destinos Metabólicos dos Carboidratos Dietéticos
Não digerido
Fornecimento de energia : Produção de ATP
GLICÓLISE
A oxidação da glicose
em ácido pirúvico
primeira etapa no
catabolismo de
carboidratos.
Fonte: Tortora, G.J. 8ª ed.; 2006
Fosforilação da glicose
Reação catalisada pela enzima hexoquinase nos tecidos e
pela glicoquinase no fígado, é irreversível
Hexoquinase alta afinidade (baixo Km), baixa Vm e é
inibida pelo produto
Glicoquinase menor afinidade (alta Km), alta Vm e é não
inibida pelo produto
Fosforilação da glicose impede saída da célula
molécula carregada negativamente impossível atravessar
passivamente a membrana celular
Indução e repressão da síntese
Insulina
Glucagon
Insulina
Glucagon
Glucagon
Glucagon
(Stryer, 2004)
Produção de acetil-CoA a partir do piruvato
Ciclo de Krebs
• Sinônimos:Ciclo dos ácidos tricarboxílicos
Ciclo do ácido cítrico
• Conceito:
Via catabólica cíclica de oxidação total da glicose a
CO2 e H2O, com liberação de ENERGIA
Só ocorre em condições aeróbicas
• Conhecido como RESPIRAÇÃO CELULAR.
Ciclo de Krebs
• São liberados vários H+, que são capturados pelos NAD
e FAD, transformando-se em NADH e FADH2;
• Ocorre liberação de energia resultando na formação de
ATP
Cadeia Transportadora de Elétrons
• Ocorre nas cristas mitocondriais;
• Também chamado Fosforilação Oxidativa;
• Sistema
de
transferência
de
elétrons
provenientes do NADH e FADH2 até a molécula
de O2
• O elétron “pula” de um citocromo para outro até
chegar no O2, ocorrendo liberação de energia
convertida em ATP
CADEIA DE TRANSPORTE DE ELÉTRONS
A CTE é a convergência final de todas as vias de degradação
oxidativa
Formada por uma série de oxirredutases organizadas em
complexos protéicos na membrana interna da mitocôndria
possibilita a regeneração do NAD+ e do FAD O2 que se
reduz a H2O
A energia livre disponibilizada pelo fluxo de e- criado é
acoplado ao transporte contracorrente de prótons através da
membrana interna da mitocôndria, conservando parte desta
energia como potencial eletroquímico transmembrana
O fluxo transmembrana de prótons “de volta” a favor de seu
gradiente de concentração através dos poros protéicos
específicos fornece energia livre para a síntese para a síntese
de ATP
CADEIA DE TRANSPORTE DE ELÉTRONS
Energia potencial química
NADH
FADH2.
CoQ
52
kcal
Cit bb
Cit cc1
½ O2 + 2H
Cit aa3
H2O
Progressão ao longo da cadeia de transporte de elétrons
CADEIA DE TRANSPORTE DE ELÉTRONS
2e-
2e-
2e-
2e2e
-
2e2e-
+ 2H+
Fosforilação Oxidativa
A transferência de elétrons pela CR é energeticamente
favorável, pois o NADH é um forte doador de elétrons e o
Oxigênio é um ávido aceptor. No entanto, o fluxo de elétrons
através da CR não resulta diretamente em síntese de ATP.
•O evento primário na Fosforilação Oxidativa é a translocação
de prótons H+ gerados pela oxidação para fora da membrana
mitocondrial interna. A membrana é impermeável a íons, isso
gera um potencial químico (diferença de pH) e um potencial
elétrico de 0,14 volts.
Esta diferença de potencial eletroquímico é
usado para ativar uma enzima ATP-sintase
localizada na membrana.
• Desidrogenases geram NADH+H+ e FADH2 que,
na cadeia respiratória, geram uma corrente
elétrica capaz de fazer transporte ativo de
prótons para o espaço intermembrana da
mitocôndria.
• A energia contida nas moléculas combustíveis
(glicose, ácidos graxos) é transferida aos prótons
que, durante sua reentrada na mitocôndria,
permitem a síntese de ATP.
Obtenção de energia
pelo organismo animal
Glicogênese
• Ocorre em todos os tecidos, mais proeminente
no fígado e músculo;
• Fígado armazena glicogênio para enviar
glicose, pelo sangue aos outros tecidos,
quando necessário;
• O músculo armazena apenas para consumo
próprio, só utiliza durante o exercício quando
há necessidade de energia rápida.
Glicogênese
Glicogenina ou fragmento de glicogênio
Sintase iniciadora do glicogênio
Sintase do glicogênio
Glicosil (4:6) transferase
Glicogênese
Fosfoglicomutase
Glicose-1-fosfato
Glicose-6-fosfato
Glicogênio
Glicogênio sintase
Uridina difosfato glicose
Glicogênese no músculo
VIA DAS PENTOSES
• Via alternativa de oxidação das hexoses, independente
da glicólise
• Via citoplasmática, anaeróbica ocorrendo no fígado,
glândulas mamárias, tecido adiposo e nas hemácias
• As funções principais são: produção de NADPH e
ribose-5-P.
Metabolismo de carboidratos durante
o repouso
Estoques de Glicogênio muscular são preservados para
o uso durante alta atividade muscular esquelética.
Os estoques de Glicogênio Hepático são encarregados de
manter a Glicemia entre as refeições
CÉREBRO
SNC
Células Sangüíneas e os rins
Metabolismo de carboidratos no jejum
Insulina
Período de privação
catabólico
Glucagon
Troca de substratos entre fígado,
tec. adiposo, músculos e cérebro
Objetivo
1 – manter glicemia
2 – mobilização de ác. graxos do tecido adiposo e corpos
cetônicos do fígado
Estado inicial do jejum
Após período absortivo Glicose sangüínea
insulina / glucagon
Glucagon
Gliconeogênese
glicogenólise
4 horas após a refeição
Glicose derivada da glicogenólise é liberada para o sangue
Captação reduzida de glicose pelo músculo e adipócitos
(Stryer, 2004)
Manutenção obtida através de 3 fatores principais
1) mobilização de glicogênio e liberação de glicose pelo
fígado
2) Liberação de ac. graxos
3) Utilização de ac. graxos pelo músculo e pelo fígado
Fígado não absorve glicose diretamente do sangue
Glicose recém-sintetizada é usada para repor glicogênio
Jejum prolongado
Alterações no 1º dia de jejum = jejum noturno
Processos metabólicos dominantes
- Mobilização de TAG (lipólise)
- Gliconeogênese
[Acetil CoA] e citrato
inibe glicólise
Músculos
diminui captação de glicose passando a
utilizar ác. graxos
Proteólise
gliconeogênese
Gliconeogênese
Via anabólica que ocorre no fígado e, excepcionalmente no
córtex renal, que é responsável pela síntese de glicose a
partir de fontes que não são carboidratos.
Substratos: lactato, piruvato, glicerol e alfa-cetoácidos
Jejum prolongado
Após 3 dias de inanição
Cérebro
Coração
corpos cetônicos liberados
no sangue
Usam o acetoacetado como fonte de energia
Várias semanas de inanição
Cérebro
corpos cetônicos principal fonte energética
Corpos cetônicos podem atravessar barreira
hemato-encefálica
Jejum prolongado : Cetogênese
Corpos cetônicos sintetizados nas mitocôndrias dos hepatócitos a
partir do excesso de acetil-CoA aumento da lipólise e desvio do
oxaloacetato do CK para a gliconeogênese
sangue
Tecido muscular
Tecido nervoso
Jejum prolongado
Diminuição da degradação protéica
Utilização de 40g de glicose X 120g no início do jejum
Tempo de sobrevivência depende do depósito de TAG
Terminado as reservas de TAG
proteólise
Perda da função cardíaca, hepática e renal
morte
Interações metabólicas