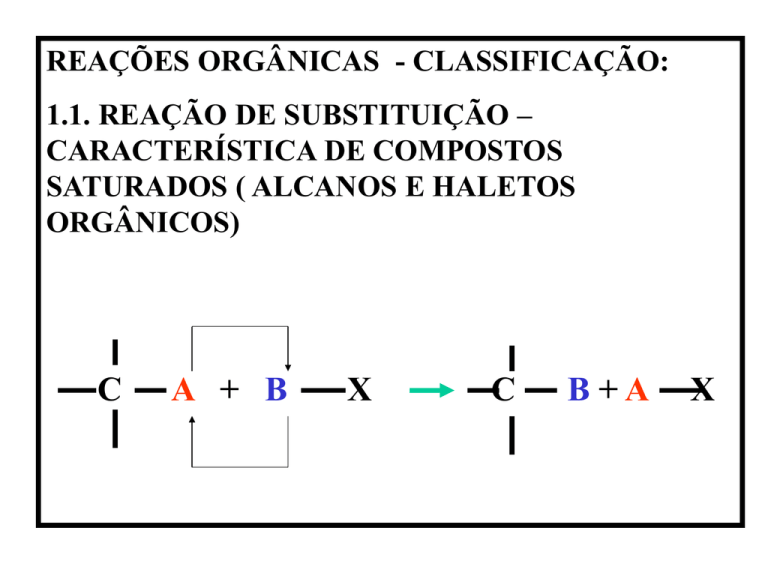
REAÇÕES ORGÂNICAS - CLASSIFICAÇÃO:
1.1. REAÇÃO DE SUBSTITUIÇÃO –
CARACTERÍSTICA DE COMPOSTOS
SATURADOS ( ALCANOS E HALETOS
ORGÂNICOS)
C
A + B
X
C
B+A
X
1.1.1. SUBSTITUIÇÃO EM ALCANOS ( APOLARES
SOFREM CISÃO HOMOLÍTICA) SUBSTITUIÇÃO
POR RADICAIS LIVRES
H
H3C C H + Cl
HCl
H
H
Cl
H3
C
H
Cl +
REAÇÕES DE SUBSTITUIÇÃO
CLORAÇÃO
HCl + R H
HCl + R Cl
BROMAÇÃO
R H + Br Br
HBr + R Br
NITRAÇÃO
OHNO2 + R H
R NO2
+ HOH
SULFONAÇÃO
RH +
HO SO3H
H2O + R SO3H
SUBSTITUIÇÃO EM AROMÁTICOS
NITRAÇÃO
ACILAÇÃO
ALQUILAÇÃO
REAÇÕES ORGÂNICAS
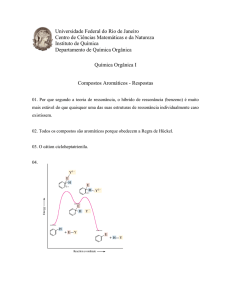
1.
REAÇÕES DE SUBSTITUIÇÃO.
1.1.
ALCANOS: Por serem apolares sofrem cisão
homolítica e a reação ocorre por meio de radicais livres.
EXEMPLO: Halogenação - Cloração do metano:
CH4 + 4Cℓ2
CCℓ4 + 4HCℓ
1.2.HALETOS ORGÂNICOS - Por serem compostos
polares, sofrem cisão heterolítica. Como a molécula
orgânica perde o elétron da ligação com o halogênio, é
atacada por um reagente nucleófilo.
EXEMPLO: Reação com água - Monocloroetano + água.
H3C-Cl + HOH
H3C-OH + HCl
1.3.FACILIDADE
ALCANOS:
DE
SUBSTITUIÇÃO
EM
H LIGADO A C TERCIÁRIO >
H LIGADO A C
SECUNDÁRIO > H LIGADO A C PRIMÁRIO
EXEMPLO: Propano + bromo : produz uma
quantidade maior de 2-bromopropano do que de 1bromopropano.
H3C-CH2-CH3 + Br2
H3C-CH-CH3 + HBr
Br
H3C-CH2 -CH2 + HBr
Br
1.4. SUBSTITUIÇÃO NO BENZENO - O benzeno,
por possuir ligações pi deslocalizadas é atacado por
eletrófilos.
1.4.1 - HALOGENAÇÃO: Reação com cloro em
presença de ferro como catalisador:
H
Cl
+ Cl – Cl
+ HCl
1.4.2 - NITRAÇÃO - Reação com ácido nítrico em
presença de ácido sulfúrico como catalisador.
1.4.3 - SULFONAÇÃO - Reação com ácido sulfúrico em
presença de SO3.
H + OHSO3H
SO3H
+HOH
1.4.4 - ACILAÇÃO DE FRIEDEL-CRAFTS - Reação com
CLORETO DE ACILA, em presença de AlCl3.
1.4.5 - ACILAÇÃO DE FRIEDEL-CRAFTS - Reação
com cloreto de acila, no caso o cloreto de etanoíla, em
presença de AlCl3
H
C=O
O
+
Cl
CH3
C-CH3
HCl
+
1.4.6 - A substituição em derivados do benzeno é
orientada pelo átomo ou grupo de átomos ( diferente
de H ) que está ligado ao anel aromático.
1.4.6.1 - RADICAIS ORTO E PARA-DIRIGENTES:
AMINA, HIDRÓXI, ALCÓXI (ÉTER), RADICAIS
ALQUILA E HALOGÊNIOS. SÃO RADICAIS DE
PRIMEIRA CLASSE OU ATIVANTES.
CH3
CH3
2ON
NO2
+ 3HONO2
NO2
+3H2O
1.4.6.2- RADICAIS META-DIRIGENTES: NITRO,
SULFÔNICO,
CARBOXILA,
ALDOXILA,
CARBONILA, ÉSTER, ACILA E CIANO. SÃO
RADICAIS
DE
SEGUNDA
CLASSE
OU
DESATIVANTES.
NO2
NO2
+ 2Cl-CH3
H3C
CH3 +
2HCl
SOPIM SATURADO
ORTO-PARA
INSATURADO
META
1.4.7 - Substituição em homólogos do benzenos ( diferem
por um ou mais grupos CH2 )
1.4.7.1-NO ANEL: NEVE, NUVEM NOITE EXEMPLO - Cl + tolueno:
CH3
CH3
Cl
Cl
+ 3 Cl
+ 3 HCl
Cl
1.4.7.2 NA CADEIA
CALOR, CLARIDADE, CADEIA
EXEMPLO Cl2 + tolueno:
CH3
CH2Cl
+ Cl2
+ HCl
1.
REAÇÕES DE ADIÇÃO.
A B
C=C
+ 3 AB
C–C
1.1. - ADIÇÃO EM ALCENOS
2.1.2 - HIDROGENAÇÃO - Eteno + H2 ( catalisadores:
platina, paládio ou níquel)
H2C = CH2
+ H2
H3C – CH3
2.1.3 - HALOGENAÇÃO - Adição de F2, Cl2, Br2 e I2
na presença de luz. Propeno + Cl2
Cl Cl
H2C=C-CH3 + Cl2
H2C-CH-CH3
2.1.4 - HALETOS DE HIDROGÊNIO - Segue a regra
de Markovnikov - O hidrogênio do haleto se liga ao
carbono mais hidrogenado da dupla). EXEMPLO:
Propeno + HCl:
Cl
H2-C=CH-CH3 + HCl
H3-C-CH-CH3
2.1.5. BROMETO DE HIDROGÊNIO - KHARASCH
- A reação em presença de peróxidos inverte a regra de
Makovnikov- o hidrogênio liga-se ao carbono menos
hidrogenado da dupla. Propeno + HBr:
H2O2
H2C=CH-CH3 + HBr
H2C-CH2-CH3
Na2O2
2.1.6 - ÁGUA - A adição de água em alcenos ocorre em
meio ácido e obedece à regra de Markonikov. Produz
álcoois.
EXEMPLO: Eteno + água:
MEIO ÁCIDO
H2C=CH2 + HOH
H3C-CH2OH
1.
REAÇÕES DE ADIÇÃO EM CICLANOS. OS
CICLANOS COM ATÉ 5 CARBONOS NA
MOLÉCULA PODEM SOFRER REAÇÕES DE
ADIÇÃO.
1.1. TEORIA DAS TENSÕES DE BAYER - Quanto
mais o ângulo entre as ligações no ciclo se afasta de
10928' mais instável ( e mais fácil de ser rompido) se
torna o ciclano. Isto ocorre na ordem: ciclopropano
(60), ciclobutano (90) e ciclopentano (108).
13.2 EXEMPLOS DE
HALOGENAÇÃO DO:
1.13.2.1.
HIDROGENAÇÃO
E
CICLOPROPANO
Ni/CALOR
+ H2
H3C-CH2-CH3
Ni/CALOR
+ Cl2
CH2Cl
Cl-CH2-CH2-
3.2.2. CICLOBUTANO
Ni/CALOR
+ H2
H3C-CH2-CH2-CH3
Ni/CALOR
+ Cl2
Cl-CH2-CH2-CH2-CH2-Cl
1.1.1.
CICLOPENTANO
+ H2
H3C-CH2-CH2CH2-CH3
Cl
+ Cl2
1.1.1.
CICLO-HEXANO
NÃO REAGE COM H2 – ÂNGULO 109o28’ (TODOS OS
CICLANOS COM MAIS DE 6 CARBONOS)
Cl
+ Cl2
4.REAÇÕES DE ELIMINAÇÃO:
4.1. ELIMINAÇÃO INTRAMOLECULAR DE
HALETOS ORGÂNICOS. PRODUZ ALCENOS É
FEITA COM KOH EM MEIO ALCOÓLICO. O
HIDROGÊNIO
MAIS
FACILMENTE
ELIMINADO: C TERC MAIOR C SEC MAIOR C
PRIMÁRIO, O QUE IRÁ DETERMINAR O
COMPOSTO
OBTIDO
EM
MAIOR
QUANTIDADE.
EXEMPLO
PROPENO.
:
2-CLOROPROPANO
PRODUZ
Cl
H3C-CH-CH3 + KOH
KCl + HOH
+ H2C=CH2-CH3
4.2. ELIMINAÇÃO INTRAMOLECULAR DE
ÁLCOOIS.
PRODUZ
ALCENOS.
ÁCIDO
SULFÚRICO COMO CATALISADOR E 170O C.
EXEMPLO: ETANOL PRODUZ ETENO
H OH
H2C – CH2
HOH + H2C=CH2
4.3.ELIMINAÇÃO
INTERMOLECULAR
DE
ÁLCOOIS. PRODUZ ÉTERES. PRESENÇA DE
ÁCIDO SULFÚRICO E 140O C .
H3C-CH2-OH + HO-CH2-CH3
HOH + H3C-CH2-O-CH2-CH3
4.4.ELIMINAÇÃO INTERMOLECULAR DE ÁCIDOS
CARBOXÍLICOS. PRODUZ ANIDRIDOS. OCORRE NA
PRESENÇA DE AGENTES DESIDRATANTES COMO
ÁCIDO SULFÚRICO, PENTÓXIDO DE DIFÓSFORO OU
ÁCIDO FOSFÓRICO.
O
H3C-C
O
C-CH3
HOH
+
OH HO
O
+ H3C-C - O -
O
C-CH3
5.
PRINCIPAIS
ESPECÍFICAS.
REAÇÕES
ORGÂNICAS
5.1. COMBUSTÃO: EXEMPLO COMBUSTÃO DO
PROPANO:
COMBUSTÃO TOTAL
CH3-CH2-CH3 + 5O2
3CO2 +4H2O
COMBUSTÃO PARCIAL
CH3-CH2-CH3 + 7/2 O2
3CO +4 H2O
COM FORMAÇÃO DE FULIGEM
CH3-CH2-CH3 + 2 O2
3C +4 H2O
5.2.SALIFICAÇÃO. É A REAÇÃO ENTRE UM
ÁCIDO CARBOXÍLICO E UMA BASE DE
ARRHENIUS. EXEMPLO: ÁCIDO PALMÍTICO E
HIDRÓXIDO DE SÓDIO PRODUZ PALMITATO DE
SÓDIO (SABÃO) E ÁGUA.
C15H31COOH + NaOH
+H2O
C15H31COONa
5.3.ESTERIFICAÇÃO - REAÇÃO DE FISCHER .
ÁCIDO + ÁLCOOL PRODUZ ÉSTER + ÁGUA
(EQUILÍBRIO).
EXEMPLO:
H3C-COOH + HOCH2CH3
HOH +
O
+
H3C-C-O-CH2-CH3
5.6.OXIDAÇÃO E REDUÇÃO. OXIDAÇÃO AÇÃO DO [O]. REDUÇÃO - AÇÃO DO [H].
5.6.1. OZONÓLISE DE ALCENOS - SE AMBOS
OS CARBONOS DA DUPLA SÃO PRIMÁRIOS
OU SECUNDÁRIOS PRODUZ ALDEÍDOS.
H2C=CH-CH3 + O3 + H2O
H-C=O + O=C-CH3 + H2O2
H
H
6.2.SE AMBOS OS CARBONOS QUE FAZEM
PARTE DA DUPLA SÃO TERCIÁRIOS PRODUZ
CETONAS.
H3C - C = C - CH2 - CH3 + O3 + H2O
CH3 CH3
H3C - C = O + O = C - CH2 - CH3 + H2O2
CH3
CH3
6.3.SE UM DOS CARBONOS QUE FAZ PARTE DA
DUPLA
LIGAÇÃO
É
PRIMÁRIO
OU
SECUNDÁRIO E O OUTRO É TERCIÁRIO.
H3C-C = CH-CH3 + O3 + H2O
CH3
H3C-C = O + O= CH-CH3 + H2O2
CH3
7.OXIDAÇÃO
BRANDA
OCORRE
COM
PERMANGANATO DE POTÁSSIO EM MEIO
BÁSICO. NA OXIDAÇÃO BRANDA, APENAS A
LIGAÇÃO PI É ROMPIDA SENDO SUBSTITUÍDA
POR LIGAÇÕES SIGMAS FEITAS COM GRUPOS OH.
7.1. ALCENO PRODUZ DIOL VICINAL.
KMnO4
H2C – CH2
H2C = CH2 +2[O]
H2O/OH-
OH OH
7.2.ETINO PRODUZ ETANODIAL KMnO4/BÁSICO
H-C = C-H + 4[O]
O=C–C=O +
H H
+ H2O2
7.3. ALCINO COM TRIPLA ENTRE CARBONOS
SECUNDÁRIOS PRODUZ DICETONA (DIONA).
KMnO4/BÁSICO
H3C-C=C-CH3 + 4[O]
O
O
H3C – C – C - CH3
+ 2 H2O.
7.4. ALCINO COM TRIPLA ENTRE CARBONOS
PRIMÁRIO E SECUNDÁRIO PRODUZ ALDEÍDOCETONA (FUNÇÃO MISTA).
KMnO4/BÁSICO
H3C-C=CH + 4[O]
O
H3C-C-C=O + 2H2O
H
Básico
Branda
8. OXIDAÇÃO ENÉRGICA - OCORRE COM
PERMANGANATO DE POTÁSSIO EM MEIO ÁCIDO
HÁ RUPTURA DA CADEIA.
8.1. DUPLA EM CARBONO PRIMÁRIO. PRODUZ
ÁCIDO CARBÔNICO QUE SE DECOMPÕE EM
ÁGUA E GÁS CARBÔNICO.
H-C = C-H + 6 [O]
2H2O
Enérgica
Ácido
2H2CO3
2CO2 +
8.2.
DUPLA EM CARBONO SECUNDÁRIO
PRODUZ ÁCIDO CARBOXÍLICO.
KMnO4/H+
H3C-C=C-CH3 + 4[O]
2 H3C-COOH
8.3. DUPLA EM CARBONO TERCIÀRIO PRODUZ
CETONA.
KMnO4/H+
H3C - C = C - CH3 + 2[O]
CH3 CH3
2H3C - C = O
CH3
9. OXIDAÇÃO DE ÁLCOOIS. O DICROMATO
DE POTÁSSIO EM MEIO ÁCIDO É MUITO
USADO NA OXIDAÇÃO BRANDA DE ÁLCOOIS.
9.1. METANOL - OXIDAÇÃO PARCIAL PRODUZ
METANAL E ÁCIDO METANÓICO. A TOTAL
PRODUZ GÁS CARBÔNICO E ÁGUA.
H3C-OH + 3[O]
H2O + HC=O +[O]
H
H-COOH
H2O + CO 2
OXIDAÇÃO DE ÁLCOOIS: K2Cr2O7/H+
9.2. ÁLCOOL PRIMÁRIO. PARCIAL PRODUZ
ALDEÍDO E TOTAL ÁCIDO CARBOXÍLICO.
K2Cr2O7/H+
H3C-CH2OH + [O]
H2O + H3C-C=O
H
K2Cr2O7/H+
H3C-C=O + [O]
H
H3C-COOH
9.3.
ÁLCOOL SECUNDÁRIO. A OXIDAÇÃO
TOTAL PRODUZ CETONA.
OH
K2Cr2O7/H+ O
H3C–C–CH3 + [O]
H3C–C–CH3 + H2O
9.4. O ÁLCOOL TERCIÁRIO NÃO OXIDA
OH
H3C–C–CH3 + [O]
CH3
NÃO REAGE
10.REDUÇÃO DE ÁCIDOS, ALDEÍDOS E
CETONAS. OCORRE COM ZINCO EM PRESENÇA
DE ÁCIDO CLORÍDRICO.
10.1. ALDEÍDO. REDUÇÃO TOTAL PRODUZ
ÁLCOOL PRIMÁRIO
H3C-C=O
H
+ 2[H]
H3C-CH2-OH
10.2.
ÁCIDO
CARBOXÍLICO.
REDUÇÃO
PARCIAL PRODUZ ALDEÍDO E TOTAL ÁLCOOL
PRIMÁRIO.
H3C-C=O + 2[H]
OH
H2O + H3C-C=O +2[H]
H
H3C-CH2-OH
ÁLCOOL
PRIMÁRIO
OXIDAÇÃO
REDUÇÃO
ALDEÍDO
OXIDAÇÃO
ÁCIDO
REDUÇÃO
CARBOXÍLICO
10.3. CETONA. REDUÇÃO TOTAL PRODUZ
ÁLCOOL SECUNDÁRIO.
O
H3C-C-CH3
OH
+ 2[H]
H3C-C-CH3
ÁLCOOL
SECUNDÁRIO
OXIDAÇÃO
REDUÇÃO
CETONA