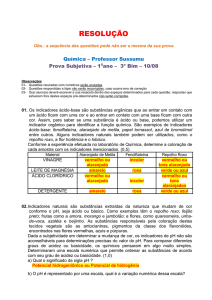
AULA 8
QUÍMICA- TONI - ATITUDE
www.sosprofessor.xpg.com.br
BASES
CLASSIFICAÇÃO DAS BASES
FÓRMULAS DAS BASES
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 1
Obs: Os elementos das colunas 1A (exceto o hidrogênio), 2A e 3ª (exceto o boro) e 4ª (exceto o carbono
e o silício) formam bases seguindo a formula.
INSTABILIDADE DAS BASES FRENTE AO CALOR
Quase todas as bases sofrem decomposição quando aquecida:
Os hidróxidos dos metais que estão no fim da “fila de reatividade” (metais nobres) são tão
instáveis que se decompõem ate em temperatura ambiente
Pode os notar que, ao sofrer decomposição, os hidróxidos produzem um oxido metálico que é,
por isso, um oxido básico. Faz exceção o hidróxido de amônio.
Os únicos hidróxidos que resistem bem ao aquecimento (podendo, inclusive, ser fundido) são os
hidróxidos alcalinos.
CONDUTIVIDADE ELÉTRICA
Os hidróxidos dos metais alcalinos são compostos iônicos. Assim quando falamos em hidróxido
de sódio, no estado solido, devemos pensar num aglomerado de íons de Na + e OH-. A fusão ou a
dissociação desse hidróxido em água apenas dá mobilidade aos íons (dissociação iônica).
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 2
Por isso o hidróxido de sódio (e os demais metais alcalinos) conduzem a corrente elétrica, que
em solução aquosa que fundida.
Os hidróxidos dos metais alcalino-terrosos são também compostos iônicos. O hidróxido de
cálcio, por exemplo, é um sólido formado pelo aglomerado de íons Ca2+ e OH-.
Ca2+ e OH-
Ca(OH)2
Representação simbólica
Representação real
A conduçao de corrente elétrica por esses hidróxidos é todavia dificultada pois:
- em solução aquosa- ele são poucos solúveis e a condutividade elétrica relativamente pequena.
- por aquecimento- esses hidróxidos se decompõem antes de fundir. Portanto não se pode falar em em
condutividade no “estado fundido”.
Com os demais hidróxidos as coisas se complicam ainda mais porque:
- são praticamente insolúveis na água
- quando aquecidos, sofrem decomposição, antes de fundir
Por fim, cumpre-nos assinalar que, a medida que avançamos na “fila de reatividade” dos metais,
seus hidróxidos vão perdendo o “caráter iônico” e adquirindo a condição de “oxido hidratado”. Assim por
exemplo, o hidróxido ferroso - Fe(OH)2 – equivale mais a FeO.H2O do que a um aglomerado de íons
Fe2+ + OH-.
Obs: como já acontece com os poliácidos, todos os hidróxidos que possuam duas ou mais hidroxilas,
vai sofrer dissociação iônica em etapas:
1a etapa:
______2a etapa:
Ca(OH)2
Ca(OH) +
Dissociação total Ca(OH)2
QUÍMICA
Ca+ e OHCa2+ e OH-______
Ca2+ e OH-
WWW.SOSPROFESSOR.XPG.COM.BR
Página 3
AULA 9
QUÍMICA- TONI - ATITUDE
www.sosprofessor.xpg.com.br
NOMECLATURA DE ÁCIDOS E BASES
NOMECLATURA DOS ÁCIDOS
Lembrando que negativos dos ácidos são quase sempre formados pelos elementos químicos
situados do lado direito e na parte superior da tabela periódica (exceto os gases nobres).
F
Flúor
Cl
Cloro
Br
Bromo
I
Iôdo
At
Astato
O cloro que é considerado o elemento mais importante desse grupo forma os seguintes ácidos:
ácido clorídrico
HCl
(hidrácido)
ácido hipocloroso
HClO
(oxiácido)
ácido cloroso
HClO2
(oxiácido)
ácido clórico
HClO3
(oxiácido)
ácido perclórico
HClO4
(oxiácido)
Notem que a medida que o numero de oxigênio varia, o nome do ácido também varia
acrescentando se (no caso do cloro) a terminação ídrico, oso, ico. Assim como também os
prefixos hipo (com menos oxigênio) e per (com mais oxigênio).
QUANDO O ELEMENTO FORMA TRÊS OU QUATRO OXIÁCIDOS
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 4
Para praticar
1) Dê o nome dos ácidos a seguir:
a) HBr
b) HBrO
c) HBrO2
d) HBrO3
e) HBrO4
2) Por analogia quais as formulas e nomes possíveis dos ácidos do elemento iôdo ?
OBS:
Orto: é o ácido mais hidratado
Piro: é o tem hidratação média
Meta: é o ácido menos hidratado
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 5
Para praticar
1) Por analogia aos ácidos dos fósforo dê o nome dos seguintes ácidos:
a) H4As2O7
b) H3AsO3
c) H3AsO4
2) Qual é a formula do ácido pirosslfúrico ?
3) Sabendo-se que o ácido ortossilícico é H4SiO4 escreva as formulas dos ácidos metassilícico e
pirossilícico.
QUANDO O ELEMENTO FORMA DOIS OXIÁCIDOS
Para praticar
1) Os elementos enxofre, selênio e telúrio pertencem a mesma família dos calcolgênios. Por
analogia aos ácidos do enxofre, quais as formulas e nomes dos ácidos do selênio ?
2) Idem para o telúrio:
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 6
QUANDO O ELEMENTO FORMA UM OXIÁCIDO
Usa-se a terminação iço.
Para praticar
1) Usando a tabela de radicais negativos, dê o nomes ou formula dos seguintes
ácidos:
a) HCN
b) HMnO4
c) H2CO3
d) H4SiO4
e) H2S2O3
f) H2Cr2O7
g) H3 Fe (CN)6
h) H2SnO3
i) H3BO3
j) Ácido crômico
k) Ácido ferrocianídrico
l) Ácido estanoso
m) Ácido mangânico
n) Ácido piroantimônico
o) Ácido dicrômico (ou pirocrômico)
NOMECLATURA DAS BASES
QUANDO O ELEMENTO FORMA APENAS UMA BASE
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 7
QUANDO O ELEMENTO FORMA DUAS BASES
Para praticar
1) Usando a tabela de radicais positivos, dê o nomes ou formula das seguintes
bases:
a) Zn(OH)2
b) AuOH
c) Cr(OH)3
d) AgOH
e) Sn(OH)4
f) Cd(OH)2
g) Hidróxido de alumínio
h) Hidróxido cúprico
i)
Estanoso
j) Hidróxido áurico
k) Hidróxido de amônio
l) Hidróxido platínico
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 8
MEDIDA DO CARÁTER ÁCIDO E BÁSICO
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 9
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 10
ÁCIDOS E BASES IMPORTANTES
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 11
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 12
BASES IMPORTANTES
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 13
INDICADORES ÁCIDO-BASE
COMPARAÇÃO ENTRE ÁCIDO E BASE
QUÍMICA
WWW.SOSPROFESSOR.XPG.COM.BR
Página 14