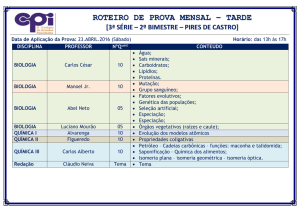
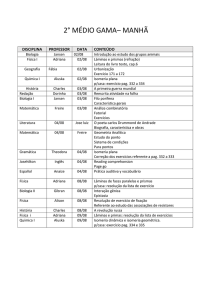
UNIVERSIDADE FEDERAL DE OURO PRETO
PRÉ-VESTIBULAR RUMO À UNIVERSIDADE
CAMPUS JOÃO MONLEVADE
QUÍMICA ORGÂNICA
ORIENTADORA: PROF.ª DRA. KARLA VIEIRA
PROF.ª LUCAS SIQUEIRA
ISOMERIA – INTRODUÇÃO (I)
• Quando se substitui um átomo de hidrogênio do
etano por um cloro, obtém-se uma única substância,
pois qualquer que seja o hidrogênio substituído, a
estrutura obtida será sempre a mesma:
ISOMERIA – INTRODUÇÃO (II)
• Mas, quando se substituem dois átomos de
hidrogênio por dois átomos de cloro, obtém-se
duas substâncias diferentes, pois podem ocorrer
duas possibilidades:
• Os dois hidrogênios substituídos estão ligados ao mesmo
carbono;
• Os dois hidrogênios substituídos estão ligados a carbonos
diferentes;
ISOMERIA – INTRODUÇÃO (III)
• Os dois compostos diferentes possuem os mesmos
átomos, na mesma quantidade, mas apresentam
estruturas diferentes. Esse é um exemplo do
fenômeno chamado isomeria.
ISOMERIA – INTRODUÇÃO (II)
• Isomeria é o fenômeno caracterizado pela
existência de duas ou mais substâncias diferentes,
que apresentam a mesma fórmula molecular,
porém diferentes fórmulas estruturais.
• Em algumas das vezes, o fenômeno da isomeria
pode ser percebido por meio da análise da
fórmula estrutural plana. Mas existem situações em
que a isomeria só é perceptível por meio da análise
da fórmula estrutural espacial.
• O estudo será dividido em Isomeria Plana e
Isomeria Espacial (estereoisomeria).
ISOMERIA - ESTUDO
• Isomeria Plana (análise da fórmula estrutural plana):
•
•
•
•
•
De função;
De cadeia (núcleo);
De posição;
De compensação (metameria);
Dinâmica (tautomeria);
• Isomeria Espacial ou estereoisomeria (análise da
fórmula estrutural espacial):
• Geométrica;
• Óptica.
ISOMERIA PLANA DE FUNÇÃO (I)
• Ocorre quando os isômeros pertencem a funções
diferentes;
ISOMERIA PLANA DE FUNÇÃO (II)
ISOMERIA PLANA DE CADEIA OU DE
NÚCLEO
• Na isomeria de cadeia ou de núcleo, os isômeros
pertencem à mesma função, mas apresentam
diferentes tipos de cadeia.
ISOMERIA PLANA DE POSIÇÃO (I)
• Na isomeria de posição, os isômeros pertencem a
mesma função e têm o mesmo tipo de cadeia,
mas apresentam diferença na posição de um
grupo funcional, de uma ramificação ou de uma
insaturação.
ISOMERIA PLANA DE POSIÇÃO (II)
ISOMERIA PLANA DE COMPENSAÇÃO
OU METAMERIA (I)
• Na isomeria de compensação ou metameria
(meta=“mudança” + meros=“partes”), os isômeros
pertencem à mesma função e tem o mesmo tipo
de cadeia, mas apresentam diferença na posição
de um heteroátomo. A metameria pode ser
considerada um caso particular da isomeria de
posição.
ISOMERIA PLANA DE COMPENSAÇÃO
OU METAMERIA (II)
ISOMERIA DINÂMICA (I)
• Na isomeria dinâmica ou tautomeria, os isômeros
coexistem em equilíbrio dinâmico em solução.
• Pode ser considerada um caso particular da
isomeria de função.
• Os principais casos de tautomeria envolvem
compostos carbonílicos.
• Ao preparar uma solução de aldeído acético, uma
pequena parte se transforma em etenol, o qual,
por sua vez, regenera o aldeído, estabelecendo
um equilíbrio.
ISOMERIA DINÂMICA (II)
• Esse equilíbrio é denominado aldoenólico e pode
ser representado por:
• Esse equilíbrio é característico de enóis que
apresentam a hidroxila (OH) em carbono primário.
ISOMERIA DINÂMICA (III)
• Em enóis com hidroxila em carbono secundário,
ocorre um equilíbrio denominado cetoenólico, ou
seja, entre uma cetona e um enol.
• A solução que contém dois tautômeros é
denominada alelotrópica, e ambos os equilíbrios
são genericamente denominados cetoenólicos.
QUESTÕES
QUESTÕES
QUESTÕES
ISOMERIA GEOMÉTRICA (I)
• Quando dois hidrogênios, um de cada carbono do
etileno, são substituídos por dois átomos de cloro,
formam-se duas estruturas diferentes com a mesma
fórmula molecular: C2H2Cl2.
ISOMERIA GEOMÉTRICA (II)
Os
compostos
C2H2Cl2,
representados pelas estruturas 2
e 3, são isômeros geométricos.
Observe que:
• Na estrutura 2, os dois átomos
de Cl2 e os dois átomos de H
estão no mesmo lado do plano
imaginário.
O
isômero
geométrico com essa estrutura
é denominado cis.
• Na estrutura 3, os dois átomos
de Cl2 e os dois átomos de H
estão em lados opostos do
plano imaginário. O isômero
geométrico com essa estrutura
é denominado trans.
ISOMERIA GEOMÉTRICA (III)
• Dessa maneira, o composto C2H2Cl2 com a
estrutura 2 é chamado cis-1,2-dicloroeteno;
• Já o composto C2H2Cl2 com a estrutura 3 é
chamado trans-1,2-dicloroeteno. As fórmulas
estruturais desses dois isômeros geométricos podem
ser assim representadas:
OCORRÊNCIA DE ISÔMEROS
GEOMÉTRICOS (I)
• Os compostos acícilicos devem apresentar pelo
menos uma ligação dupla entre carbonos, e cada
um dos carbonos da dupla deve apresentar grupos
ligantes diferentes.
EXEMPLO DE ISÔMERO CIS-TRANS (I)
• O composto pent-2-eno satisfaz as condições anteriores
e, portanto, apresenta isômeros geométricos ou cistrans.
• Observe que, no composto cis, os dois H ligado ao C
estão no mesmo lado no plano imaginário. No
composto trans, estão em lados opostos desse plano.
ISÔMEROS CIS-TRANS
• Considerando o 2-metilbut-2-eno. Ele satisfaz as
condições necessárias para ocorrer a isomeria
geométrica?
ISÔMEROS GEOMÉTRICOS
• Considerando o 2-bromo-1-cloropropeno.
• Por quê esses compostos não
diferenciados usando cis-trans?
• Como podem ser então nomeados?
podem
ser
ISÔMEROS Z-E (I)
• Nesse caso, são diferenciados usando o prefixo Z-E;
• O isômero Z é aquele que apresenta dois ligantes
de cada C da ligação dupla com os maiores
números atômicos no mesmo lado plano; O que
apresenta os maiores em lado oposto, será o
isômero E.
• No exemplo dado, temos:
ISÔMEROS Z-E (II)
• Observe que, no isômero Z, os ligantes de maior
número atômico (Cl e Br) estão no mesmo lado do
plano imaginário; No E, estão em lados opostos.
Latim
Cis = “próximo à”
Trans= “atráves de”
Alemão
Zusammen (Z) = “juntos”
Entgegen= “opostos”
• Não confunda Z, número atômico, com Z, nome de
isômero geométrico.
OCORRÊNCIA DE ISÔMEROS
GEOMÉTRICOS (II)
• Os compostos cíclicos devem apresentar grupos
ligantes diferentes em pelo menos dois carbonos
do ciclo.
EXEMPLO DE ISÔMERO CIS-TRANS (II)
QUESTÕES
QUESTÕES
QUESTÕES
DÚVIDAS?
PROF.ª LUCAS SIQUEIRA
OBRIGADO PELA ATENÇÃO!
PROF.ª LUCAS SIQUEIRA