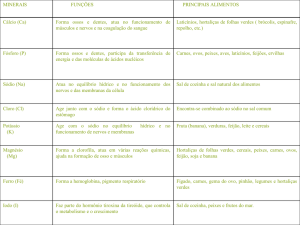
--------------------------
o
(U. F. Pelotas-RS, adaptada) Antiácidos são medicamentos
capazes de neutralizar a acidez estomacal. Eles são constituídos, pelo menos, por uma substância básica (ou de reação básica), como, por exemplo, A/(OH)3' Mg(OH)2' NaHC03
e Na2C03. Os antiácidos que apresentam carbonatos em
suas composições também contêm um ácido fraco, cuja
função é fornecer íons W que propiciam a decomposição
do carbonato, quando na dissolução do medicamento em
água, a qual libera gás carbônico (efervescência), conforme
as equações:
I. Na HC03IS+
) W ~
o
11. Na2C03IS+) 2W ~
2Nat,Q) + HPIC) + C021g)
Entre os ácidos fracos encontrados na decomposição de
antiácidos podem ser citados o ácido cítrico e o ácido
aceltilsalicílico, cujas fórmulas estruturais planas são:
As substâncias citadas no texto são:
Fostato de cálcio - Ca,(PO),
Bicarbonato de sódio (carbonato ácido de sódio ou hidrogeno-carbonato
de sódio) - NaHC01
Ácido clorídrico - HCI
Di-hidrogenopirotostato
de sódio - Na,Hl,O,
Tiossulfato de sódio - Na2S,O
Alternativa c
Ácido ecetllsallcillco
OH
I
O=C-CH
I
2
OH
-c=o
-C-CH
I
c=o
I
2
a fosfato de cálcio é um importante componente dos ossos
e dentes do corpo, encontra-se na forma de minerais. a bicarbonato de sódio é um antiácido estomacal, neutraliza o excesso de
ácido clorídrico no suco gástrico. a di-hidrogenopirofosfato
de sódio é misturado com amido e aromatizante no preparo de
pudins instantâneos. O tiossulfato de sódio é usado para remover o gosto desagradável da água potávél fortemente dorada.
Indique a alternativa que contém as fórmulas corretas das
substâncias citadas no texto.
a) Ca3(P04)2- Na2C03- Nal207 - Na2S203
b) Ca(P04) - NaHC03 - Nal207 - Na2S20,
c) Ca3(P04)2 - NaHC03 - Na2HlP7 - Na2Sp3
d) Ca3(P04)2- NaHC03 - Na2Hl207 - Na2S,04
e) Ca3(P04)2- NaHC03 - Nal207 - Na2S204
Nat,q) + HPlf) + C021g1
Ácido dtrico
(UTPR) Leia o texto a seguir.
I
OH
OH
Sobre o texto apresentado, analise as afirmações a seguir.
I.
NaHC03 é um hidrogeno-sal ou sal monoácido cuja
dissolução em água na presença de ácido cítrico manterá seu cátion Na+ na forma de citrato.
11.
magnésio, cátion do composto de fórmula Mg(OH)2'
é um metal alcalino localizado no segundo período
da tabela periódica e no seu segundo grupo.
111.
sódio (cátion em dois dos exemplos citados no texto), quando na forma atõmica, apresenta seu elétron
diferenciador (elétron da camada mais externa, último a ser distribuído) no subníveI3s'.
IV. Entre o oxigênio e o hidrogênio do ânion OH- dos
hidróxidos citados no texto, a ligação estabelecida é
predominantemente
iônica.
A respeito das informações apresentadas sobre os componentes dos antiácidos:
a) apenas uma está correta.
b) apenas duas estão corretas.
c) apenas três estão corretas.
d) apenas quatro estão corretas.
e) todas estão erradas.
°
°
°
11. (F) o Mg está no 3' período da tabela e é um metal alcalinoterroso.
IV. (F) A ligação é covalente.
Alternativa b
o
(PUC-PR) Muitos produtos químicos estão presentes no
nosso cotidiano, como o leite de magnésia, o vinagre, o
calcá rio, a soda cáustica, entre outros. Essas substâncias
citadas pertencem, respectivamente, às seguintes funções
químicas:
a) ácido, base, base e sal.
b) sal, ácido, sal e base.
c) ácido, base, sal e base.
d) base, sal, ácido e base.
e) base, ácido, sal e base.
Leite de magnésia
->
hidróxido
de magnésio: Mg (OH),
Vinagre --> solução aquosa de ácido etanoico (acético):
H,C -
/
C
o
-->
ácido
"'OH
Calcário --> carbonato de cálcio: CaCO, --> sal
Soda cáustica --> hidróxido
Alternativa e
de sódio: NaOH --> base
->
base
..
:::J"
o
Indique qual substância pode ser representada por W na
reação 1 e qual pode ser considerada responsável pela
causa das mortes na reação 2.
a) HClO) e Ba(HCO))2
b) HCI e Ba(HCO)2
c) HCI e BaS04
d) HCI e BaCO)
e) HCN e BaCO)
(C1/H4) Leia o texto a seguir.
°
"desaparecimento" de uma substância quando misturada a outra é um interessante fenômeno que fascina
cientistas há anos, além de despertar interesses econômicos
e, até mesmo, de saúde pública. Um exemplo que abalou
a sociedade brasileira foi a suspeita de contaminação de
um contraste à base de Ba504, usado em radioscopia e
radiografia para destacar órgãos, que pode ter causado a
morte de pelo menos 21 pessoas. sulfato de bârio é usado para este fim por ser um sal praticamente insolúvel em
água (0,0002 g/100 g de água) e em soluções ácidas diluídas. Análises de amostras deste medicamento, produzido
por um determinado fabricante, constataram a presença
de BaC03. Embora o carbonato de bário apresente também
baixa solubilidade em água (0,002 g/100 g de água), este sal
é solúvel em soluções ácidas diluídas como o suco gástrico,
um fluido digestivo ácido (reação 1). Além disso, BaCO)' em
presença de CO2 e HP, forma bicarbonato de bârio, que é
um sal aquossolúvel (reação 2).
°
o texto afirma que "o carbonato de bário é solúvel em soluções ácidas
diluídas como o suco gástrico". Assim W representa o ácido clorídrico'
(Hc0. A causa das mortes foi a produção de uma substância solúvel que na
reação 2 é representada pelo hidrogeno sal Ba(HCO,)[
Alternativa b
I
o
BaCO)ls)+ 2H~QI --> Ba~'~1 + C021g1
+ H20lel (reação 1)
BaCO)IS)+ C021g1
+ HPlel
->
(C5/H17) A Comissão Nacional da Verdade frequentemente
recorre à exumação de ossadas para resgatar a memória dos
tempos da ditadura militar brasileira. Essasossadas resistem
ao tempo por causa da presença de um fosfato muito estável, de fórmula genérica ca,0(p04)6(OH)x' Sabendo que esse
fosfato é proveniente do ácido fosfórico (Hl04), o número
de hidroxilas presentes em sua fórmula genérica é:
a) 1
b) 2
c) 3
d) 4
e) 5
o somatório de cargas em um composto iônico, como o fosfato apresentado, é igual a zero. Assim, sabendo que o cálcio é um metal alcalinoterroso
(carga +2), que o ânion fosfato (pO;,) é trivalente e que o aníon hidroxila
(OH) é monovalente, temos:
((+2),10] + ((3)6] + [(-1) x]
0=>x=2
Alternativa b
Ba(HCO))21'Q)(reação 2)
Como todos os compostos de bârio solúveis em água
ou ácidos são venenosos, o BaC03 apresenta efeito deletério
à saúde humana. Esse caso ilustra bem a importância do
conhecimento da solubilidade, pois o engano com relação
ao meio reacional pode ter sido o motivo que levou várias
pessoas à morte.
=
Adaptado de SILVA, L.A.; MARTINS, C.R.; ANDRADE, J.B.;
Por que todos os nitratos são solúveis?Disponível em
http://qnint.sbq.org.br
(acesso em 23 maio 2014)
EXERCíCIOS COMPLEMENTIIRES
~
(UFSC, adaptada)A irradiação é uma técnica u!ilizada na
conservação de alimentos para inibir a germmacao, retardar
amadurecimento e destruir bactérias patogênicas. Os isótopos
césio-137 e cobalto-60 são muito utilizados na obtenção de
alimentos irradiados, que não contêm resíduos radiativos e,
portanto, não prejudicam a saúde.
Analise as afirmativas e dê a soma dos números dos itens
corretos.
(01) Césio e cobalto são elementos de transição.
(02)
número atômico de césio-137 é 55.
(04) césio forma hidróxidos do tipo M(OH)2'
(08) Os elétrons do cobalto estão distribuídos em quatro
níveis principais de energia.
(16) átomo do cobalto-60 tem 27 nêutrons no núcleo.
(32)
elemento césio está localizado no sexto período e
no grupo 1 da classificação periódica dos elementos.
°
°
Distribuição esquemática de íons de um sal dissolvido
em água.
composto que representa melhor a solução esquematizada na figura é:
a) MgCl2
b) KCI
c) K2S04
°
°
°
@ (Vunesp) Soluções são misturas
homogêneas de duas ou
mais substâncias. A água é um solvente muito eficaz para
solubilizar compostos iônicos. Quando um composto iônico
se dissolve em água, a solução resultante é composta de
íons dispersos pela solução.
~
(Unifra-RS, adaptada) Dadas as substâncias:
NaU sal de cozinha
NHp: sal amoníaco (usado como fermento em bolachas)
NaN03: salitre do chile (usado como conservante de produtos cárneos - cancerígeno)
r=>;
-----------------------------------------
NaOH: soda cáustica (usada na fabricação de sabões)
A/,(S04)3: sulfato de alumínio (usado na purificação de
água das cidades)
NaHC03: bicarbonato de sódio (constituinte do fermento
químico, antiácido estomacal)
H,S04: ácido sulfúrico (constituinte da solução das baterias
d e carros - tóxi co)
H3C- COOH: ácido acético (constituinte essencial do vinagre)
Considerando-se os compostos dados, qual das propostas
a segu ir é correta?
a)
NaC! e o NaOH, quando em solução aquosa, comportam-se como bases' de Arrhenius.
b) O NaC!, por suas propriedades químicas, pode ser usado
como antiãcido estomacal.
c)
composto H3C - COOH, por ser um composto orgânico e molecular, quando em solução aquosa, não sofre
ionização.
d)
salitre do chile é muito usado também na fabricação
de pólvora.
°
°
°
~
(UFRj) Durante um experimento, seu professor de química
pediu que você identificasse as soluções aquosas presentes
em cada um dos béqueres (A, B, C) apresentados a seguir.
@ (UPE)
A queima de etanol em duas latas bem limpas, I e 11,
contendo um pouco de uma solução salina nas suas bordas
superiores, uma solução diferente para cada lata, forneceu
colorações distintas às chamas produzidas.
grupo de
teatro experimental que realizou essa atividade apresentou um slide, contendo as seguintes informações sobre o
procedimento adotado:
As duas soluções utilizadas foram preparadas com base
nos reagentes disponíveis numa maleta que armazenava:
Ba(N03)" CuS04,CaC!2' KNOJ, LiC!, NaC!, PbS04 e Sr(NOJ)r
Não havia íons de metais de transição nas soluções
uti Iizadas.
,
As duas soluções eram concentradas e constituídas de
sais bastante solúveis em água.
Os cátions presentes em cada uma das soluções utilizadas eram de elementos de diferentes grupos da tabela
periódica.
Oscátions presentes em cada uma das soluções utilizadas
possuíam os menores raios iônicos quando comparados
aos demais cátions dentro dos seus respectivos grupos.
°
Coloração típica de chamas por causa da presença de
alguns cátions em estado excitado
ElementQ
V
Bário
Verde-amarelada
Cálcio
Alaranjada
Chumbo
Azul
Cobre
Verde
Estrôncio
A
B
C
Dois béqueres do experimento contêm soluções aquosas
salinas, de sais desconhecidos.
a) O ânion do sal presente na solução salina saturada
pertence à família dos halogênios e é isoeletrônico
ao sulfeto. Escreva o nome do ânion e identifique o
béquer que contém essa solução.
b) Sabe-se que o sal da solução não saturada é um nitrato
cujo cátion pertence ao 3º período da família dos metais
alcalinoterrosos. Escreva a fórmula QUímica desse sal.
(Observação: Consultar a tabela periódica.)
Vermelho-tijolo
Lítio
Carmim
Sódio
Amarela
Potássio
Violeta
(Dado: Ba (Z 56): [Xe]6s2; Ca (Z 20): [Ar]4s2; Cu (Z 29): [Ar]
4s' 3d'°; K (Z 19): [Ar]4s'; Li (Z 3): 1$22s'; Na (Z 11): [Ne]3s';
Pb (Z 82): [Xe]4f'4 5d1O 6s2 6p2; Sr (Z 38): [Kr] 5s2)
Quais as tonalidades observadas nas chamas das latas I e li?
a) Azul e verde.
b) Amarela e verde.
c) Carmim e alaranjada.
d) Vermelho-tijolo e azul.
e) Violeta e verde-amarelada.
.-:3
~§
=
QI