MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
MINISTÉRIO DA SAÚDE
SECRETARIA DE ASSISTÊNCIA À SAÚDE
PORTARIA N° 865, DE 5 DE NOVEMBRO DE 2002
DO 217, de 8/11/02
O Secretário de Assistência à Saúde, no uso de suas atribuições legais,
Considerando a necessidade de estabelecer Protocolo Clínico e Diretrizes
Terapêuticas para o tratamento da Artrite Reumatóide, que contenha critérios de
diagnóstico e tratamento, observando ética e tecnicamente a prescrição médica, racionalize
a dispensação dos medicamentos preconizados para o tratamento da doença, regulamente
suas indicações e seus esquemas terapêuticos e estabeleça mecanismos de acompanhamento
de uso e de avaliação de resultados, garantindo assim a prescrição segura e eficaz;
Considerando a Consulta Pública a que foi submetido o Protocolo Clínico e
Diretrizes Terapêuticas - Artrite Reumatóide, por meio da Consulta Pública GM/MS nº 01,
de 23 de julho de 2002 - Anexo III, que promoveu sua ampla discussão e possibilitou a
participação efetiva da comunidade técnico científica, sociedades médicas, profissionais de
saúde e gestores do Sistema Único de Saúde na sua formulação, e
Considerando as sugestões apresentadas ao Departamento de Sistemas e
Redes Assistenciais no processo de Consulta Pública acima referido, resolve:
Art. 1º - Aprovar o PROTOCOLO CLÍNICO E DIRETRIZES
TERAPÊUTICAS -ARTRITE REUMATÓIDE - Antiinflamatórios não-esteroidais,
Prednisona, Hidroxicloroquina, Cloroquina, Sulfassalazina, Metotrexate, Azatioprina,
Leflunomide, Ciclosporina, Infliximab, na forma do Anexo desta Portaria.
§ 1º - Este Protocolo, que contém o conceito geral da doença, os critérios de
inclusão/exclusão de pacientes no tratamento, critérios de diagnóstico, esquema terapêutico
preconizado e mecanismos de acompanhamento e avaliação deste tratamento, é de caráter
nacional, devendo ser utilizado pelas Secretarias de Saúde dos estados, do Distrito Federal
e dos municípios, na regulação da dispensação dos medicamentos nele previstos.
§ 2º - As Sec’retarias de Saúde que já tenham definido Protocolo próprio
com a mesma finalidade, deverão adequá-lo de forma a observar a totalidade dos critérios
técnicos estabelecidos no Protocolo aprovado pela presente Portaria;
§ 3º - É obrigatória a observância deste Protocolo para fins de dispensação
dos medicamentos nele previstos;
§ 4º - É obrigatória a cientificação do paciente, ou de seu responsável legal,
dos potenciais riscos e efeitos colaterais relacionados ao uso dos medicamentos
preconizados para o tratamento da Artrite Reumatóide, o que deverá ser formalizado
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
através da assinatura do respectivo Termo de Consentimento Informado, conforme o
modelo integrante do Protocolo.
Art. 2º - Esta Portaria entra em vigor na data de sua publicação, revogadas as
disposições em contrário.
RENILSON REHEM DE SOUZA
ANEXO
PROTOCOLO CLÍNICO E DIRETRIZES TERAPÊUTICAS
ARTRITE REUMATÓIDE
Medicamentos:Antiinflamatórios
não-esteroidais,
Prednisona,
Hidroxicloroquina, Cloroquina, Sulfassalazina, Metotrexate, Azatioprina, Leflunomide,
Ciclosporina, Infliximab
1. Introdução
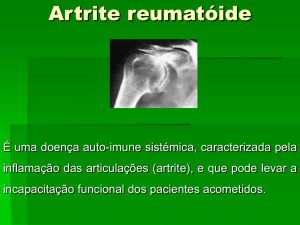
Artrite reumatóide é uma desordem auto-imune, de etiologia desconhecida,
caracterizada por poliartrite periférica, simétrica, que leva a deformidade e destruição das
articulações devido à erosão da cartilagem e osso (1). Quando apresenta envolvimento
multissistêmico a morbidade e a gravidade da doença são maiores. A maioria dos pacientes
apresenta um curso clínico flutuante, com períodos de melhora e exacerbação dos sintomas
articulares. A prevalência estimada é de 1% (1,2), com incidência de 36/100.000 em
mulheres e de 14/100.000 em homens (3).
A atividade da doença leva em consideração 4 fatores básicos (4):
▪ avaliação dos sintomas e estado funcional: graduação da dor articular,
rigidez matinal e severidade da fadiga;
▪ avaliação do envolvimento articular e manifestações extra-articulares: as
articulações devem ser avaliadas quanto ao edema, dolorimento, perda de movimento e
deformidade. Manifestações extra-articulares, incluindo manifestações sistêmicas como
febre, anorexia, náuseas e perda de peso, devem ser investigadas;
▪ marcadores laboratoriais: proteína C reativa e velocidade de
eritrossedimentação (reatores de fase aguda) são marcadores inespecíficos que refletem
grau de inflamação sinovial;
▪ estudos radiológicos: acompanhamento com radiografias após 6-12 meses
de tratamento e sua comparação com as basais podem indicar atividade da doença
(desenvolvimento ou piora de osteopenia e/ou erosões articulares e redução do espaço
articular são indicativos de atividade da doença).
Quanto à severidade da doença, a artrite reumatóide costuma ser dividida
em:
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
▪ leve: paciente apresenta artralgias, pelo menos 3 articulações com sinais de
inflamação, nenhuma doença extra-articular, fator reumatóide costumeiramente negativo,
elevação dos reatores de fase aguda e nenhuma evidência de erosão ou perda de cartilagem
ao estudo radiográfico;
▪ moderada: entre 6 e 20 articulações acometidas, comumente doença restrita
a articulações, elevação de reatores de fase aguda, positividade do fator reumatóide,
evidência de inflamação a radiografia;
▪ grave: mais de 20 articulações persistentemente acometidas, elevação dos
reatores de fase aguda, anemia de doença crônica, hipoalbuminemia, fator reumatóide
positivo, radiografias demonstrando erosões e perda de cartilagem e doença extra-articular.
2. Classificação CID10
▪ M05.- Artrite reumatóide soro-positiva
▪ M06.- Outras artrites reumatóides
3. Diagnóstico
O diagnóstico depende da associação de uma série de sintomas e sinais
característicos, dados laboratoriais e achados radiológicos (1).
3.1. Critérios Clínicos e Laboratoriais
Critérios Diagnósticos de Artrite Reumatóide
3.1.1. Orientação para Classificação:
a) quatro dos sete critérios são necessários para classificar um paciente como
tendo artrite reumatóide;
b) pacientes com dois ou três critérios não são excluídos da possibilidade do
futuro desenvolvimento da doença, não sendo considerados para inclusão neste protocolo.
3.1.2. Critérios *
a) rigidez matinal: rigidez articular e peri-articular durando pelo menos 1
hora antes de máxima melhora;
b) artrite de três ou mais áreas: pelo menos três áreas articulares com edema
de partes moles ou derrame articular;
c) artrite de articulações das mãos (interfalangianas proximais ou
metacarpofalangianas) ou punhos;
d) artrite simétrica: comprometimento simultâneo bilateral;
e) nódulos reumatóides: nódulos subcutâneos sobre proeminências ósseas,
superfície extensora ou região justa-articular;
f) presença de fator reumatóide sérico;
g) alterações radiológicas: erosões localizadas ou osteopenia justa-articular
em radiografias de mãos e punhos.
* Critérios: “a” até “d” devem estar presentes por, pelo menos, 6 semanas. O
médico deve ter observado os critérios “b” até “e”.
3.2. Exames Subsidiários Exigidos
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Radiografia de mãos e punhos e fator reumatóide são necessários caso o
paciente não apresente os quatro critérios clínicos descritos acima. VSG e proteína C
reativa para acompanhamento da resposta terapêutica.
4. Critérios de Inclusão no Protocolo de Tratamento
Para inclusão no Protocolo de Tratamento o paciente deve preencher os
critérios diagnósticos relacionados no item 3 supra.
5. Tratamento
O manejo do paciente vai variar de acordo com o estágio da doença, sua
atividade e severidade, devendo-se ser mais agressivo no tratamento quanto mais agressiva
for a doença (1,2,5). Medidas não farmacológicas são de extrema importância,
principalmente a educação do paciente em relação a sua doença.
Para casos leves o uso de antiinflamatórios não esteróides pode ser feito
inicialmente de forma isolada. É aconselhável, entretanto, o uso de drogas modificadoras
do curso da doença (DMCD) desde o momento do diagnóstico.
Para casos refratários, o uso de corticosteróides em baixa dose
(correspondente a 2,5-10mg de prednisona) pode ser benéfico (6-10).
Em casos avançados terminais, onde o componente álgico é importante, o
uso de analgésicos simples e/ou antidepressivos tricíclicos pode trazer alívio. O uso de
opióides pode se fazer necessário em alguns pacientes (5).
Estudos avaliando o uso de drogas modificadores do curso da doença são
abundantes.
Uma revisão sistemática que avaliou o uso de hidroxicloroquina observou
que ela foi capaz de melhorar, em relação ao placebo, o número de articulações
edemaciadas e sensíveis, o escore de dor, avaliação global pelo paciente e pelo médico e
velocidade de eritrossedimentação (11).
Duas revisões sistemáticas de ensaios clínicos randomizados e um ensaio
clínico subseqüente (12-14) observaram que a sulfassalazina é mais efetiva que o placebo
em reduzir a atividade da doença e a inflamação articular, escore de dor e impressão clínica
global.
Metotrexate foi comparado por placebo em uma metanálise que incluiu 5
ensaios clínicos randomizados e 161 pacientes. Benefício foi demonstrado para edema e
sensibilidade das articulações, escore de dor, avaliação global pelo paciente e pelo médico e
estado funcional (15). Estudos observacionais (16-19) referem ser o metotrexate a mais
bem tolerada das DMCD.
Leflunomide é uma droga relativamente nova que tem demonstrado
benefício no tratamento da artrite reumatóide. Em uma metanálise (20) demonstrou
melhorar a qualidade de vida e reduzir a progressão radiológica em relação ao placebo.
Azatioprina demonstrou seu benefício na diminuição do escore de
articulações edemaciadas em uma análise (21). Seu perfil de efeitos adversos a coloca como
uma alternativa quando da não-resposta a outras DMCD.
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Benefício sobre estado funcional, número de articulações edemaciadas e
doloridas e sobre redução da progressão radiológica foi demonstrado pela ciclosporina (22).
Sua toxicidade, entretanto, limita sua utilização para pacientes com doença não-responsiva
a outras DMCD.
Ensaios clínicos e metanálises comparando as diversas DMCD entre elas
não demonstraram superioridade significativa de nenhuma delas (14,23-28). A toxicidade
das drogas, aliado à sua experiência de uso norteia a escolha, fazendo com que a
hidroxicloroquina, a sulfassalazina e o metotrexate sejam as drogas que detêm a melhor
relação risco-benefício, sendo assim as preferidas.
5.1. Orientações Gerais para todos os Pacientes
Os pacientes portadores de Artrite Reumatóide deverão ser orientados para:
a) participarem, onde disponível, de grupos de apoio a pacientes artríticos,
principalmente aqueles reconhecidos pelo Ministério da Saúde
b) participarem, onde haja disponível, de programa de proteção articular
orientado por terapeuta ocupacional e/ou fisioterapeuta;
c) realizarem exercícios para preservação de tônus muscular e manutenção
da amplitude e função articular, no período intercrises, orientados por fisioterapêuta e/ou
educador físico;
d) repouso articular durante as crises, gelo local.
5.2. Fármacos
5.2.1. Antiinflamatórios não-esteroidais (AINE)
Não existe diferença de eficácia antiinflamatória entre os AINEs atualmente
disponíveis. Os inibidores mais seletivos da ciclooxigenase 2 (COX-2) estão associados a
uma menor incidência de efeitos adversos gastrointestinais quando comparados com AINEs
não seletivos (29,30). Entretanto, este benefício é perdido quando os pacientes fazem uso
de baixas doses de ácido acetilsalicílico (30). Redução significativa das taxas de
complicações gastrointestinais associadas aos AINEs não seletivos são conseguidas com a
associação de drogas protetoras gástricas (inibidores da bomba de prótons e antagonistas
H2)(31).
O uso de inibidores seletivos da COX-2 parece estar associado a um
aumento na incidência de fenômenos oclusivos vasculares, tais como infarto do miocárdio,
em observação a ser explorada por estudos específicos e no momento sem conclusões
definitivas na literatura médica (29).
Desta forma, para pacientes que não sejam portadores de cardiopatia
isquêmica, que não estejam fazendo uso de ácido acetilsalicílico e que apresentem alto risco
para o desenvolvimento de complicações gastrointestinais (como história prévia de úlcera
gastro-duodenal documentada, hemorragia digestiva ou perfuração gastro-duodenal) podese utilizar inibidores da COX-2.
5.2.2. Anti-maláricos
Dose: hidroxicloroquina: 400mg/dia, difosfato de cloroquina: 250 mg/dia,
até efeito máximo (usualmente 8-12 semanas). Após, a dose pode ser reduzida pela metade.
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Contra-indicações: Contra-indicada em pacientes que apresentem alterações
retinianas e de campo visual atribuídas a cloroquinas. A incidência de depósitos retinianos é
bem menor com o uso da hidroxicloroquina.
Monitoramento: efeito máximo pode levar de 3 a 6 meses; devem ser
realizados exames oftalmológicos no início do tratamento e a cada 6 meses, além de
contagem de células brancas. Depósitos na córnea não constituem contra-indicação à
manutenção do tratamento, eis que sofrem reabsorção espontânea mesmo na vigência do
uso de anti-maláricos. Estas drogas não são hepatotóxicas.
5.2.3. Sulfassalazina
Dose: inicia-se com 0,5-1g/dia aumentando 0,5g semanalmente até 1g 3-4
vezes ao dia. Depois de alcançado o efeito, em geral após 2 a 3 meses de uso continuado, a
dose pode ser reduzida para 2g/dia em doses divididas para a manutenção.
Contra-indicações: Contra-indicada em pacientes com história de
hipersensibilidade a sulfas, salicilatos ou a qualquer componente da fórmula da
sulfassalazina, portadores de porfiria, obstrução de aparelho digestório ou gênito-urinário.
Monitoramento: o efeito costuma ser alcançado em 1 a 2 meses. Deve haver
monitoramento de hemograma (risco de leucopenia e agranulocitose) e provas hepáticas a
cada 2 semanas nos primeiros 3 meses, mensal nos 3 meses subseqüentes e a cada 3 meses
após (10). Monitorizar exame de urina pelo risco de formação de cálculos. Aumentar a
ingesta hídrica. Eventualmente alcalinizar a urina com bicarbonato de sódio, 1 colher de
sopa ao dia.
5.2.4. Metotrexate
Dose: 7,5 mg/semana, podendo ser aumentada até 25mg/semana se não
houver resposta após 6-8 semanas de tratamento. Havendo resposta, o intervalo de dose
pode ser aumentado para cada 2 semanas.
Contra-indicações: Contra-indicado em pacientes com insuficiência renal
e/ou hepática grave, em pacientes com supressão da medula óssea, em mulheres grávidas e
em etilistas.
Monitoramento: provas de lesão hepática (TGO, TGP), leucograma e
contagem de plaquetas mensalmente. A administração do metotrexate pode ser associada ao
uso de ácido fólico (1-2mg/dia) para minimizar efeitos adversos nos pacientes que os
apresentarem (32).
5.2.5. Azatioprina
Dose: 1mg/kg/dia por 6-8 semanas aumentando 0,5mg/kg a cada 4 semanas
até resposta ou até 2,5mg/kg/dia.
Contra-indicações: contra-indicado em mulheres grávidas.
Monitoramento: leucograma, contagem de plaquetas, bilirrubinas e fosfatase
alcalina.
5.2.6. Leflunomide
Dose: iniciar nos primeiros 3 dias de tratamento com 100mg ao dia, via oral.
Após o 3º dia, 20mg ao dia. Alguns pacientes respondem de forma consistente à dose de 10
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
mg ao dia. A dose pode também ser diminuída para 10mg ao dia para os pacientes que não
tolerem os 20mg.
Contra-indicações: contra-indicado em mulheres grávidas.
Monitoramento: devem ser avaliadas as transaminases antes do início do
tratamento e mensalmente durante a fase inicial. Permanecendo normais, pode haver
aumento do intervalo da monitorização.
5.2.7. Ciclosporina
Dose: dose inicial de 2,5 mg/kg/dia, via oral, dividida em 2 tomadas. A dose
pode ser aumentada em 0,5-0,75 mg/kg/dia se não houver resposta adequada em 8 semanas
de tratamento. Novo incremento da dose pode ser realizado na 12ª semana de tratamento, se
necessário, com uma dose máxima de 4 mg/kg/dia. Não havendo resposta até a 16ª semana
deve ser considerada falha terapêutica.
Contra-indicações: Contra-indicada em pacientes com alteração da função
renal, hipertensão não controlada e malignidade.
Monitoramento: devem ser avaliadas a pressão arterial sistêmica e função
renal (creatinina) no início do tratamento. Estas avaliações devem ser repetidas a cada 2
semanas nos primeiros 3 meses de tratamento. Se houver o desenvolvimento de
hipertensão, deve ser realizada redução de 25 a 50% da dose de ciclosporina. Persistindo
hipertensão após esta redução, o tratamento deve ser descontinuado.
5.2.8. Infliximab
Dose: 3 mg/kg administrados via intravenosa, seguida da mesma dose (3
mg/kg) na semana 2 e 6 e, após a cada 8 semanas. Deve sempre ser utilizado conjuntamente
com metotrexate (5).
Contra-indicações: contra-indicado em mulheres grávidas ou que estejam
amamentando, em vigência de infecção ativa ou em pacientes com alto risco para o
desenvolvimento de infecções (úlcera crônica de membros inferiores, artrite séptica nos
últimos 12 meses [ou indefinidamente se em prótese que não foi retirada], infecções
pulmonares persistentes ou recorrentes, esclerose múltipla, tuberculose não adequadamente
tratada), em pacientes com doenças malignas atuais ou passada (menos de 10 anos).
Monitoramento: acompanhar o surgimento de sinais de infecção,
principalmente tuberculose.
5.3. Tratamento da Artrite Reumatóide Leve (33)
5.3.1. Tratamento Inicial
▪ uso de AINE;
▪ analgésicos comuns (paracetamol) conforme necessidade;
▪ o uso de DMCD (anti-maláricos ou sulfassalazina).
5.3.2. Sem controle após 4 semanas de tratamento
▪ troca de AINE;
▪ uso de corticosteróides intra-articular se pauciarticular (poucas articulações
acometidas).
5.3.3. Sem controle após 3-5 semanas
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
▪ tratamento como AR moderada.
5.4. Tratamento da Artrite Reumatóide Moderada(34)
5.4.1. Tratamento Inicial
▪ uso de AINE;
▪ uso de DMCD ( anti-maláricos, sulfassalazina ou metotrexate);
▪ analgésicos comuns (paracetamol), conforme necessidade.
5.4.2. Sem controle após 4 semanas de tratamento
▪ troca de AINE;
▪ uso de corticosteróides intra-articular se pauciarticular.
5.4.3. Sem controle após 3-5 semanas de tratamento
▪ Associa-se prednisona 7,5 mg/dia enquanto se aguarda por efeito máximo
das DMCDs, tentando reduzir a dose após controle clínico.
5.4.4. Sem controle após período de efeito máximo da DMCD
▪ tratamento como AR grave.
5.5. Tratamento da Artrite Reumatóide Grave (34)
5.5.1. Tratamento Inicial
▪ uso de AINE;
▪ uso de DMCD (metotrexate);
▪ analgésicos comuns (paracetamol), conforme necessidade.
5.5.2. Se o paciente está febril, ou apresenta deterioração rápida apesar do
tratamento
▪ associa-se prednisona 5-20mg/dia com redução da dose após 8-12
semanas, objetivando manter dose inferior a 10mg/dia.
5.5.3. Não havendo resposta ao metotrexate em doses adequadas ou havendo
contra-indicação para seu uso
▪ utiliza-se a associação de sulfassalazina e anti-maláricos, ou
▪ azatioprina isoladamente, ou
▪ leflunomide isoladamente, ou
▪ ciclosporina isoladamente.
5.5.4. Se não houver resposta a pelo menos dois esquemas de tratamento
anteriores
▪ Nestes casos utiliza-se associações de DMCD
- metotrexate + anti-maláricos, ou
- metotrexate + sulfassalazina, ou
- metotrexate + sulfassalazina + anti-maláricos, ou
- metotrexate + ciclosporina, ou
- metotrexate + leflunomide.
5.5.5. Se não houver resposta ao uso de pelo menos uma das associações do
item 5.5.4
▪ utiliza-se infliximab associado a metotrexate.
5.6. Benefícios Esperados com o Tratamento
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
Alívio dos sintomas, diminuição de morbidade e de perda funcional.
5.7. Tempo de Tratamento e Critérios de Interrupção de Tratamento
O tratamento com antiinflamatórios deve ser mantido enquanto se observar
sinais inflamatórios e/ou o paciente apresentar dores articulares.
O uso de DMCD deve ser mantido indefinidamente.
Os antagonistas do Fator de Necrose Tumoral devem ser suspensos
temporariamente frente a gravidez e durante infecções graves. Devem ser suspensos
indefinidamente se ocorrerem efeitos adversos significativos (desenvolvimento de
malignidade, toxicidade grave relacionada à droga) ou se não houver resposta clínica
significativa em 3 meses de tratamento (5).
6. Monitorização
Além da monitorização dos efeitos adversos das medicações, conforme
descrito para cada fármaco no item 5.2, deve ser realizada a monitorização da atividade da
doença, conforme abordado na Introdução deste Protocolo.
7. Comitê de Especialistas
O gestor estadual poderá constituir um Comitê Estadual de Especialistas
para avaliação dos casos complicados onde a associação de dois ou mais DMCD são
indicados ou for necessário o uso de antagonistas do Fator de Necrose Tumoral.
8. Consentimento informado
É obrigatória a cientificação do paciente, ou de seu responsável legal, dos
potenciais benefícios e riscos deste tratamento, o que deverá ser formalizado por meio da
assinatura de Termo de Consentimento Informado, de acordo com o modelo que faz parte
deste Protocolo.
9. Referências Bibliográficas
1. Lipski PE. Rheumatoid arthitis. In. Harrison´s Principles of Internal
Medicine. International edition, 14th ed., 1998.
2. ACR Clinical Guidelines Committee. Guidelines for the management of
rheumatoid arthritis. Arthitis e Rheumatism 1996;39(5):713-22.
3. Symmons DP, Barrett EM, Bankhead CR, Scott DG, Silman AJ. The
incidence of rheumatoid arthritis in the United Kingdom: results from the Norfolk Arthritis
Register. Br J Rheumatol 1994;33:735-39
4. Felson DT, Anderson JJ, Boers M, Bombardier C, Furst D, Goldsmith C,
et al. American College of Rheumatology Preliminary definition of improvement in
rheumatoid arthritis. Arthritis Rheum 1995;38:727-35
5. National Institute for Clinical Excellence. Guidance on the use of
etanercept and infliximab for the treatment of rheumatoid arthritis. www.nice.org.uk em
junho de 2002.
6. Gotzsche PC, Johansen HK. Short-term low-dose corticosteroids vs
placebo and nonsteroidal antiinflammatory drugs in rheumatoid arthritis (Cochrane
Review). In: The Cochrane Library, Issue 3, 2000. Oxford: Update Software.
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
7. Criswell LA, Saag KG, Sems KM, Welch V, Shea B, Wells G, SuarezAlmazor ME. Moderate-term, low-dose corticosteroids for rheumatoid arthritis (Cochrane
Review). In: The Cochrane Library, Issue 3, 2000. Oxford: Update Software.
8. Gotzsche PC, Johansen HK. Meta-analysis of short-term low-dose
prednisolone versus placebo and non-steroidal anti-inflammatory drugs in rheumatoid
arthritis. BMJ 1998;316:811-18.
9. Kirwan JR. Arthritis and rheumatism council low dose glucocorticoid
study group: the effect of glucocorticoids on joint destruction in rheumatoid arthritis. N
Engl J Med 1995;333:142-46.
10. Hickling P, Jacoby RK, Kirwan JR, et al. Joint destruction after
glucocorticoids are withdrawn in early rheumatoid arthritis. Br J Rheumatol 1998;37:93036.
11. Suarez-Almazor ME, Belseck E, Shea B, Homik J, Wells G, Tugwell P.
Antimalarials for rheumatoid arthritis (Cochrane Review). In: The Cochrane Library, Issue
3, 2000. Oxford: Update Software.
12. Suarez-Almazor ME, Belseck E, Shea B, Wells G, Tugwell P.
Sulfasalazine for rheumatoid arthritis (Cochrane Review). In: The Cochrane Library, Issue
3, 2000. Oxford: Update Software.
13. Weinblatt ME, Reda D, Henderson W, et al. Ssulfasalazine treatment for
rheumatoid arthritis: a metaanalysis of 15 randomized trials. J Rheumatol 1999;26:2123-30.
14. Smolen JS, Kalden JR, Scott DL, et al. Efficacy and safety of
leflunomide compared to placebo and sulphasalazine in active rheumatoid arthritis: a
double-blind, randomized, multicentre trial. Lancet 1999;353:259-66.
15. Suarez-Almazor ME, Belseck E, Shea B, Wells G, Tugwell P.
Methotrexate for rheumatoid arthritis (Cochrane Review). In: The Cochrane Library, Issue
3, 2000. Oxford: Update Software.
16. Wolfe F, Hawley DJ, Cathey MA. Termination of slow acting antirheumatic therapy in rheumatoid arthritis: a 14 year prospective evaluation of 1017 starts. J
Rheumatol 1990;17:994-1002.
17. Pincus T, Marcum SB, Callahan LF. Long-term drug therapy for
rheumatoid arthritis in seven rheumatology private practices: II. Second line drugs and
prednisone. J Rheumatol 1992;19:1885-94.
18. Fries JF, Williams CA, Ramey D, Bloch DA. The relative toxicity of
disease-modifying antirheumatic drugs. Arthritis Rheum 1993;36:297-306.
19. Suarez-Almazor ME, Soskoine CL, Saunders LD, Russell AS. Use of a
second-line drug in the treatment of rheumatoid arthritis in Edmonton, Alberta: patterns of
prescription and long-term effectiveness. J Rheumatol 1995;22:836-43.
20. Hewitson PJ, DeBroe S, McBride A, Milne R. Leflunomide and
rheumatoid arthritis: a systematic review of effectiveness, safety and cost implications. J
Clin Pharm Ther 2000;25:295-302.
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
21. Suarez-Almazor ME, Spooner C, Belseck E. Azathioprine for
rheumatoid arthritis (Cochrane Review). In: The Cochrane Library, Issue 3, 2000. Oxford:
Update Software.
22. Wells G, Haguenauer D, Shea B, Suarez-Almazor ME, Welch VA,
Tugwell R. Cyclosporin for Rheumatoid Arthritis. In: The Cochrane Library, Issue 1, 2000.
Oxford: Update Software.
23. Felson DT, Anderson JJ, Meenan RF. The comparative efficacy and
toxicity of second-line drugs in rheumatoid arthritis: results of two meta-analysis. Arthritis
Rheum 1990;33:1449-61.
24. Felson DT, Anderson JJ, Meenan RF. Use of short-term efficacy/toxicity
trade-offs to select second-line drugs in rheumatoid arthritis: a meta-analysis of published
clinical trials. Arthritis Rheum 1992;35:1117-25.
25. Gotzsche PC, Podenphant J, Olesen M, Haiberg P. Meta-analysis of
second-line drugs: sample size bias and uncertain benefit. J Clin Epidemiol 1992;45:58794.
26. Suarez-Almazor ME, Belseck E, Wells G, Shea B, Tugwell R. Metaanalysis of placebo controlled trials of disease-modifying antirheumatic drugs (DMARD)
for the treatment of rheumatoid arthritis (RA). Arthritis Rheum 1998;41:S153
27. Strand V, Cohen S, Schiff M, et al. Treatment of rheumatoid arthritis
with leflunomide compared with placebo and methotrexate. Arch Intern Med
1999;159:2542-50.
28. Drosos AA, Voulgari PV, Papadopoulus IA, Politi EN, Georgiou PE.
Cyclosporin A in the treatment of early rheumatoid arthritis. A prospective randomized 24month study. Clin Exp Rheumatol 1998;16:695-701.
29. Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis
B, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients
with rheumatoid arthritis. N Engl J Med 2000;343:1520-08.
30. Silverstein FE, Faich G, Goldstein JL, Simon LS, Pincus T, Whelton A,
et al. Gastrointestinal toxicity with celecoxib vc nonsteroidal antiinflamatory drugs for
osteoarthritis and rheumatoid arthritis: the CLASS study: A randomized controlled trial.
JAMA 2000;284:1247-55.
31. Roston A, Wells G, Tugwell P, Welch V, Dube C, McGowan J.
Prevention of NSAID-induced gastroduodenal ulcers (Cochrane Review). In: The Cochrane
Library, Issue 3, 2002. Oxford: Uptodate Software.
32. Ortiz Z, Shea B, Suarez Almazor M, Moher D, Wells G, Tugwell P.
Folic acid and folinic acid for reducing side effects in patients receiving methotrexate for
rheumatoid arthritis (Cochrane Review). In: The Cochrane Library, Issue 3, 2000. Oxford:
Update Software.
33. Harris ED, Schur PH, Maine RN. Treatment of active rheumatoid
arthritis - I. In: UpToDate, Rose, BD (Ed), UpToDate, Wellesley, MA 2001.
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
34. Harris ED, Schur PH, Maine RN. Treatment of active rheumatoid
arthritis - II. In: UpToDate, Rose, BD (Ed), UpToDate, Wellesley, MA 2001.
TERMO DE CONSENTIMENTO INFORMADO
Antiinflamatórios
não-esteroidais,
Prednisona,
Hidroxicloroquina,
Cloroquina, Sulfassalazina, Metotrexate, Azatioprina, Leflunomide, Ciclosporina,
Infliximab
Eu _________________________ (nome do(a) paciente), abaixo
identificado(a) e firmado(a), declaro ter sido informado(a) claramente sobre todas as
indicações, contra-indicações, principais efeitos colaterais, relacionados ao uso dos
medicamentos Antiinflamatórioss não-esteroidais, Prednisona, Hidroxicloroquina,
Cloroquina, Sulfassalazina, Metotrexate, Azatioprina, Leflunomide, Ciclosporina,
Infliximab indicados para o tratamento da Artrite Reumatóide.
Os termos médicos foram explicados e todas as minhas dúvidas foram
resolvidas pelo médico __________________________ (nome do médico que prescreve).
Expresso também minha concordância e espontânea vontade em submeterme ao referido tratamento, assumindo a responsabilidade e os riscos pelos eventuais efeitos
indesejáveis decorrentes.
Assim declaro que:
Fui claramente informado que os medicamentos que passo a receber podem
trazer os seguintes benefícios ao paciente portador de artrite reumatóide:
Diminuição da inflamação das articulações com melhora das dores;
Diminuição da progressão da lesão das articulações com menor chance do
ocorrer deformidades articulares.
Fui também claramente informado a respeito dos potenciais efeitos
colaterais, contra-indicações, riscos e advertências a respeito dos medicamentos no
tratamento da artrite reumatóide:
Medicações classificadas na gestação como fator de risco B (estudos em
animais não mostraram anormalidades nos descendentes, porém não há estudos em
humanos; risco para o bebê muito improvável); C (estudos em animais mostraram
anormalidades nos descendentes, porém não há estudos em humanos; o risco para o bebê
não pode ser descartado, mas um benefício potencial pode ser maior que os riscos), D (há
evidências de riscos ao feto, mas um benefício potencial pode ser maior que os riscos) e X
(estudos em animais ou em humanos claramente demonstram risco para o bebê que
suplantam quaisquer potenciais benefícios, sendo a droga contra-indicada na gestação):
- Categoria B: Sulfassalazina* , AINEs (antiinflamatórioss não esteróides)**
- Categoria C: Hidroxicloroquina, Ciclosporina, Prednisona, Infliximab,
AINEs**
- Categoria D: Azatioprina, Sulfassalazina*
- Categoria X: Leflunomide, Metotrexate
* A sulfassalazina é classificada como B no primeiro trimestre da gestação e
como D no terceiro trimestre.
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
** Os AINEs, por serem um grupo de medicamentos heterogêneo,
apresentam representantes classificados como B e como C.
Contra-indicados em casos de hipersensibilidade (alergia) aos fármacos;
O risco de infecções de várias etiologias e alguns tipos de neoplasias
(câncer) é aumentado, principalmente, com o uso destes fármacos em associação;
Diversos efeitos colaterais podem ocorrer, de acordo com as diferentes
drogas:
AINEs: as principais reações adversas são relacionadas ao trato
gastrointestinal. Gastrointestinais: náuseas, vômitos, perda de apetite, desconforto
abdominal, gastrite, úlcera péptica, azia, dor e desconforto epigástrico, plenitude gástrica,
perfuração intestinal, eructação (arrotos), boca seca, colite, refluxo gastro-esofágico,
gastroenterite, proctite, íleo paralítico, salivação, glossite, aumento da fosfatase alcalina,
aumento de LDH, presença de sangue nas fezes, disfagia, necrose bucal, esteatose,
diverticulite, hérnia de hiato, hemorróides, pedra na vesícula, pancreatite, alterações
dentárias, hepatite, amarelão, cirrose, disfunções hepáticas; Cardiovasculares: alteração da
pressão arterial (pressão alta ou baixa), edema periférico, retenção de líquidos, angina de
peito, insuficiência cardíaca, infarto do miocárdio, palpitações, arritmias cardíacas,
desmaios, vasculite, insuficiência venosa, alteração da freqüência do coração (aumento ou
diminuição), vasculopatia periférica; Neurológicos: sonolência, dor de cabeça, tonturas,
nervosismo, vertigens, fraqueza, insônia, confusão, depressão, tremor, convulsões,
formigamentos, sonhos anormais, perda da capacidade de concentração, piora de epilepsias
e parkinsonismos, isquemia cérebro-vascular, instabilidade do humor, distúrbios
psiquiátricos (incluindo psicose aguda), alucinações, despersonalização, meningite
asséptica, movimentos involuntários, amnésia, coma, distúrbios do sono, agitação,
excitação, desorientação, sintomas extrapiramidais, síndrome de Lyell; Dermatológicos:
alergias de pele, queda de cabelo, alteração da coloração da pele, alteração das unhas,
infecções por herpes; Gênito-urinário: alterações da menstruação, impotência sexual,
sangramento vaginal, sintomas de menopausa, alterações da mama, desordens prostáticas,
infecções vaginais; Hematológicos: alterações (aumento ou diminuição) das células do
sangue (brancas, vermelhas e plaquetas); sangramento nasal, depressão da medula óssea,
alteração da coagulação, hemorragias, síndrome hemolítico-urêmica, alterações da uréia;
Metabólicos: alteração de apetite e do peso, alterações da glicemia, hipercalemia,
hiponatremia, aumento do suor, hipercolesterolemia; Músculo-esqueléticos: dores e rigidez
em músculos e articulações, cansaço, cãibras,; Renal: infecções do trato urinário, dor ao
urinar, alteração da freqüência e quantidade de micção, retenção urinária, pedra nos rins,
incontinência urinária, sangue na urina, insuficiência renal, perda de proteína na urina;
Respiratório: falta de ar, infecções, asma, broncoespasmo, respiração curta, pneumonite
eosinofílica, secura do nariz, secreção e/ou congestão nasal, depressão respiratória, edema
na faringe; Diversos: distúrbios visuais com visão borrada, perda temporária da visão,
edema macular, catarata, glaucoma, conjuntivite, fotofobia, escotomas, irritação dos olhos,
cegueira noturna, hemorragia na retina, alterações da pigmentação, perda da visão a cores;
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
distúrbios da audição, dor de ouvido, impactação de cerume, alterações do paladar,
sintomas semelhantes a resfriado, febre, calafrios, sede excessiva, cólicas, infecções.
Cloroquina/Hidroxicloroquina: principais reações adversas incluem as
oculares, sendo necessário, inclusive, acompanhamento oftalmológico periódico; Oculares:
distúrbios visuais com visão borrada e fotofobia, edema macular, pigmentação anormal,
retinopatia, atrofia do disco óptico, escotomas, diminuição da acuidade visual, nistagmo;
Neurológicos: irritabilidade, ansiedade, alterações emocionais, pesadelos, psicoses, dores
de cabeça, tonturas, convulsões, movimentos involuntários, fadiga. Dermatológicos:
branqueamento e queda de cabelos, mudanças da cor da pele, rash podendo variar desde
apenas vermelhidão da pele até quadros graves como síndrome de Stevens-Johnson
(formação de bolhas e com perda de regiões da pele e de mucosas). Gastrointestinais:
náuseas, vômitos, perda de apetite, desconforto abdominal, diarréia; Hematopoéticos:
parada na produção de sangue pela medula óssea (anemia aplásica), parada na produção de
células brancas pela medula óssea (agranulocitose), diminuição das células brancas do
sangue e das plaquetas, destruição das células do sangue (hemólise); Músculo-esqueléticos:
miopatia, paralisia, neuromiopatia levando a fraqueza e atrofia dos músculos proximais;
Diversos: zumbido, surdez, miocardiopatia (efeito raro).
Metotrexate: a incidência e severidade dos efeitos adversos, particularmente
os hepáticos, parece estar relacionada a freqüência da dose e duração do tratamento.
Toxicidade tende a ocorrer menos freqüentemente e ser menos severa com doses semanais
do que com doses diárias; Neurológicos: convulsões, encefalopatia, febre, calafrios,
sonolência; Dermatológicos: queda de cabelo, espinhas e furúnculos, alergias de pele,
sensibilidade à luz (fotossensibilidade), alterações da pigmentação da pele, formação de
bolhas e com perda de regiões da pele e de mucosas (Síndrome de Stevens-Johnson e
necrólise epidérmica tóxica); Gastrointestinais: náuseas, vômitos, perda de apetite,
inflamação na boca, úlceras de trato gastro-intestinal, hepatite, cirrose e necrose hepática;
Hematopoéticos: diminuição das células brancas do sangue e das plaquetas; Diversos:
insuficiência renal, nefropatia, faringites, pneumonite e fibrose pulmonar, diminuição das
defesas imunológicas do organismo com ocorrência de infecções.
Leflunomide: Cardiovasculares: pressão alta, dor no peito, palpitações,
aumento da freqüência cardíaca, vasculites, varizes, edema; Respiratório: infecções
respiratórias, bronquite, tosse, faringite, rinite, sinusite, asma, falta de ar, sangramento
nasal; Gastrointestinais: diarréia, hepatite, náuseas, vômitos, perda de apetite, gastrite,
gastroenterite, dor abdominal, azia, gazes, ulcerações na boca, pedra na vesícula, prisão de
ventre, desconforto abdominal, sangramento nas fezes, candidíase oral (infecção por fungos
na boca), aumento das glândulas salivares, boca seca, alterações dentárias, distúrbios do
paladar; Gênito-urinário: infecções do trato urinário, perda de proteína na urina, dor para
urinar, candidíase vaginal (infecção por fungos), alterações da próstata; Neurológicos:
ansiedade, depressão, fraqueza, dores de cabeça, tonturas, febre, sonolência, distúrbios do
sono, formigamentos; Dermatológicos: alteração da cor e queda de cabelo, alergias de pele,
coceira, pele seca, espinhas, hematomas, infecções por herpes, alterações das unhas,
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
nódulos subcutâneos, alteração da cor da pele, úlceras de pele; Endócrino-metabólicos:
hipocalemia, diabete mélito, hiperlipidemia, hipertireoidismo, desordens menstruais;
Músculo-esquelético: dores pelo corpo, dor e rigidez nos músculos e articulações, espasmos
musculares, artrose, neuralgia, ruptura de tendão; Oculares: alteração da visão, catarata,
conjuntivite; Diversos: anemia, infecções, alterações da voz.
Azatioprina: principais efeitos tóxicos incluem o sistema hematológico e
gastrointestinal. Hematológicos: anemia, diminuição das células brancas, vermelhas e
plaquetas do sangue. Gastrointestinais: náuseas, vômitos, diarréia, dor abdominal, fezes
com sangue, toxicidade para o fígado. Diversos: febre, calafrios, diminuição de apetite,
vermelhidão de pele, perda de cabelo, aftas, dores articulares, retinopatia, falta de ar,
pressão baixa e reações de hipersensibilidade.
Ciclosporina: principais reações adversas incluem disfunção renal, tremores,
aumento da quantidade de pêlos no corpo, pressão alta, hipertrofia gengival, aumento do
colesterol e triglicerídeos. Cardiovasculares: formigamentos, dor no peito, infarto do
miocardio, batimentos rápidos do coração. Neurológicos: convulsões, confusão, ansiedade,
depressão, fraqueza, dores de cabeça. Dermatológicos: unhas e cabelos quebradiços,
coceira, espinhas. Gastrointestinais: náuseas, vômitos, perda de apetite, gastrite, úlcera
péptica, soluços, inflamação na boca, dificuldade para engolir, hemorragias, inflamação do
pâncreas, prisão de ventre, desconforto abdominal. Hematopoéticos: síndrome hemolíticourêmica, diminuição das células brancas do sangue, linfoma; Diversos: calorões,
hipercalemia, hipomagnesemia, hiperuricemia, toxicidade para os músculos, disfunção
respiratória, sensibilidade aumentada a temperatura e reações alérgicas, toxicidade renal e
hepática, ginecomastia.
Prednisona: Neurológicos: insônia, nervosismo, vertigem, convulsões,
psicose, pseudotumor cerebral, dor de cabeça, delírio, alucinações, euforia.
Gastrointestinais: úlcera péptica, náuseas, vômitos, distensão abdominal, esofagite
ulcerativa, pancreatite. Oftálmicos: catarata, glaucoma. Dermatológicos: aumento da
quantidade de pêlos no corpo, espinha, atrofia de pele, hiperpigmentação, síndrome de
Cushing. Endócrinos: aumento do apetite, diabete mélito, edema, supressão adrenal,
supressão do crescimento, retenção de líquidos, parada da menstruação. Diversos: dores
articulares, sangramentos nasais, pressão alta, hipocalemia, alcalose, fraqueza muscular,
osteoporose, fraturas e reações de hipersensibilidade.
Sulfassalazina: Neurológicos: dores de cabeça; Dermatológicos:
sensibilidade aumentada aos raios solares, formação de bolhas e com perda de regiões da
pele e de mucosas (Síndrome de Stevens-Johnson e necrólise epidérmica tóxica);
Gastrointestinais: dores abdominais, náuseas, vômitos, perda de apetite, diarréia, hepatite,
dificuldade para engolir; Hematológicos: diminuição do número dos glóbulos brancos no
sangue, parada na produção de sangue pela medula óssea (anemia aplásica), anemia por
destruição aumentada dos glóbulos vermelhos do sangue (anemia hemolítica), diminuição
no número de plaquetas no sangue; Respiratório: falta de ar associada a tosse e febre
(pneumonite intersticial); Músculo-esqueléticos: dores articulares, cansaço; Diversos:
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
reações alérgicas (dores articulares, febre, coceira, erupção cutânea), desenvolvimento de
sintomas semelhantes aos do Lúpus Eritematoso Sistêmico (ou seja, bolhas na pele, dor no
peito, mal-estar, erupções cutâneas, falta de ar e coceira).
Infliximab: Gastrointestinais: náuseas, diarréia, dor abdominal, vômito e má
digestão e azia. Neurológicos: dor de cabeça, fadiga, febre, tontura, dor. Dermatológicos:
rash cutâneo, prurido. Respiratórios: bronquite, rinite, infecção de vias aéreas superiores,
tosse, sinusite, faringite, reativação de tuberculose. Diversos: reação a infusão, dor no peito,
infecções, reações de hiperssensibilidade¸ dor nas articulações, dor nas costas, infecção no
trato urinário. Também estão relatados como evento adverso: abscesso, hérnia abdominal,
Síndrome da Angústia Respiratória do Adulto, aumento das transaminases hepáticas (ALT
e AST), anemia, ansiedade, apendicite, arritmia, artrite, bloqueio atrioventricular, azotemia,
carcinoma basocelular, cólica biliar, fratura óssea, bradicardia, infarto cerebral, câncer de
mama, parada cardíaca, insuficiência cardíaca, celulite, colecistite, colelitíase, confusão,
desidratação, delírio, depressão, hérnia diafragmática, falta de ar, disúria, edema,
encefalopatia, endometriose, endoftalmite, furunculose, úlcera gástrica, hemorragia
gastrointestinal, hepatite colestática, herpes zoster, hidronefrose, pressão alta ou baixa,
hérnia de disco intervertebral, inflamação, obstrução intestinal, perfuração intestinal,
estenose intestinal, cisto articular, degeneração articular, infarto renal, leucopenia,
linfangite, lúpus eritematoso sistêmico, linfoma, mialgia, isquemia miocárdica, osteoartrite,
osteoporose, isquemia periférica, derrame pleural, dor pleurítica, pneumonia, pneumotórax,
edema pulmonar, embolia pulmonar, cálculo renal, insuficiência renal, insuficiência
respiratória, nódulos reumatóides, palpitação, insuficiência pancreática, pancreatite,
peritonite, pielonefrite, adenocarcinoma de reto, sepse, câncer de pele, sonolência, infartos
esplênicos, espondilolistese, esplenomegalia, tentativa de suicídio, desmaios, taquicardia,
problemas nos tendões, diminuição de plaquetas, trombose, úlceras, lesão no neurônio
motor superior, obstrução ureteral e perda de peso. Pode facilitar o estabelecimento ou
agravar infecções fúngicas e bacterianas;
O risco da ocorrência de efeitos adversos aumenta com a superdosagem.
Estou da mesma forma ciente que pode haver necessidade de mudança das
doses, assim como o tipo de medicamentos que farão parte do meu tratamento.
Estou ciente que posso suspender este tratamento a qualquer momento, sem
que este fato implique em qualquer forma de constrangimento entre eu e meu médico, que
se dispõe a continuar me tratando em quaisquer circunstâncias.
O meu regime de tratamento constará de:
□AINEs
□Hidroxicloroquina/Cloroquina metronidazol
□Sulfassalazina
□Metotrexate
□Azatioprina
□Ciclosporina
□Leflunomide
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002
MINISTÉRIO DA SAÚDE
DEPARTAMENTO NACIONAL DE AUDITORIA DO SUS
COORDENAÇÃO DE SISTEMAS DE INFORMAÇÃO
SISTEMA ÚNICO DE SAÚDE - LEGISLAÇÃO FEDERAL
INFORMES
□Corticosteróides
□Infliximab
Assim o faço por livre e espontânea vontade e por decisão conjunta, minha e
de meu médico.
Paciente:
R.G. do paciente:
Sexo do paciente: ( )
Masculino ( )
Feminino ( )
CEP:
Telefone: ( )
Idade do Paciente:
Endereço:
Cidade:
Responsável Legal (quanto for o caso):
R.G do responsável legal:
____________________________________________
Assinatura do Paciente ou Responsável
Médico Responsável:
CRM:
Endereço do Consultório:
Cidade:
CEP:
____________________________
Assinatura e Carimbo do Médico
Telefone: ( )
____/____/____
Data
Observações:
1. Preenchimento completo deste Termo e sua respectiva assinatura são
imprescindíveis para o fornecimento dos medicamentos.
2. Este Termo será preenchido em duas vias ficando uma arquivada na
farmácia responsável pela dispensação dos medicamentos e outra no prontuário do
paciente.
____________________________________________________________________________________
__
Este texto não substitui o publicado no(a) Diário Oficial da União de 08/11/2002