OLIMPÍADA PERNAMBUCANA DE QUÍMICA – 2014
MODALIDADE III
01. V ou F?
( ) Apesar de suas moléculas conterem dois átomos, nitrogênio, cloro e oxigênio são substâncias simples.
( ) CH4 é uma substância simples enquanto C2H4 é composta.
( ) Substâncias simples têm baixo ponto de ebulição, ao contrário das substâncias compostas.
( ) Substâncias simples não podem ser decompostas.
( ) Como possuem diferentes densidades, é possível separar substâncias simples das compostas por
decantação.
02. Quando a panela de pressão “apita”, V ou F?
( ) a água da panela entrou em ebulição.
( ) a temperatura interna permanece constante.
( ) não precisa mais do fogo.
( ) inicia o cozimento.
( ) neste ponto é recomendável fechar a válvula.
03. Assinale V ou F:
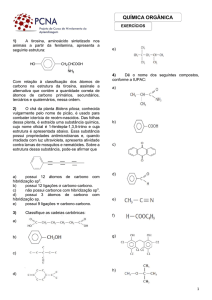
( ) Todos os metais formam bases.
( ) Metais alcalinos formam bases fortes.
( ) Metais alcalinos terrosos formam bases fracas.
( ) Hidróxidos dos metais alcalinos terrosos são pouco solúveis em água.
( ) Uma base é tanto mais forte quanto maior for o seu grau de ionização.
04. Ao agitar um refrigerante aberto (V ou F):
( ) ocorre uma perturbação do equilíbrio químico CO2(g) + H2O(l) ↔ H2CO3(aq)
( ) libera de CO2 para o ambiente.
( ) eleva a temperatura do refrigerante.
( ) eleva a pressão interna no recipiente.
( ) eleva a concentração de CO2 no líquido.
05. Indique V ou F:
( ) Acima de 100 °C a água certamente estará em ebulição.
( ) A água pode ferver a 0°C.
( ) À pressão de 1atm, a água do mar ferve a 100°C.
( ) No caso da água destilada, sua temperatura de ebulição não varia com a altitude.
( ) À pressão de 1 atm, água doce ferve a menos de 100°C.
06. Nas condições ambientes, é exemplo de sistema em estado de equilíbrio (V ou F):
( ) um copo de água salgada.
( ) uma bolinha de naftalina
( ) um gás colocado num balão de fundo redondo;
( ) água fervendo em temperatura constante;
( ) uma pedra de gelo no congelador.
07. Sobre os tipos de radiação responda V ou F.
( ) ao emitir radiação alfa, a massa do átomo permanece inalterada.
( ) ao emitir radiação beta, um núcleo tem seu número de massa inalterado.
( ) ao emitir radiação gama, um núcleo não sofre alteração em sua massa.
( ) ao emitir radiação beta, um átomo tem seu número atômico aumentado em uma unidade.
( ) a radiação alfa é um átomo de hélio.
1
OLIMPÍADA PERNAMBUCANA DE QUÍMICA – 2014
MODALIDADE III
08. Na combustão de um mol de etanol, assinale V ou F.
( ) nem sempre são obtidos dois mols de dióxido de carbono.
( ) a reação nunca será reversível.
( ) a reação é exotérmica.
( ) o oxigênio é o agente oxidante.
( ) o número de mols de gás oxigênio usado é igual ao número de mols de água do que se forma.
09. Considerando a célula eletroquímica M(s) │ Mn+ (aq) ║ Xn+ (aq) │ X(s), indique V ou F:
( ) A espécie M é o agente oxidante.
( ) X é o ânodo.
( ) Os elétrons fluem, pelo circuito externo, de M para X.
( ) Há dissolução do eletrodo de X.
( ) A concentração da solução da espécie M diminui com o tempo.
10. Sobre o carbono analise as alternativas abaixo e indique V ou F.
( ) Os nanotubos de carbono são formados por ligações entre carbonos sp 2 similares aos do grafite.
( ) A hibridização sp3 explica a dureza do diamante.
( ) A hibridização sp2 explica a porque o grafite conduz eletricidade.
( ) No carbono amorfo, seus átomos não sofrem hibridização.
( ) Como o fulereno é esférico, ele possui os três tipos de hibridização do carbono.
11. Indique V ou F:
( ) Os átomos, mesmo num sólido, estão em constante movimento.
( ) O átomo de Dalton não é átomo.
( ) Átomos contêm quarks.
( ) Lavoisier não acreditava na existência de átomos.
( ) O DNA é a maior molécula existente.
12. Dadas representações moleculares da glicose e frutose assinale V ou F.
(
(
(
(
(
) glicose é um aldeído.
) a frutose é uma cetona.
) glicose e frutose são isômeros de função.
) glicose e frutose são isômeros de posição.
) glicose e frutose não são isômeros
13. Sobre a atuação de plastificantes em cadeias poliméricas do PVC representada abaixo, indique V ou F
nas alternativas para a função do plastificante:
Esquema 1: Sem plastificante
Esquema 2: Com plastificante
( ) aumentar a ramificação do PVC.
( ) aumentar a interação eletrostática entre os átomos de Cl de uma camada e o de H de outra camada.
2
OLIMPÍADA PERNAMBUCANA DE QUÍMICA – 2014
MODALIDADE III
( ) atenuar as ligações dipolo-dipolo entre as cadeias poliméricas.
( ) minimizar o impedimento estérico.
( ) reduzir o grau de polimerização.
14. Em relação à água oxigenada, indique V ou F:
( ) Como se decompõe em água e oxigênio, sua adição ao leite não altera as propriedades deste alimento.
( ) Como agente oxidante, pode causar a ferrugem.
( ) Sua fórmula molecular é H2O2, e neste caso, o número de oxidação do oxigênio é -2.
( ) Pode ser decomposta pela luz.
( ) Por ser amarelada, é utilizada para tingir o cabelo.
15. Sabendo que o calor de combustão do H2(g) = - 68 kcal/mol e do CH4(g) = -213 kcal/mol, indique qual dos
dois combustíveis liberaria uma maior quantidade de calor por grama. Dados: C= 12 e H = 1.
16. A reação da queima do butano em oxigênio, formando dióxido de carbono e água é representada pela
equação: xC4H10 + yO2 → zCO2 + wH2O
Onde a soma dos coeficientes x, y, z e w é igual a:
17. Calcule o pH de uma solução 0,1 M de ácido acético. Dado: Ka do ácido acético = 1,74 x 10-5
18. Em um processo de recuperação de cobre ouro, tenha-se eletrolisado uma solução de sulfato de cobre
(II), durante 3h, empregou-se uma corrente elétrica de intensidade igual a 10A. Calcule a massa
aproximada de cobre puro recuperado. Dados: Constante de Faraday = 96500C/mol; massa molar do Cu =
63,5 .
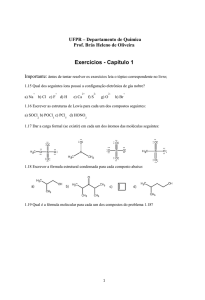
19. Informe a fórmula molecular dos ácidos:
(
) Ácido cloroso
(
) Ácido fosfórico
(
) Ácido sulforoso
(
) Ácido clórico
(
) Ácido nitroso
20. “O oxigênio eficaz do ar atmosférico,
O calor e o carbono e o amplo éter não
Valem três vezes menos que este Américo
Augusto dos Anzóis Sousa Falcão...”
Perfis Chaleiras – Augusto dos Anjos (1884-1914)
Escreva o nome de cada uma das moléculas indicadas abaixo e indique com um X qual a qual delas Augusto
dos Anjos poderia estar se referindo em seu poema.
( ) CH2CH2CH3 - nome:
( ) CH3COCH3 - nome:
( ) CH3COOCH3 - nome:
( ) CH3CH2OCH3 - nome:
( ) CH3CH2CHO - nome:
3