UFPR – Departamento de Química
Prof. Brás Heleno de Oliveira
Exercícios - Capítulo 1
Importante: antes de tentar resolver os exercícios leia o tópico correspondente no livro;
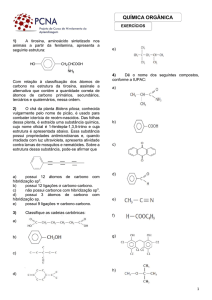
1.15 Qual dos seguintes íons possui a configuração eletrônica de gás nobre?
+
a) Na
+
b) Cl c) F
2+
d) H
2-
e) Ca
f) S
2-
g) O
+
h) Br
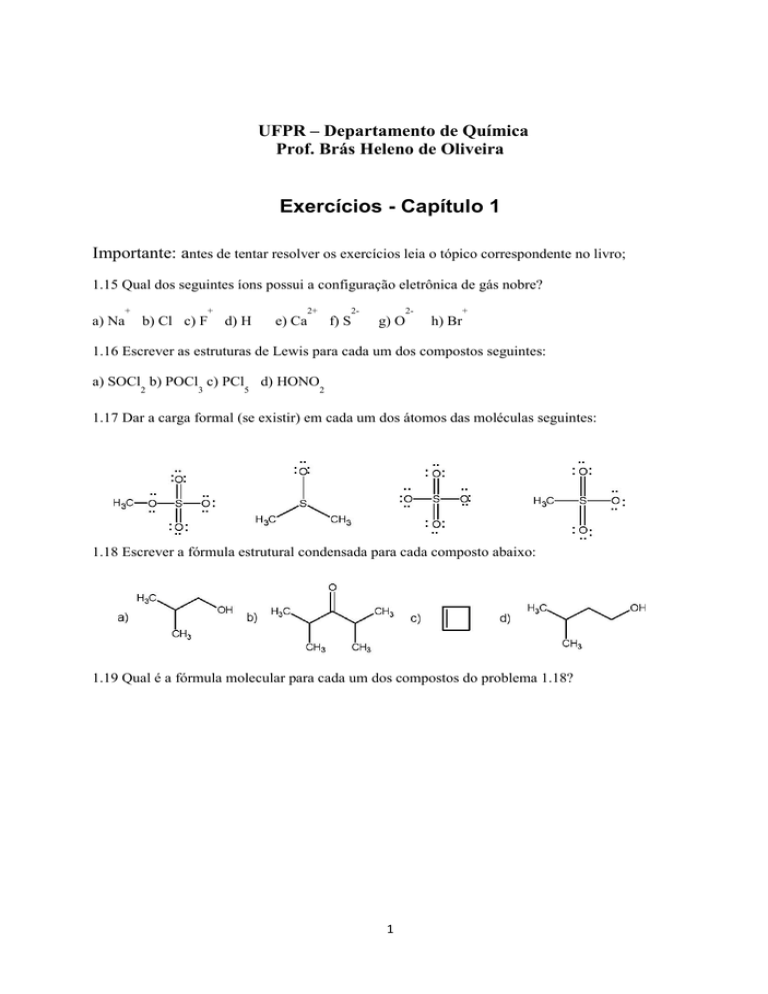
1.16 Escrever as estruturas de Lewis para cada um dos compostos seguintes:
a) SOCl b) POCl c) PCl
2
3
5
d) HONO
2
1.17 Dar a carga formal (se existir) em cada um dos átomos das moléculas seguintes:
1.18 Escrever a fórmula estrutural condensada para cada composto abaixo:
1.19 Qual é a fórmula molecular para cada um dos compostos do problema 1.18?
1
1.20 Considere cada par de fórmulas estruturais abaixo e determine se as duas fórmulas representam o
mesmo composto, se representam compostos diferentes, mas que são isômeros constitucionais um do
outro, ou se representam compostos diferentes que não são isômeros.
1.21 Reescrever cada uma das seguintes fórmulas, usando as fórmulas de linha de ligação:
2
1.22 Escrever uma fórmula de traço para cada uma das seguintes moléculas, mostrando quaisquer
pares de elétrons não-compartilhados.
1.23 Escrever fórmulas estruturais de sua escolha, para todos os isômeros constitucionais de fórmula
molecular C H .
4
8
1.24 Escrever fórmulas estruturais para pelo menos três isômeros constitucionais com a fórmula
molecular CH NO . (Atribuir carga formal a qualquer átomo que a possuir).
3
2
1.26 Considere uma espécie química (seja uma molécula ou um íon) na qual um átomo de carbono
forma três ligações simples com três átomos de hidrogênio, e na qual o átomo de carbono não possui
qualquer um dos elétrons de valência. (a) Qual é a carga formal do átomo de carbono? (b) Qual é a
carga total da espécie? (c) Qual seria a geometria esperada dessa espécie? (d) Qual seria o estado de
hibridização do átomo de carbono?
1.27 Considere uma espécie química como no problema anterior onde o átomo de carbono forma três
ligações simples com três átomos de hidrogênio, mas na qual o átomo de carbono possui um par de
elétrons não-compartilhados. (a) Qual é a carga formal do átomo de carbono? (b) Qual é a carga total
da espécie? (c) Qual seria a forma esperada dessa espécie? (d) Qual seria o estado de hibridização do
átomo de carbono?
1.28 Considere uma espécie química como no problema anterior onde o átomo de carbono forma três
ligações simples com três átomos de hidrogênio, mas na qual o átomo de carbono possui um elétron
não emparelhado. (a) Qual é a carga formal do átomo de carbono? (b) Qual é a carga total da espécie?
(c) Qual seria a forma esperada dessa espécie? (d) Qual seria o estado de hibridização do átomo de
carbono?
-
1.30 Escrever estruturas de ressonância para o íon azida, N . Explicar como estas estruturas de
3
ressonância justificam o fato de que ambas as ligações deste íon têm o mesmo comprimento.
1.31 Escrever fórmulas estruturais do tipo indicado:
(a) Fórmulas de linha de ligação para sete isômeros constitucionais com a fórmula C H O.
4
10
(b) Fórmulas estruturais condensadas para dois isômeros constitucionais com a fórmula C H N.
2
7
(c) Fórmulas estruturais condensadas para quatro isômeros constitucionais com a fórmula C H N.
3
(d) Fórmulas de linhas de ligação para três isômeros constitucionais com a fórmula C H .
5
3
12
9
1.32 Qual é a relação entre os membros dos seguintes pares de estruturas? Isto é, são isômeros
constitucionais, são idênticos ou são compostos diferentes?
1.34 Dados os conjuntos de átomos abaixo, escreva fórmulas de linha de ligação para todos os
componentes isoméricos constitucionalmente ou íons possíveis, que pudessem ser feitos a partir dos
mesmos. Mostras todos os pares de elétrons não-compartilhados e todas as cargas formais, se houver.
Conjunto
A
B
C
D
E
Átomos de C
3
3
3
2
3
Átomos de H
6
9
4
7
7
4
Outros
2 Br
1 N + 1 O (não no mesmo C)
1O
1 N + 1 próton
1 elétron extra