Sumário 3 - Átomos
Modelo Quântico do Átomo ‐ Átomo de Hidrogénio Números Quânticos: n, l, ml, ms Energias das Orbitais Funções de Onda (Orbitais):Representação das Funções de Onda Funções de Distribuição Radial. Funções de Densidade de Probabilidade. Contornos de Isoprobabilidade. Átomos Polielectrónicos; Configuração Electrónica Aproximação do Campo Central Regras de Preenchimento das Orbitais Princípio da Energia Mínima Princípio de Exclusão de Pauli Regra de Hund Regra de Wiswesser Configuração Electrónica e Tabela Periódica Modelo Quântico do Átomo ‐ Átomo de Hidrogénio FUNÇÕES DE ONDA ψ ( x, y, z) =ψ (r ,θ ,ϕ ) = R(r )×Θ(θ ,ϕ ) NÚMEROS QUÂNTICOS: n, l, ml, ms n = 1, 2, 3, … l = 0, 1, 2, …, n‐1 ml = ‐l, …, l ms= ‐1/2, 1/2 Números Funções próprias (orbitais) quânticos n l ml Ψ100 = 1
⎛Z⎞
⎜
⎟
⎜ a0 ⎟
⎝
⎠
3/ 2
0 0 2 0 0 ⎛
⎞
Ψ 200 = 1 ⎜ Z ⎟
4 2π ⎜⎝ a0 ⎟⎠
⎛
⎞
Ψ 210 = 1 ⎜⎜ aZ ⎟⎟
4 2π ⎝ 0 ⎠
2 1 0 2 1 1 π
Ψ 21±1 = 1
8 π
En = -
⎛Z⎞
⎜
⎟
⎜ a0 ⎟
⎝
⎠
)
(
exp − Zr / a0 1 3/ 2
3/ 2
3/ 2
μ e4
Z2
8 ε0 h2 n2
⎛ 2 − Zr ⎞
⎜
⎟ exp
⎜ a0 ⎟
⎝
⎠
⎛
⎜
⎜
⎝
⎛
⎜
⎜
⎝
( − Zr / 2a0 ) Zr ⎞⎟ exp − Zr / 2a cosθ 0
a0 ⎟⎠
)
(
Zr ⎞⎟ exp − Zr / 2a senθ exp(± iϕ )
0
a0 ⎟⎠
(
)
(n = 1, 2, 3, ...)
Funções de Distribuição Radial Orbitais s
Função de onda radial R(r)
1s
2s
3s
0.3
0.5
1.4
1.2
0.25
0.4
1
0.2
0.6
0.4
R(r)
0.15
R(r)
R(r) R(r)
0.3
0.8
0.2
0.1
0.1
0.2
0.05
0
0
0
0
0
0.6
1.2
1.8
2.4
3
1.6
3.2
4.8
6.4
0.0
-0.1
2.5
5.0
7.5
10.0
12.5
-0.05
r/A
r/A
r/A
r
Densidade de Probabilidade 4πr2R(r)2
Probabilidade de encontrar o electrão do átomo de Hidrogénio em
função da distância ao núcleo
0.08
0.03
0.07
0.016
0.014
0.025
0.012
0.02
0.04
0.03
0.01
r2R(r)2
r2R2
0.05
r2R2
r2 R(r)2 0.06
0.015
0.008
0.006
0.01
0.02
0.004
0.005
0.01
0
0.002
0
0
0
0.6
1.2
1.8
r/A
2.4
3
0
0.8 1.6 2.4 3.2
4
4.8 5.6 6.4
r/A
r
Contorno de isoprobabilidade 0
2.5
5
7.5
r/A
10
12.5
15
15.0
Orbitais p
Função de onda radial R(r)
3p
0.18
0.07
0.16
0.06
0.14
0.05
0.12
0.04
0.03
0.1
R(r)
R(r) R(r)
2p
0.08
0.02
0.01
0.06
0
0.04
-0.01
0.02
-0.02
0
-0.03
0
1.6
3.2
4.8
6.4
8
0.0
2.5
5.0
7.5
r/A
10.0
12.5
15.0
r/A
Probabilidade de encontrar o electrão do átomo de Hidrogénio em
função da distância ao núcleo 4πr2R(r)2
0.025
0.09
0.08
0.02
r2 R(r)2 0.07
r2R(r)2
r2R2
0.06
0.05
0.04
0.015
0.01
0.03
0.02
0.005
0.01
0
0
0
0.8 1.6 2.4 3.2
4
4.8 5.6 6.4 7.2
8
0
2.5
5
7.5
r/A
r/A
Contorno de isoprobabilidade
10
12.5
15
Orbitais d dxy dyz dzy dz2 dx2‐y2 0.06
0.05
0.04
0.03
0.02
0.01
0
0
5
10
15
20
Probabilidade radial, r2R(r)2, das orbitais 3s, 3p e 3d Átomos Polielectrónicos APROXIMAÇÃO DO CAMPO CENTRAL F2,1
r1,2
F1,2
r1
F2
F1
r2
Forças em jogo num átomo com 2 electrões NÚMERO ATÓMICO EFECTIVO Zef Zef = Z ‐ S Electrão
Núcleo de carga Z‐S
Zef é igual ao número atómico real Z subtraído de um número S de protões do núcleo cujo efeito atractivo é cancelado pela repulsão dos restantes electrões. CÁLCULO DE S REGRAS DE SLATER 1‐ Ordenar as orbitais atómicas em grupos de Slater: (1s) (2s, 2p) (3s, 3p) (3d) (4s, 4p) (4d) (5s, 5p) (5d) (5f), etc. 2‐ S é igual á soma das seguintes contribuições: 2.1 ‐ Electrões em grupos exteriores àquele para que estamos a calcular a blindagem não contribuem para a blindagem. 2.2 ‐ Electrões pertencentes ao grupo daquele que estamos a considerar contribuem com 0,35. Excepção: se o electrão pertencer ao grupo 1s então a contribuição é 0,30. 2.3 ‐ Se o electrão em causa for um electrão s ou p então os electrões com número quântico principal uma unidade inferior contribuem com 0,85 e os restantes interiores com 1,00. 2.4 ‐ Se o electrão em causa for um electrão d ou f, então os electrões de todos os grupos interiores contribuem com 1,00. 2
Zef
4
μ
e
En = 8 ε 0 h 2 n2
(n = 1, 2, 3, ...)
2
2 En é proporcional a – Zef /n
ENERGIA DAS ORBITAIS ATÓMICAS EM FUNÇÃO DO NÚMERO ATÓMICO Z −E
Z
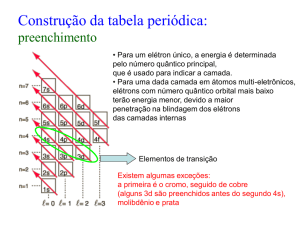
No eixo das ordenadas está representada a raiz quadrada do simétrico da energia da orbital em Rydbergs (1 Rydberg = 13,6 eV). REGRAS DE PREENCHIMENTO DE ORBITAIS 1. Princípio da Energia Mínima 2. Princípio de Exclusão de Pauli 3. Regra de Hund 4. Regra de Wiswesser (regra do n+l) l
0
1
2
3
4
5
6
7
7s
7p
7d
7f
7g
7h
7i
6
6s
6p
6d
6f
6g
6h
5
5s
5p
5d
5f
5g
4
4s
n
3
2
1
4d
4f n+l =7
n+l =6
3s 3p
3dn+l =5
n+l =4
2s 2p
n+l =3
n+l =2
1s 2s 2p 3s 3p 4s 3d 4p 5s
1s
n+l =1
4p
4d 5p 6s 4f 5d 6p 7s ....
TABELA PERIÓDICA E CONFIGURAÇÃO ELECTRÓNICA Número Atómico
Peso Atómico
Ponto de Ebulição/K
Estados de Oxidação
65.38
30
Ponto de Fusão/K
2
1180
692.73
Zn
7 14
Massa Volúmica a 300 K
3
(g/cm )
Símbolo
10
2
[Ar]3d 4s
Zinc
Nome
Configuração
Electrónica
Sumário 4 – Propriedades Periódicas (Átomos) Energia de Ionização Factores Condicionantes da Energia de Ionização ‐ Número Atómico Efectivo, Zef; Regras de Slater ‐ Número Quântico Principal ‐ Número Quântico Azimutal (Tipo de Orbital) ‐ Grau de Preenchimento ‐Variação na Tabela Periódica Electroafinidade ‐ Factores Condicionantes e Variação na Tabela Periódica Electronegatividade Propriedades Periódicas e Tipos de Ligação Química ENERGIA DE IONIZAÇÃO E
i → X + ( g ) + 1e −
X ( g) ⎯⎯⎯⎯
A energia de ionização é igual ao simétrico da energia da orbital, logo: Ei é proporcional a Zef2/n2 Números Atómicos Efectivos, Zef, dos electrões ns ou np dos elementos representativos calculados pelas regras de Slater. 1
H
1.00
3
Li
1.30
Be
1.95
5
6
7
8
9
B
C
N
O
F
2.60 3.25 3.90 4.55 5.20
10
11
Na
2.20
12
13
18
19
K
2.20
20
37
Rb
2.20
38
Sr
2.85
55
Cs
2.20
56
87
88
Fr
2.20
2
He
1.70
4
Al 14Si 15P 16S 17Cl
3.50 4.15 4.80 5.45 6.10
Mg
2.85
31
Ca
2.85
Ba
2.85
Bloco
d
Ne
5.85
Ar
6.75
Ga 32Ge 33As 34Se 35Br
5.00 5.65 6.30 6.95 7.60
36
49
In 50Sn 51Sb 52Te 53I
5.00 5.65 6.30 6.95 7.60
54
81
86
Tl 82Pb 83Bi 84Po 85At
5.00 5.65 6.30 6.95 7.60
Kr
8.25
Xe
8.25
Ra
2.85
Zef aumenta de 0.65 ao longo do período Rn
8.25
Números Atómicos Efectivos, Zef, dos electrões ns dos elementos de transição calculados pelas regras de Slater. 21
Sc
22
Ti
23
V
24
Cr
25
Mn
26
Fe
27
Co
28
Ni
29
Cu
30
Zn
3.00 3.15 3.30 3.45 3.60 3.75 3.90 4.05 4.20 4.35
39
Y
40
Zr
41
Nb
42
Mo
43
Tc
44
Ru
45
Rh
46
Pd
47
Ag
48
Cd
3.00 3.15 3.30 3.45 3.60 3.75 3.90 4.05 4.20 4.35
57
La
72
Hf
73
Ta
74
W
75
Re
76
Os
77
Ir
78
Pt
79
Au
80
Hg
3.00 3.15 3.30 3.45 3.60 3.75 3.90 4.05 4.20 4.35
Zef aumenta de 0.15 ao longo do período Energia de ionização depende de: Zef n Tipo de orbital (l) Grau de ocupação da orbital
He Ne Ar
Kr
Li Na K Rb
Xe
Cs
Rn ELECTRO
OAFINIDADEE X + 1e− ⎯⎯⎯
⎯ →X−+E
a
A ele
ectroafiinidade
e de um
m átom
mo é igual i
à prime
eira energgia de io
onizaçãão do re
espectivvo anião
o. Depe
ende do
os messmos factoress (Zef, n, l e e grau de ocupaação) m
mas refe
eridos aao anião
o. F Cl
Br
I
At ELECTRONEGATIVIDADE Mulliken Ei ( A) + Ea ( A)
χA∝
2
Pauling (1932) ‐ Fixa χ(F) = 4 e determina χ para os outros elementos com base nas energias de ligação (ver 4,5
4
3,5
3
2,5
2
1,5
1
0,5
0
2500
2000
1500
1000
500
0
-500
0
10
Z
20
Ei, kJmol-1
Ea, kJmol-1
Electronegatividade
diatómicas heteronucleares). ELEC
CTRON
NEGATTIVIDA
ADE E TTABELLA PER
RIÓDIC
CA ELECTRON
NEGATTIVIDA
ADE E LIGAÇ
ÇÃO QU
UÍMIC
CA Baixa egatividaade
Electrone
Altta Electroneggatividade
e Alta Electrronegativvidade Ligaçãão iónicaa Ligação co
ovalente
e Baixa Electrronegativvidade Ligação
o Metálicca Ligação
o iónica