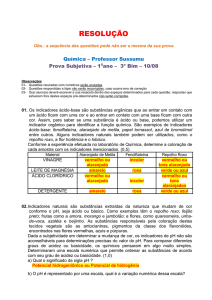
A Água e Suas Relações
Funções Inorgânicas
Ácidos, Bases e Sais
Água
Introdução:
• É constituída por 2 gases:
Hidrogênio
Oxigênio
Na proporção 2:1, ou seja 2 átomos de hidrogênio e 1 átomo de oxigênio
Sua Fórmula Química é H20
• Sinônimos:
Ácido hidroxílico
Hidróxido de hidrogênio
Óxido de hidrogênio
Monóxido de dihidrogênio
Água
Generalidades:
• É essencial para todas as formas conhecidas de vida na Terra
• Se a água é encontrada em um determinado planeta pode-se
esperar que haja vida neste planeta
• ¾ da superfície da Terra são cobertos pela água (75%)
• Equivale a 1,5 bilhões de km3 de água em todo o planeta
• Nas seguintes proporções:
97,5% de água salgada
97,5% oceanos
2,4% geleiras e calotas polares
1,6% aquíferos
2,5% de água doce
0,6% rios, lagoas e lagos
0,001% atmosfera
Estados Físico da Água no Planeta
Líquido
Sólido
Gasoso
Água
Generalidades:
• O Volume da água na Terra é de, aproximadamente,
1.360.000.000 km3, mas apenas 9% pode ser consumida pelos
seres humanos, ou seja Água Potável.
• Água Potável se caracteriza por apresentar menos de 1000
coliformes fecais e menos de 10 micro-organismo patogênico por
litro de água.
• A escassez de água potável é um Problema Muita Grave, e já
começou: 29 países já têm problema com falta de água e tende a
piorar. Até 2025, dois de três habitantes do planeta serão
afetados de alguma forma pela escassez.
• É um problema em escala mundial e que nunca houve nenhum
problema semelhante
• A falta de água da afeta o Oriente Médio, China, Índia e o Norte
da África. A ONU calcula que até 2050, 50 países sofrerão com a
crise de abastecimento de água
Água
Generalidades:
• A água se move constantemente na Terra através do Ciclo da
Água, conhecido cientificamente como o Ciclo Hidrológico,
que refere-se a troca permanente de água da hidrosfera, entre a
atmosfera, as águas do solo (superficiais e subterrâneas) e das
plantas, com mudanças permanentes do estado físico da agua
• Os processos de transferências do Ciclo Hidrológico:
Evaporação
Transpiração
Evapotranspiração
Precipitação
Escoamento
Infiltração
Absorção
Percolação: minas d´água ou nascentes
Água
Generalidades:
• Ciclo Hidrológico:
Água
Generalidades:
• Ciclo Hidrológico:
Água
Generalidades:
• Ciclo Hidrológico:
Água
Generalidades:
• Ciclo Hidrológico:
Água
Generalidades:
• Ciclo Hidrológico:
Água
Generalidades:
• Ciclo Hidrológico:
Água
Generalidades:
• Ciclo Hidrológico:
Água
Generalidades:
• Ciclo Hidrológico:
Água
Funções:
• Nos Seres Vivos
• Nas Indústrias
• Na Agricultura
• Na Geologia
Água
Funções:
• Nos Seres Vivos: 10%
Humanos: 75% composto da água
Proteção contra doenças: desidratação, cálculo renal, infecções
urinárias
Proteção contra o envelhecimento
Regula a temperatura
Diluidora dos sólidos: transporta os nutrientes e metabólitos entre os
órgãos
Determina um bom funcionamento dos órgãos: ingerida por via oral e
eliminada na filtração hídrica renal (urina) e pela transpiração dos poros
Água
Funções:
• Nas Indústrias:
Transferência de Calor:
o Refrigeradora: Torres de Resfriamento
o Aquecimento: Caldeiras
Geradora de Energia:
o Termoelétricas: vapor d`água para mover as turbinas adaptadas a
geradores
Aplicação nos Processos:
o Transportadora: transporte de materiais
o Diluidora: a maiorias das reações químicas são realizadas em
soluções
Lavagens de máquinas e equipamentos
Irrigação da áreas verdes
Sanitários
Água
Funções:
• Na Agricultura: 69%
Irrigação do solo
Utilização animal
Água
Funções:
• Nas Indústrias: 21%
Alguns exemplos de consumo de água na produção:
o 1 garrafa – 3 litros
o 1 calça Jeans – 8.000 litros
o 1 micro computador – 30.000 litros
o 1 carro – 380.000 litros
o 1 kg de trigo (produção) 500 a 4.000 litros
o 1 litro cerveja – 10 litros
o 1 kg batata – 106 litros
o 1 kg galinha – 3.500 litros
o 1 kg carne – 10.000 litros
Água
Funções:
• Na Geologia:
Mateorização (formação de rocha, solos e minerais): superfícies
Padrões das falhas geológicas: subterrâneas
Vulcões: manto
Água
Propriedades:
• Molécula Polar
• Formam “Pontes de Hidrogênio”
• Dilatação anômala
• Solvente universal
• Tensão Superficial
• Densidade maior (3,984oC)
• Estável na Atmosfera
• Incolor
• Calor Específico
Água
Propriedades:
• Molécula Polar
• Formam “Pontes de Hidrogênio”
Água
Propriedades:
• Dilatação anômala:
A água entre 0oC e 4oC se torna menos densa: congela a superfície
o Contração da moléculas: “pontes de hidrogênio”
o Diminuição do volume
V: volume
V
V min
Densidade máxima
4
T: temperatura (oC)
Água
Propriedades:
• Solvente universal
Água
Propriedades:
• Solvente universal
Água
Propriedades:
• Tensão Superficial: Maior
Água
Propriedades:
• Densidade maior (3,984oC)
Água
Propriedades:
• Densidade maior (3,984oC)
Água
Propriedades:
• Estável na Atmosfera: absorve a radiação infravermelha,
atenuando o efeito estufa
Água
Propriedades:
• Estável na Atmosfera: absorve a radiação infravermelha,
atenuando o efeito estufa
Água
Propriedades:
• Incolor: possibilita a penetração dos raios ultravioleta (luz),
que serão necessários para a fotossíntese marinha
Água
Propriedades:
• Calor Específico: é a tendência da substância de aumentar sua
temperatura ao receber uma fonte de calor: o da água é alto
Calor Específico da água é 4,18 J/goC:
para aquecer em 1oC a quantidade de 1g
de água é necessário que ela absorva
4,18J de energia
Regula a temperatura corpórea e o
clima global
Água
Propriedades:
• Calor Específico: é a tendência da substância de aumentar sua
temperatura ao receber uma fonte de calor: o da água é alto
Água
Potencial de ionização da água: na temperatura 250C
HOH
H+ + OH-
Ki = [H+] . [OH-]
[H2O]
Ki . [H2O] = [H+] . [OH-]
como [H2O] é constante, o produto Ki . [H2O] também é
constante e será chamado de Kw , o produto iônico da água
Kw = [H+] . [OH-]
Kw só varia com a temperatura
Em 1 litro de H2O a 250C temos: [H+] = [OH-] = 1,0 . 10-7 mol/L
Kw = [H+] . [OH-]
Kw = 10-7 . 10-7
Kw = 10-14
Água
Potencial de ionização da água: na temperatura 250C
Kw = [H+] . [OH-]
Kw = 10-14
10-14 = [H+] . [OH-]
log 10-14 = log [H+] + log [OH-]
- log 10-14 = (-log [H+]) + (-log [OH-])
- log = p (potencial)
14 = pH + pOH
Potencial Hidrogeniônico:
pH = -log [H+]
Potencial Hidroxiliônico
pOH = -log [OH-]
[H+] = [OH-] = 10-7 mol/L
pH = pOH = 7
meio neutro: pH = 7
meio ácido: pH < 7
meio básico: pH > 7
Água
pH das Soluções:
É o símbolo para determinar a grandeza físico-química do
Potencial Hidrogeniônico, que indica a acidez, neutralidade
ou alcalinidade de uma solução aquosa.
Água
pH das Soluções:
pH + pOH = 14
[H+] = 10-4 mol/L
[OH-] = 10-10 mol/L
pH = -log 10-4 : pH = 4
pOH = -log 10-10 : pOH = 10
Funções Inorgânicas
Ácidos
Bases
Sais
Ácidos
Definição:
São substâncias que em solução aquosa sofrem ionização,
liberando como o único cátion o H+.
Hx A
água
xH+ (aq) + Ax- (aq)
Ácidos
Grupos:
• Hidrácidos
• Oxiácidos
Ácidos
Grupos:
• Hidrácidos: ácidos sem oxigênio
HF: ácido fluorídrico
HCl: ácido clorídrico
HBr: ácido bromídrico
HI: ácido iodídrico
H2S: ácido sufídrico
HCN: ácido cianídrico
Ácidos
Grupos:
• Oxiácidos: ácidos com oxigênio
HClO3: ácido clórico
H2SO4: ácido sulfúrico
HNO3: ácido nítrico
H3PO4: ácido fosfórico
H2CO3: ácido carbônico
Ácidos
Classificação:
• Número de Hidrogênios Ionizáveis
• Grau de Ionização
• Volatilidade
Ácidos
Classificação:
• Número de Hidrogênios ionizáveis
Monoácidos: 1 H+
Diácidos: 2 H+
Triácidos: 3 H+
Tetrácidos: 4 H+
Ácidos
Classificação:
• Número de Hidrogênios ionizáveis
Hidrácidos: todos os hidrogênios presentes na molécula são ionizáveis
Oxiácidos: são ionizáveis apenas o hidrogênios ligados ao átomo de
oxigênio
H3PO4
H3PO3
O
O
H
O
P
O
H
O
H
H
O
P
H
O
H
Ácidos
Classificação:
• Grau de ionização (α): é a relação entre o número de
moléculas ionizadas e o número total de moléculas dissolvidas
α = nº de moléculas ionizadas
nº de moléculas dissolvidas
o Fortes
o Semifortes
o Fracos
Ácidos
Classificação:
• Grau de ionização (α): é a relação entre o número de
moléculas ionizadas e o número total de moléculas dissolvidas
α = nº de moléculas ionizadas
nº de moléculas dissolvidas
o Hidrácidos:
Fortes
Semifortes
Fracos
α ≥ 50%
5% < α > 50%
α ≤ 5%
HCl, HBr, HI
HF
H2S, HCN
Ácidos
Classificação:
• Grau de ionização (α):
o Oxiácidos: determina-se o x, onde:
x = nº de átomos de oxigênio - nº de átomos de hidrogênio
Fortes
Semifortes
Fracos
Valor de x
3 ou 2
1
0
Exemplos
HBrO4
H2SO4
H3PO4
HNO2
HClOH
4SiO4
Observações:
H2Co3 (ácido carbônico): é um ácido instável, logo, se decompõe mais facilmente do que se ioniza, logo, é fraco.
H3CCOOH (ácido acético): pode ser obtido a partir do álcool comum e é um ácido fraco.
Ácidos
Classificação:
• Volatilidade: se caracteriza pela facilidade com que os ácidos
passam do estado líquido para o gasoso.
o Voláteis: a grande maioria dos ácidos: HF, HCl, HCN, H2S, HNO3,
H3CCOOH, etc
o Fixos: os menos voláteis, mais comuns, são apenas 2: H2SO4 e H3PO4
Ácidos
Propriedades:
• Sabor azedo
• Líquido fumegante
• Líquido corrosivo
• Ação sobre os indicadores de pH: baixo pH
• Condutibilidade elétrica em meio aquoso
• Extremamente perigoso
• Reação com metais: determina a formação de um sal deste
metal e libera o gás hidrogênio
• Reação com os ânions carbonato e bicarbonato formando um
sal, água e libera gás carbônico:
CaCO3 (s) + 2HCL (aq)
CaCl2 (aq) + H2O (l) + CO2 (g)
NaHCO3 (s) + HCl (aq)
NaCl (aq) + H2O (l) + CO2 (g)
Ácidos
Aplicações:
• ácido fluorídrico (HF): corrói o vidro
• ácido clorídrico (HCl): suco gástrico
• ácido sulfídrico (H2S): ovo podre
• ácido cianídrico (HCN): mandioca e sol, ácido tóxico
• ácido sulfúrico (H2SO4): baterias dos automóveis
• ácido carbônico (H2CO3): presente nos refrigerantes
• ácido fosfórico (H3PO4): refrigerante a base de cola
• ácido nítrico (HNO3): fabricação de explosivos
• ácido acético (H3CCOOH): produção do vinagre
Bases ou Hidróxidos
Definição:
São substâncias que em solução aquosa sofrem ionização,
liberando como o único tipo de ânion os íons OH- (Hidroxila).
C(OH)x
água
Cx+ (aq) + x OH- (aq)
São portanto Hidróxidos de Metais (cátion):
NaOH
Ca(OH)2
Al(OH)3
água
água
água
Na+ + OHCa2+ + 2OHAl3+ + 3OH-
Nomenclatura: hidróxido de (nome do cátion)
se o cátion apresentar deferentes eletrovalência, no final do nome, o número da carga elétrica do
cátion será expressa em algarismo romano ou utilisamos o sufíxo “oso” para a menor carga e “ico”
para a maior carga
Exemplo:
Fe(OH)2: hidróxido de ferro II ou hidróxido ferroso
Fe(OH)3: hidróxido de ferro III ou hidróxido férrico
Bases ou Hidróxidos
Classificação:
• Número de Hidroxila
• Solubilidade em água
• Grau de Dissociação
Bases ou Hidróxidos
Classificação:
• Número de Hidroxila: os grupos de hidroxilas liberadas por
fórmulas
Monobases
Dibases
Tribases
Tetrabases
Nº de OH- na fórmula
1 OH-
2 OH-
3 OH-
4 OH-
Exemplos
NaOH
Mg(OH)2
Al(OH)3
Pb(OH)4
NaOH
Mg(OH)2
Al(OH)3
Pb(OH)4
água
água
água
água
Na+ + OHMg2+ + 2OHAl3+ + 3OH-
Pb+4 + 4 OH-
Bases ou Hidróxidos
Classificação:
• Solubilidade em água: se caracteriza pela quantidade em
gramas da base que se dissolve em 1 litro de água, a 200C
Solubilidade (em gramas) de base / litro de água (a 200C)
CsOH
3.857
Ca(OH)2
1,65
KOH
1.120
Mg(OH)2
0,009
NaOH
1.090
Al(OH)3
0,008
Ba(OH)2
38,9
Fe(OH)2
0,001
Sr(OH)2
3,9
Fe(OH)3
0,0000001
Solubilidade (em gramas) de base / litro de água (a 200C)
Metais Alcalinos
Metais
Alcalinos Terrosos
Outros Metais
Solúveis
Pouco Solúveis
Praticamente
Insolúveis
Bases ou Hidróxidos
Classificação:
• Grau de Dissociação: está relacionada com a solubilidade das
bases, quanto maior a solubilidade maior será sua força de
dissociação, logo será considerada uma Base Forte. Logo, se
uma base for pouco solúvel apresentará uma força de
dissociação menor, portanto, será uma Base Fraca
Características das Bases
Base Solúvel
Elevado Grau de Dissociação
Base Insolúvel Baixo Grau de Dissociação
Base Forte
LiOH, NaOH, KOH, RbOH, CsOH,
Ca(OH)2, Sr(OH)2, Ba(OH)2
Base Fraca
NH4OH e as bases dos demais metais
Bases ou Hidróxidos
Propriedades:
• Sabor adstringente, que “amarra” a boca
• Líquido extremamente perigoso
• Ação sobre os indicadores de pH: alto pH
• Reações com ácidos: ocorrerá a neutralização pela formação
de água e a formação de um sal (salificação)
Bases ou Hidróxidos
Aplicações:
• hidróxido de sódio (NaOH): produção de sabão
• hidróxido de magnésio (Mg(OH)2): antiácido gástrico
• hidróxido de cálcio (Ca(OH)2: a cal utilizada nas pinturas e
na argamassa
• hidróxido de amônio NH4OH: nos fertilizantes agrícolas e
produtos de limpeza
Sais Minerais
Definição:
São substâncias que em solução aquosa sofrem dissociação,
produzindo pelo menos um cátion diferente do H+ pelo menos
um ânion diferente do OHNa+Cl-
(s)
Ag+NO3- (s)
Na+HCO3- (s)
água
água
água
Na+(aq) + Cl-(aq)
Ag+(aq) + NO-3 (aq)
Na+(aq) + HCO-3 (aq)
Sais Minerais
Definição:
Ânions
acetato: H3CCOO-
bicarbonato: HCO3-
bissulfato: HSO4-
brometo: Br-
carbonato: CO32-
cianeto: CN-
cloreto: Cl-
fluoreto: F-
fosfato: PO43-
hipoclorito: ClO-
iodeto: I-
nitrato: NO3-
nitrito: NO2-
permanganato: MnO4- pirofosfato: P2O74-
sulfato: SO42-
sulfeto: S2-
sulfito: SO32-
Cátions
+1
Li+, Na+, K+, Ag+, NH4+, Cu+
+2
Mg2+, Ca2+, Ba2+, Zn2+,Cu2+, Fe2+
+3
Al3+, Fe3+
Sais Minerais
Classificação:
• Natureza dos Íons
• Solubilidade em água
Sais Minerais
Classificação:
• Natureza dos Íons
o Sal Normal: o ânion não possui hidrogênio ionizável (H-) e também
não apresenta o ânion OH-:
NaCl, BaSO4, Al2(SO4)
o Hidrogenossais: apresentam 2 cátions, dos quais um deles é
obrigatoriamente o H+ (hidrogênio ionizável) e um ânion:
NaHCO3
o Hidroxissal ou Sal Básico: sal que apresenta 2 ânions, dos quais um
deles é o OH- (hidroxila) e somente um cátion
Ca2+(OH)Cl- = Ca2OHCl
o Sal Duplo ou Misto: sal que apresenta 2 cátions diferentes (exceto o
H+) ou 2 ânions diferentes (exceto o OH-)
Na+Li+SO42- = NaLiSO4 ou Ca2+Cl-ClO- = Ca(Cl)ClO
o Sal Hidratado: apresenta, no retículo cristalino, moléculas de água em
proporção definida (água de cristalização) e indicada na fórmula
CuSO4 ∙ 5H2O = sulfato de cobre II penta hidratado
Sais Minerais
Classificação:
• Solubilidade em água: na prática, é o critério mais importante
de classificar os sais
Solubilidade das substâncias em água (a 250C e 1 atm)
Solúveis
(como regra)
nitratos (NO3-)
acetatos (H3CCOO-)
Insolúveis
(principais exceções)
Insolúveis
(como regra)
-
(S2-)
sulfetos
Solúveis
(principais exceções)
metais alcalinos,
alcalinos terrosos, e
amônio
cloretos (Cl-)
brometos (Br-)
iodetos (I-)
Ag+, Pb2+, Hg22+
carbonato ( CO32-)
metais alcalinos e
amônio
sulfatos (SO42-)
Ca2+, Sr2+, Ba2+, Pb2+
nitrato: NO3-
metais alcalinos e
amônio
Sais Minerais
Obtenção:
• Reação de Neutralização: quando um ácido reage com uma
base produzido o sal.
o Neutralização Total: sal normal
o Neutralização Parcial:
Neutralização Parcial do Ácido: sal ácido
H3PO4 + 2NaOH NaH2PO4 + H2O
Neutralização Parcial da Base: sal básico
HCL + Mg(OH)2 Mg(OH)Cl + H2O
Sais Minerais
Características:
• Sabor salgado
• Sólidos: compostos iônicos
• Maior solubilidade: maior condutibilidade elétrica
• Várias cores
Sais Minerais
Aplicações:
• cloreto de sódio (NaCl): bócio
• nitrato de sódio (NaNO3): fertilizante e pólvora
• carbonato de cálcio (CaCO3): calcário, mármore, corais e
conchas
• carbonato da sódio (Na2CO3): produção de vidro
• bicarbonato de sódio (NaHCO3): antiácidos, fermentos
químicos e extintor de incêndio
• sulfato de cálcio (CaSO4): gesso e giz
• fosfato de cálcio (Ca3(PO4)2): nos ossos
• hipoclorito de sódio (NaClO): água sanitária
• sulfato de alumínio (Al2(SO4)3): tratamento da água que em
meio básico determina floculação
Solução Tampão
Definição:
É a solução capaz de manter o seu pH constante
mesmo que seja adicionado pequenas quantidades de
ácidos e de bases mesmo que sejam ácidos e bases
fortes.
Solução Tampão
Constituição:
• Solução Tampão Ácida:
o Ácido Fraco e o Sal Derivado
CH3COOH + CH3COONa
ácido acético e acetato de sódio
•
Solução Tampão Alcalina:
o Base Fraca e o Sal Derivado
NH4OH + NH4Cl
hidróxido de amônia e cloreto de amônia
Solução Tampão
Constituição:
• Solução Tampão Ácida:
o Ácido Fraco e o Sal Derivado
CH3COOH + CH3COONa
ácido acético e acetato de sódio
CH3COOH
H3CCOO- + H+
CH3COONa
H3CCOO- + Na+
Água
pH das Soluções:
Exercício: Em uma solução a concentração molar de íons OH- é
de 1,0 . 10-9 mol/L. Qual será o seu pH em 250C e o caráter do
meio desta solução?