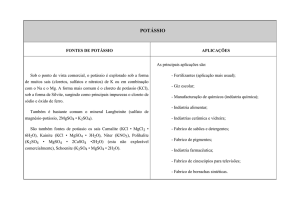
QUÍMICA
Prof. Daniel Pires
SAIS
1. Escreva as fórmulas químicas e os respectivos nomes de quatro sais diferentes formados por cátions de
metais alcalino-terrosos e ânions contendo enxofre e oxigênio.
2. São considerados sais terciários:
a) NaCØ e NaHS.
b) CaO e H‚SO„.
d) Ni(OH)ƒ e FePO„.
e) H‚SO„ e Ni(OH)ƒ.
c) NaHS e Na‚COƒ.
3. Comparar cloreto de potássio e cloreto de hidrogênio quanto:
a) ao tipo de ligação de cada composto puro;
b) à dissolução de cada um desses compostos em água;
c) à função inorgânica a que pertence cada composto.
4. Escreva:
a) as fórmulas químicas dos compostos hidrogenocarbonato de sódio e sulfato de ferro (III);
b) os nomes dos compostos químicos de fórmulas NH„NO‚ e PbI‚.
5. Quando se reagem 1 mol de hidróxido de potássio com 1 mol de ácido fosfórico e 1 mol da mesma base
com 1 mol de ácido sulfúrico obtém-se?
6. Molibdato de amônio é usado como fonte de molibdênio para o crescimento das plantas. Sabendo que
este elemento, de símbolo Mo, pertence a mesma família do crômio, Cr, e que a fórmula do íon cromato
é (CrO„)£­, a fórmula do molibdato de amônio é:
a) NH‚MoO‚
b) NHƒMoOƒ
c) (NHƒ)‚MoO„
d) NH„MoO„
7. Os ânions CØOƒ­, HPOƒ£­, MnO„­ e S‚Oƒ£­ são respectivamente, denominados:
a) clorato, fosfito, permanganato e tiossulfato.
b) perclorato, fosfito, manganato e tiossulfato.
c) perclorato, pirofosfato, permanganato e persulfato.
d) hipoclorito, fosfito, manganato, tiossulfato.
e) clorato, pirofosfato, permanganato e persulfato.
1
e) (NH„)‚MoO„
8. Os sais hidrogenocarbonato de potássio, ortofosfato de cálcio, cianeto de ouro (I) e sulfeto de sódio
podem ser usados em banhos para douração. Escrever as fórmulas desses compostos.
9. A figura a seguir mostra as substâncias existentes nas caixas e nos chamados "palitos de fósforo" e, de
acordo com ela, constatamos que o fósforo é uma substância pertencente às caixas e não aos palitos.
Assim, as substâncias existentes nos palitos são K‚Cr‚O‡, Sb‚Sƒ e outras. À substância K‚Cr‚O‡ e aos
elementos Sb e S, chamamos, respectivamente:
a) dicromato de sódio, antimônio e potássio.
b) permanganato de potássio, chumbo e sódio.
c) dicromato de potássio, chumbo e enxofre.
d) permanganato de potássio, antimônio e enxôfre.
e) dicromato de potássio, antimônio e enxofre.
10. Os solos muito ácidos são, em geral, impróprios para o cultivo de vegetais. A correção do pH do solo
poderia ser realizada pelos agricultores, através da adição, ao solo, de:
a) NH„NOƒ
b) KCØ
c) BaCØ‚
d) CaCOƒ
e) (NH„)‚SO„
11. O ácido clórico é um ácido forte, utilizado como catalisador em reações de polimerização e como agente
oxidante. Soluções aquosas desse ácido pode causar grande irritação na pele e nas mucosas.
a) Represente a fórmula estrutural do ácido clórico.
b) Qual o nome do sal formado pela reação de neutralização do ácido clórico pelo hidróxido de alumínio?
12. Determinados tipos de fermentos químicos, quando umedecidos, liberam gás carbônico pela reação:
2NaHCOƒ + Ca(H‚PO„)‚ ë Na‚HPO„ + CaHPO„ + 2CO‚ + 2H‚O
Os componentes desses fermentos são classificados como
a) sais ácidos
b) sais básicos
d) hidrácidos
e) bases inorgânicas
c) oxiácidos
2
13. Reações de deslocamento ou simples troca são aquelas em que uma substância simples de um
elemento mais reativo desloca outro de uma substância composta. Um exemplo de reação de
deslocamento, em que o cálcio desloca o hidrogênio, é apresentado a seguir:
Ca(s) + 2 HNOƒ(aq) ë Ca(NOƒ)‚(aq) + H‚(g)
a) Qual o nome do sal formado nessa reação?
b) Por analogia, apresente a equação da reação em que o alumínio desloca o hidrogênio do ácido clorídrico.
14. O elemento químico fósforo é absorvido pelas plantas sob a forma de sais, tais como NaH‚PO„ e
Na‚HPO„. A absorção desses sais é mais eficiente quando o pH do solo está entre 5 e 8.
Com o auxílio dessas informações, julgue os itens adiante.
(1) O nome do sal Na‚HPO„ é monohidrogenofosfato de sódio.
(2) O nome do sal Na‚HPO„ pode ser obtido pela seguinte reação:HƒPO„ + NaOH ë NaH‚PO„ + H‚O.
(3) Se a concentração de íons H® no solo for igual a 1,0 × 10-£mol/L, a absorção dos íons fósforo ocorrerá
com a máxima eficiência.
(4) Se o pH diminuir, o equilíbrio de ionização do ácido fosfórico: HƒPO„ Ï H® + H‚PO„­, será deslocado
para a direita.
15. O "fermento químico" utilizado na confecção de bolos é uma mistura de di-hidrogenofosfato de cálcio e
bicarbonato de sódio sólidos, que sofrem dissociação iônica quando em contato com a água utilizada na
preparação da massa. O bolo cresce devido à expansão de gás carbônico que se origina da reação
entre os ânions resultantes da dissociação dos sais acima referidos, juntamente com o íon
hidrogenofosfato e água.
Escreva a equação química correspondente ao processo de formação de gás carbônico.
RESPOSTAS:
1-CaSO„ ë sulfato de cálcio
MgSOƒ ë sulfito de magnésio
SrSO„ ë sulfato de estrôncio
BaS‚Oƒ ë tiossulfato de bário.
2-C
3-a) KCØ(s): ligação iônica
HCØ(g): ligação covalente
b) Para o KCØ(s): dissociação iônica
Para o HCØ: ionização
c) KCØ: sal
HCØ: ácido
3
4-a) Hidrogenocarbonato de sódio : NaHCOƒ
Sulfato de ferro III: Fe‚(SO„)ƒ
b) Nitrato de amônio: NH„NOƒ
Iodeto de chumbo II: PbI‚
5-KH‚PO„ e KHSO„
6-E
7-A
8-KHCOƒ , Caƒ(PO„) , AuCN e Na‚S
9-E
10-D
11-
12-A
13-a) nitrato de cálcio
14-V V F F
b) 2 AØ + 6 HCØ ë 2 AØC؃ + 3 H‚
15-H‚PO­„(aq) + HCO­ƒ(aq) ëH‚O(Ø) + CO‚(g) + HPO­£„(aq)
4