Professora Sonia
Íons complexos
Nos séculos XVIII e XIX foram preparados vários compostos contendo átomos metálicos, cuja
estrutura e ligação não puderam ser descritas satisfatoriamente pelas teorias então correntes.
Esses compostos, embora muitas vezes iônicos, eram muitos mais complexos do que os sais
inorgânicos simples e por isso eram chamados de íons complexos. Desde então, foram preparados
muitos compostos deste gênero e verificou-se que apresentam carga elétrica (positiva ou negativa),
ou são eletricamente neutros. Por outro lado, muitos compostos anteriormente considerados
“simples” pertencem realmente à classe dos complexos (compostos). A primeira teoria sobre
ligações nos complexos, de alguma utilidade foi proposta por Alfred Werner em 1898; por isso,
esses compostos são eventualmente chamados de complexos de Werner. Uma das teorias
desenvolvidas no estudo desses compostos utilizou a formação da ligação covalente de
coordenação; daí a denominação ainda em uso, de compostos de coordenação.
Chamaremos os compostos dessa classe de compostos complexos (ou simplesmente complexos).
A definição de complexo que adotaremos diz que um complexo é todo e qualquer composto
contendo átomos metálicos, formado por mais de um átomo.
Essa definição satisfará o químico inorgânico que gostaria de incluir, na classe dos compostos
complexos, substâncias como o íon permanganato (MnO4-), o óxido de ferro sólido (Fe3O4), o
acetato de cobre hidratado (CuO2CCH3.2H2O) e os íons alumínio hidratado (Al3+(aq)). Seriam
excluídos os compostos usualmente classificados como substâncias orgânicas, como o benzeno
(C6H6) e o açúcar (C12H22O11).
Compostos como o hexafluoreto de enxofre (SF6) e sais simples como o cloreto de sódio, que
podem ser descritos como ligados de maneira covalente ou iônica, não serão considerados
complexos. Em nossa discussão, trataremos exclusivamente de complexos de metais de transição
pelo fato de apresentarem variedade química maior do que a dos metais representativos.
Um dos exemplos mais simples de complexo é o íon crômico hidratado, Cr3+(aq). Visto que o íon
metálico apresenta uma carga altamente positiva e um raio iônico pequeno, é de esperar uma
grande interação com o dipolo permanente da molécula de água. Verificou-se experimentalmente
que seis moléculas de água estão firmemente ligadas ao íon metálico (podem existir muitas outras
interações de moléculas de água com o íon, mas suas intensidades são muito fracas), donde o
nome: íon crômico hexahidratado (III). O arranjo geométrico das moléculas de água pode ser
ilustrado de duas maneiras equivalentes: colocando o átomo metálico no centro de um octaedro
com as moléculas de água nos seis vértices (figura 1) ou colocando o átomo de metal no centro de
um cubo com as moléculas de água no centro de um cubo com as moléculas de água no centro de
cada face do cubo (figura 2).
www.quimicaparaovestibular.com.br
[email protected]
1
Professora Sonia
Cada molécula de água conserva, aproximadamente, os mesmos ângulos de ligação, as mesmas
distâncias, etc., existentes na molécula gasosa, mas ela se orienta de modo a apresentar o átomo
de oxigênio mais próximo do átomo do metal. Outros cátions aquosos não foram investigados tão
intensivamente, mas é provável que a maioria dos íons dos metais de transição existam em
solução aquosa sob a forma de íons hexahidratados [M(H2O)6]z+.
A figura 2 sugere uma representação mais conveniente de simetria octaédrica. Usaremos muitas
vezes essa representação em nossa discussão dos complexos octaédricos.
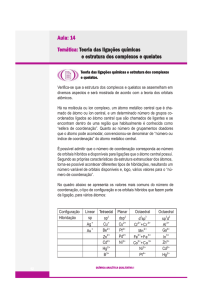
Para os complexos de número de coordenação quatro, podemos admitir dois tipos de simetria
regular: tetraédrica (figura 3) e quadrada plana (figura 4).
Nos exemplos dados anteriormente, vários grupos estão ligados ao átomo metálico central do
metal; os grupos ligados ao átomo metálico central se chamam ligantes . Em alguns complexos
podemos ter mais de um tipo de ligante ligados ao átomo metálico central; por exemplo, íon
cobalto-cloropentamina (III), que aparece na figura 5 a seguir.
Propriedades dos compostos complexos
I. Estabilidade
Alguns complexos são mais estáveis, enquanto outros se decompõem facilmente. Um complexo
azul-escuro de cobre, a ftalocianina, é tão resistente ao ataque e a decomposição por agentes
como ar, água, luz solar, ácidos, calor, etc., que é usado como pigmento em tintas para
automóveis e na fabricação de CD-R (Cd’s graváveis). O complexo cobre-tetramina (II) se
decompõe rapidamente por aquecimento, em solução aquosa, produzindo amônia e óxido cúprico.
www.quimicaparaovestibular.com.br
[email protected]
2
Professora Sonia
II. Reatividade
Outra propriedade dos complexos é sua velocidade de reação; alguns se ajustam rapidamente às
mudanças do meio, enquanto outros o fazem mais lentamente.
Os primeiros são chamados lábeis e os outros, inertes. Alguns complexos instáveis em certas
condições, por exemplo: o íon Co(NH3)63+, em solução fortemente ácida, permanece inalterado por
longos períodos de tempo e nessas condições parece ser estável, simplesmente porque sua
velocidade de reação (sua reatividade) é muito lenta. Em solução aquosa amoniacal, por exemplo,
o íon de prata hidratado sofre rapidamente uma reação de substituição, na qual as moléculas de
amônia substituem a água.
[Ag(H2O)2 ]+ (aq) + 2NH3 (aq) [Ag(NH3 )2 ]+ (aq) + 2H2O
III. Cor
Muitos complexos (e quase todos os complexos de matais de transição) são visivelmente coloridos.
Desde que a cor se situa na região visível (e na ultravioleta) do espectro, as variações de energia
são grandes, do que se conclui ser a cor o resultado de transições eletrônicas.
As transições eletrônicas que os complexos podem experimentar são, hoje, razoavelmente bem
compreendidas e por isso serão discutidas.
IV. Paramagnetismo
Muitos dos complexos de metais de transição são paramagnéticos, o que implica a existência de
spins eletrônicos desemparelhados. O número de elétrons desemparelhados nos permite
compreender algo a respeito da natureza das ligações nos complexos.
Ligação nos compostos complexos
Teoria na ligação de valência
A tabela a seguir indica a estrutura eletrônica de alguns íons de metais de transição na fase
gasosa.
Tabela de íons gasosos (*configuração alterada)
Ferro (Fe):
www.quimicaparaovestibular.com.br
[email protected]
3
Professora Sonia
Níquel (Ni) e cobalto (Co):
Cobre (Cu):
As configurações sem asterisco são as do estado fundamental. Os estados com asteriscos
possuem energia maior, Poe promoveram elétrons emparelhados (lembrar que emparelhar
elétrons viola a regra da multiplicidade máxima de Hund). A finalidade da promoção ou do
emparelhamento é esvaziar os orbitais que serão, mais tarde, hibridados; os orbitais a serem
hibridados, isto é, os 3d, 4s e 4p são os de energia mais ou menos igual.
Complexos octaédricos
Para formar seis orbitais equivalentes de simetria octaédrica, necessitamos hibridar determinados
conjuntos de seis orbitais atômicos. Um de tais conjuntos são dois orbitais 3d, 4s e os três 4p;
outras combinações de seis orbitais podem, também, formar híbridos octaédricos, mas as
configurações eletrônicas da maioria dos complexos são coerentes com a hibridação d2sp3.
Consideremos, como exemplos de complexos octaédricos, os íons ferrocianeto e ferricianeto, nos
quais o ferro se acha nos estados de oxidação II e III, respectivamente. O primeiro passo para
formar os complexos é tomar os íons gasosos Fe2+ e Fe3+ e formar os estados excitados indicados
na tabela de íons gasosos. Os orbitais vazios d, s e p são, então hibridados para formar os
híbridos d2sp3; esses orbitais serão representados numa caixa:
www.quimicaparaovestibular.com.br
[email protected]
4
Professora Sonia
Escrevendo a estrutura do íon cianeto segundo Lewis ( [: C ::: N :]− ) verificamos que ele apresenta
uma ligação tripla e pares não compartilhados de elétrons nos átomos de carbono e nitrogênio. Os
pares não-compartilhados nos átomos de carbono dos seis íons cianeto podem, agora, ocupar os
seis orbitais híbridos d2sp3 vazios do átomo metálico central, formando sis ligações covalentes de
coordenação. Podemos escrever as estruturas eletrônicas desses dois íons complexos como:
onde o símbolo ≈ representa o par de elétrons doados pela molécula ligante.
Essas estruturas indicam que o íon ferrocianeto deve ser diamagnético, mas o íon ferricianeto
deve ser paramagético, com uma suscetibilidade magnética resultante da presença de um elétron
desemparelhado. Essas previsões foram confirmadas experimentalmente.
Os complexos de cobalto (III) fornecem exemplos adicionais de complexos octaédricos com orbitais
híbridos d2sp3:
nos quais os pares de elétrons não-compartilhados de oxigênio na água e de nitrogênio na amônia
ocupam os orbitais híbridos. Esses exemplos ilustram a diferença de estrutura eletrônica entre os
íons de cobalto aquoso e gasoso de carga tripla, de que resultam diferentes propriedades físicas e
químicas.
www.quimicaparaovestibular.com.br
[email protected]
5
Professora Sonia
Observação: a notação sp3d2 implica que os orbitais s e p se combinam com orbitais d, de mesmo
número quântico principal, enquanto, na notação d2sp3 os orbitais d possuem número quântico
principal menor em uma unidade em relação aos orbitais s e p.
Complexos quadrados planos
Quatro orbitais híbridos equivalentes, dirigidos para os vértices de um quadrado, podem ser
obtidos por hibridação dsp2 (isto vale principalmente para a primeira série de transição). Seguindo
o procedimento exposto anteriormente para complexos octaédricos, ou seja, de esvaziar os orbitais
convenientes dos íons gasosos, hibridando os orbitais vazios, e, então, formando ligações
covalentes por compartilhamento de um par de elétrons, a partir de cada ligante, obtemos os
exemplos de complexos quadrados planos, apresentados a seguir:
Complexos tetraédricos
Já estudamos a hibridização tetraédrica nos compostos CH4 e NH4+, etc. e por isso basta lembrar
que a simetria tetraédrica resulta de uma hibridação sp3. Conhecem-se muitos complexos
tetraédricos, observe alguns deles a seguir:
www.quimicaparaovestibular.com.br
[email protected]
6
Professora Sonia
Exercícios
Observação: Consulte a tabela periódica para obter os números atômicos dos elementos.
“O enunciado a seguir se refere aos exercícios de 01 a 15.”
Analise os compostos a seguir e dê as suas respectivas geometrias.
01. HgCl2
09. [Fe(CN)6]3-
02. CrCl63 –
10. [Co(NH3)6]3+
03. [Co(H2O)6]3+
11. [Zn(CN)4]2-
04. [Pt(NH3)4]2+
12. [CoCl4]2-
05. [Co(NH3)5Cl]2+
13. [AuCl4]-
06. [Ni(CN)4] 2–
14. [Ni(Cl)4]2-
07. [PtCl4]215. [Co(H2O)6]3+
08. [Fe(CN)6]4–
16. (Ufpe 96) Na(s) questão(ões) a seguir escreva nos parênteses a letra (V) se a afirmativa for
verdadeira ou (F) se for falsa.
Complexos de coordenação ocorrem largamente na natureza e desempenham papéis biológicos
importantes (ex.: fotossíntese, transporte de oxigênio, etc.). De um modo bem simples trata-se de
espécies em que um átomo tem disponível um ou mais pares de elétrons para realizar uma ligação
coordenada (ou dativa) com uma outra espécie que possui orbitais de valência vazios. Com base
nesta informação, pode-se afirmar que:
(___) íons Cu2+ possuem orbitais 3d semipreenchidos e poderiam formar complexos de
coordenação com uma espécie apropriada.
(___) A amônia pode formar complexo de coordenação através do par de elétrons livres do
nitrogênio.
(___) O boro, na molécula de BF3, não possui orbitais vazios na segunda camada e portanto não
pode realizar ligações coordenadas.
www.quimicaparaovestibular.com.br
[email protected]
7
Professora Sonia
(___) A molécula de água pode formar complexo de coordenacão com Ni2+.
(___) Tanto a amônia quanto a água podem formar ligação coordenada com o íon H+.
17. Com relação aos íons complexos analise as afirmativas abaixo.
I. A primeira teoria sobre ligações nos complexos, de alguma utilidade foi proposta por Alfred
Werner em 1898.
II. Uma propriedade dos complexos é sua velocidade de reação; alguns se ajustam rapidamente às
mudanças do meio, enquanto outros o fazem mais lentamente.
III. Muitos complexos (e quase todos os complexos de matais de transição) são visivelmente
coloridos.
IV. Os íons complexos não sofrem hibridização.
Está(âo) correta(s):
a) Apenas I e II.
b) Apenas I e IV.
c) Apenas IV.
d) Apenas II e III.
e) Apenas I, II e III.
18. O íon prata hidratado, em solução aquosa amoniacal, sofre rapidamente uma reação de
substituição, na qual as moléculas de amônia substituem a água. Como o íon prata hidratado é
classificado? Equacione a reação que ocorre no processo.
19. O complexo cobre-tetramina (II) se decompõe rapidamente por aquecimento, em solução
aquosa, produzindo amônia e óxido cúprico. Como o íon cobre pode ser classificado em termos de
hibridização?
20. Vários cátions aquosos não foram investigados intensivamente, mas é provável que a maioria
dos íons dos metais de transição existam em solução aquosa sob a forma de íons hexahidratados
[M(H2O)6]z+. Dê um exemplo de íon hexahidratado.
O enunciado a seguir se refere aos exercícios de 21 a 30.
“Coloque S (sim) para os compostos (ou íons) a seguir que forem classificados como complexos ou
N (não) para aqueles que não forem assim classificados.”
21. (___) Fe (s).
22. (___) MnO4-.
23. (___) [PtCl4]2 -.
24. (___) [Ag(H2O)2]+.
25. (___) H2SO4.
26. (___) CuO2CCH3.2H2O.
27. (___) Al3+(aq).
28. (___) C6H12O6.
29. (___) HNO3.
30. (___) Fe3O4.
www.quimicaparaovestibular.com.br
[email protected]
8
Professora Sonia
Respostas dos exercícios
01. HgCl2: Linear.
02. CrCl63 -: Octaédrica.
03. [Co(H2O)6]3+: Octaédrica.
04. [Pt(NH3)4]2+: Quadrada.
05. [Co(NH3)5Cl]2+Octaédrica.
06. [Ni(CN)4]2-: Quadrada.
07. [PtCl4]2-: Quadrada.
08. [Fe(CN)6]4–: Octaédrica.
09. [Fe(CN)6]3– Octaédrica.
10. [Co(NH3)6]3+: Octaédrica.
11. [Zn(CN)4]2-: Tetraédrica.
12. [CoCl4]2 -: Tetraédrica.
13. [AuCl4]-: Quadrada.
14. [Ni(Cl)4]2-: Quadrada.
15. [Co(NH3)6]3+: Octaédrica.
16. V V F V V
17. Alternativa E.
18. O íon prata hidratado é um íon complexo.
A equação é: [Ag(H2O)2 ]+ (aq) + 2NH3 (aq) [Ag(NH3 )2 ]+ (aq) + 2H2O( ) .
19. O íon cobre é complexo.
20. [Co(H2O)6 ]3+ .
21. N
22. S
23. S
24. S
25. N
26. S
27. S
28. N
www.quimicaparaovestibular.com.br
[email protected]
29. N
30. S
9