ESTADO DE SANTA CATARINA
SECRETARIA DE ESTADO DA SAÚDE
DIRETORIA DE MEDICAMENTOS BÁSICOS DIMB/SES/SC
PROTOCOLO PARA DISPENSAÇÃO DE ANÁLOGO DE LHRH PARA TRATAMENTO DA
PUBERDADE PRECOCE
OBS. Os protocolos serão avaliados se houver completo preenchimento de todos os dados solicitados, caso contrário
serão devolvidos.
1-Identificação
NOME:
DATA NASCIMENTO
MÃE ou RESPONSÁVEL:
NÚMERO do PROCESSO:
ENDEREÇO:
BAIRRO:
MUNICÍPIO:
ESTADO: SC
CEP
TELEFONE
2 - Critérios clínicos para definição de puberdade precoce central.
Assinalar o critério usado para definição.
a)Meninas:
TELARCA ANTES DOS 8 ANOS
MENARCA ANTES DOS 9 ANOS E 6 MESES
PÊLOS PUBIANOS ANTES DOS 8 ANOS COM TELARCA
b) Meninos:
VOLUME TESTICULAR > 4cm3, ou testículo > 2,5cm (maior diâmetro), antes dos 9 anos.
PÊLOS PUBIANOS ANTES DOS 9 ANOS, COM AUMENTO DO VOLUME TESTICULAR
c)Condição especial
Paciente em uso de hormônio de crescimento que iniciou a puberdade, necessitando de bloqueio.
3-Caso o paciente apresentar puberdade precoce estabelecida nos critérios acima, preencher os dados
abaixo, para análise da comissão de endocrinologia da secretaria de estado da saúde.
4-Dados referentes aos pais.
ALTURA DO PAI:
ALTURA DA MÃE
IDADE DA MENARCA DA MÃE
CASOS DE PUBERDADE PRECOCE NA FAMÍLIA?
5-Dados do paciente.
PESO NASCIMENTO:
ALTURA NASCIMENTO:
Desenvolvimento Neuro-Psico-Motor
6-ESTÁ FAZENDO USO DE ANÁLOGO DE LHRH ( )NAO ( )SIM Citar o período:
7-RX de sela túrcica:
Data:
Laudo:
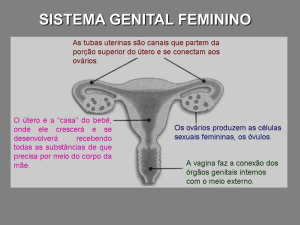
8-Ultrassonografia pélvica:
Data:
Volume uterino =
Ovário direito =
Ovário esquerdo =
Outros achados
cm³
cm³
cm³
9-Teste do LHRH
♀ Estradiol =
♂ Testosterona =
LH
Basal =
15’
=
30’
=
45’
=
60’
=
90’
=
Metodologia laboratorial:
FSH
Basal
15
30’
45’
60’
90’
=
=
=
=
=
Relação LH Máximo FSH Máximo:
10-Urocitograma: Laudo anexado ao protocolo.
11-Tomografia axial computadorizada de crânio: Laudo anexado ao protocolo.
12-Ressonância magnética: Laudo anexado ao protocolo.
13-Gráfico de crescimento: Anexado ao protocolo.
Assinatura e carimbo do médico responsável
14-Avaliação continuada.
1ª Consulta
2ª Consulta
3ª Consulta
4ª Consulta
5ª Consulta
6ª Consulta
7ª Consulta
8ª Consulta
9ª Consulta
10ª Consulta
11ª Consulta
12ª Consulta
13ª Consulta
14ª Consulta
15ª Consulta
16ª Consulta
17ª Consulta
18ª Consulta
19ª Consulta
20ª Consulta
21ª Consulta
22ª Consulta
23ª Consulta
24ª Consulta
25ª Consulta
26ª Consulta
27ª Consulta
28ª Consulta
DATA
IDADE CRONOLÓGICA
IDADE ÓSSEA
PESO
ALTURA
VELOCIDADE CRESCIMENTO
ESTÁGIO PUBERAL (Tanner) MAMAS
ESTÁGIO PUBERAL (Tanner) PÊLOS:
DATA INICIO DO ANÁLOGO
DATA
IDADE CRONOLÓGICA
IDADE ÓSSEA
PESO
ALTURA
VELOCIDADE CRESCIMENTO
ESTÁGIO PUBERAL (Tanner) MAMAS
ESTÁGIO PUBERAL (Tanner) PÊLOS:
DATA INICIO DO ANÁLOGO
DATA
IDADE CRONOLÓGICA
IDADE ÓSSEA
PESO
ALTURA
VELOCIDADE CRESCIMENTO
ESTÁGIO PUBERAL (Tanner) MAMAS
ESTÁGIO PUBERAL (Tanner) PÊLOS:
DATA INICIO DO ANÁLOGO
DATA
IDADE CRONOLÓGICA
IDADE ÓSSEA
PESO
ALTURA
VELOCIDADE CRESCIMENTO
ESTÁGIO PUBERAL (Tanner) MAMAS
ESTÁGIO PUBERAL (Tanner) PÊLOS:
DATA INICIO DO ANÁLOGO
LOCAL___________________________________________________________________________
Data____/____/____
Assinatura e carimbo do médico responsável
15-Critérios de inclusão de pacientes no programa de puberdade precoce da secretaria de estado da
saúde:
Puberdade precoce central estabelecida por critérios clínicos e laboratoriais.
16-Critérios de exclusão de pacientes no programa de puberdade precoce da secretaria de estado da
saúde:
Meninas com idade óssea igual ou superior a 12,5 anos;
Meninos com idade óssea igual ou superior a 13 anos;
Puberdade normal;
Síndrome de Mc’cune Albright com baixos níveis de LH e FSH;
Testotoxicose familiar.
17-posologia do tratamento:
Uma ampola de Triptorelina (3mg), intramuscular inicialmente de 28 em 28 dias.
Caso não ocorrer bloqueio de puberdade, este intervalo poderá ser reduzido de acordo com critérios clínicos
e laboratoriais avaliados pela comissão de endocrinologia da secretaria de estado da saúde.
18-Controle dos pacientes em uso de análogo LHRH:
Idade óssea a cada 6 meses;
LH, FSH, Estradiol ou Testosterona colhidos 1 dia antes da injeção à cada 3 meses;
Ultrassonografia pélvica nas meninas, 6 meses após inicio do tratamento;
Dados antropométricos de 6 em 6 meses.
os dados acima devem ser encaminhados junto com o protocolo durante a evolução do tratamento para
que a comissão possa avaliar.
OBS.
19-Critérios para encerrar tratamento:
Idade cronológica adequada para desenvolver puberdade e/ou estatura final dentro do potencial genético;
Idade óssea 12,5 anos para meninas;
Idade óssea 13 anos para meninos.
OBS. Não será liberado análogo para pacientes que desenvolvem puberdade normal, mas que queiram
retardá-la para tentar melhorar a estatura final.
TERMO DE CONSENTIMENTO INFORMADO
ACETATO DE LEUPROLIDE, TRIPTORELINA,
Eu_____________________________________________________________________________________________
abaixo identificado(a) e firmado(a), declaro ter sido informado(a) claramente sobre todas as indicações, contraindicações, principais efeitos colaterais e riscos relacionados ao uso dos medicamentos acetato de
medroxiprogesterona, acetato de leuprolide, triptorelina, para o tratamento da puberdade precoce.
Estou ciente de que este medicamento somente pode ser utilizado por mim, comprometendo-me a devolvê-lo caso o
tratamento seja interrompido.
Os termos médicos foram explicados e todas as minhas dúvidas foram resolvidas pelo médico EDSON CECHINEL.
Expresso também minha concordância e espontânea vontade em submeter-me ao referido tratamento, assumindo a
responsabilidade e os riscos pelos eventuais efeitos indesejáveis.
Assim, declaro que:
Fui claramente informado(a) de que os medicamentos podem trazer os seguintes benefícios:
• Bloqueio da puberdade
Fui também claramente infor
do(a) a respeito das seguintes contra-indicações, potenciais efeitos colaterais e
riscos:
• medicações classificadas na gestação como categoria X (seu uso é contra-indicado em gestantes ou em mulheres
planejando engravidar).
• risco de ocorrência dos seguintes efeitos colaterais:
- Acetato de leuprolide: (Freqüentes) calorões, diarréia, distúrbios menstruais; menos freqüentes: arritmias cardíacas,
palpitações; raros: boca seca, sede, alterações do apetite, ansiedade, náuseas, vômitos, desordens de personalidade,
desordens da memória, diminuição da libido, ganho de peso, dificuldades para dormir, delírios, dor no corpo, perda de
cabelo e distúrbios oftalmológicos.
- Triptorelina: (freqüentes) calorões, dores nos ossos, impotência, dor no local da injeção, hipertensão, dores de cabeça;
menos freqüentes: dores nas pernas, fadiga, vômitos, insônia; raros: tonturas, diarréia, retenção urinária, infecção do
trato urinário, anemia, prurido.
Estou ciente de que posso suspender este tratamento a qualquer momento, sem que este fato implique qualquer forma
de constrangimento entre mim e meu médico, que se dispõe a continuar me tratando em quaisquer circunstâncias.
Autorizo o Ministério da saúde e as Secretarias de Saúde a fazer uso de informações relativas ao meu tratamento desde
que assegurado o anonimato.
Declaro, finalmente, ter compreendido e concordado com todos os termos deste Consentimento informado.
Assim, o faço por livre e espontânea vontade e por decisão conjunta, minha e de meu médico.
O meu tratamento constará do seguinte medicamento:
( )acetato de leuprolide
( ) triptorelina
Paciente:________________________________________________________________________________
R.G. do paciente:______________________ Sexo: Masculino ( ) Feminino ( ) Idade do Paciente:_________
Endereço: Cidade:__________________________CEP: __________Telefone: ( )___________________
Responsável Legal (quanto for o caso):________________________________________________________
R.G do responsável legal:___________________________________________________________________
Assinatura do Paciente ou Responsável________________________________________________________
Médico Responsável: )_______________________CRM: ________.Endereço:________________________
Assinatura e Carimbo do Médico_____________________________________________________________
Data_______/_______/__________
Observações:
a) O preenchimento completo deste Termo e sua respectiva assinatura são imprescindíveis para o fornecimento do
medicamento.
b) Este Termo será preenchido em duas vias, ficando uma arquivada na farmácia responsável pela dispensação do
medicamento e a outra será entregue ao paciente.