Curso Ágora Tupaciguara
Colegio
Anglo
Anglo
Uberlândia
Professor: Lourival Neto
Disciplina: Química
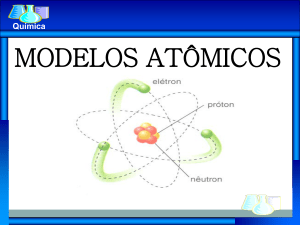
Modelos atômicos
Sumário
Modelo atômico de Dalton
Modelo Atômico de Thomson
Modelo atômico de Rutherford
Modelo atômico de Bohr
Modelo atômico de Dalton
Dalton físico inglês que em 1808 propõe sua teoria
sobre o átomo
Toda matéria existente é formada por pequenas entidades
chamadas átomos!
Dalton resgata a idéia de Leucipo e Demócrito quanto a
indivisibilidade da matéria.
Dalton Explica as leis de Lavoisier(Lei da conservação da
massa) e Proust(lei das proporções Constantes)
O primeiro modelo científico(Envolve experimentos)!
Principais características do modelo
atômico de Dalton
Os átomos seriam esferas rígidas, maciças e indivisíveis
semelhantes a bolas de Bilhar
Os átomos de um mesmo elemento são iguais.
Átomos diferentes formam elementos diferentes
Principais características do modelo atômico de
Dalton
Os átomos em uma reação química não são
Transformados, simplesmente eles trocam de parceiros
formando novas substâncias!
Lei de Proust
Pela equação química Dalton mostra que a proporção
entre as substâncias é a mesma logo entre os átomos
também!
2 moléculas de H para 1 de O e formando 2 de Água
Quantas moléculas de água serão formadas quando
tivermos 6 de Hidrogênio?
Principais características do modelo
atômico de Dalton
Como os átomos se conservam em uma reação química,
a massa das substâncias que foram consumidas é a
mesma massa das substâncias formadas. (Lavoisier)
Reagentes Produtos (reação química)
MR = Mp
Modelo de Thomson
Tubo de
Raios
Catódicos
Características do
modelo de Thomson
Descobriu a relação entre a massa e a carga do
elétron(descoberta do elétron)
Introduziu o conceito de cargas elétrica atômicas
Características do
modelo de Thomson
Átomo esférico, maciço e divisível, semelhante a um
pudim de passas.
Átomo possui cargas positivas e negativas(elétrons) em
igual quantidade(neutro)
No átomo os elétrons (cargas negativas estariam
incrustadas nas cargas positivas, assim como as passas
estão no pudim
Átomo possui densidade homogênea, pois é Contínuo!
Modelo atômico de Rutherford
Antecedentes:
Descoberta da radioatividade - partículas ‘(+) ’(-)
Experimento dispersão das partículas ‘(+)
Experimento de Rutherford
Experimento modificado de
Rutherford
Experimento modificado de
Rutherford
Conclusões
O átomo possui duas regiões
Núcleo (prótons)
Eletrosfera(elétrons)
Principais características do modelo
atômico de Rutherford
O átomo possui um núcleo central onde estão as
cargas + (prótons)
Ao redor do núcleo estão os elétrons (eletrosfera),
em movimento acelerado para não serem atraídos
pelo núcleo!
O tamanho do átomo é cerca de 10000 a 100000
vezes maior que o tamanho do núcleo!
O átomo é descontínuo não sendo portanto maciço!
Qual é o modelo criado?
Modelo sistema planetário!
Os elétrons giram ao redor do núcleo assim
como os planetas ao redor do sol!
Modelo de Bohr
“Complementação”
Rutherford!
Porque os elétrons não “caem” no Núcleo?
A física clássica dizia que cairia!
Quando
o
elétron
(carga
elétrica)
se
movimenta(acelerado), ele perde energia (muda a
cor da luminescência)!
do
modelo
atômico
de
Não é o que percebemos!
Átomos específicos emitem cores específicas!
Átomos de elementos diferentes emitem diferentes
cores!
E agora? Quem poderá nos defender?
A Fronteira
Existiu uma grande fronteira que separava de um
lado a explicação de Rutherford e a Física Clássica
e de outro as observações!
Bohr irá resgatar o modelo de Rutherford e
Introduzir conceitos da teoria Quântica de Planck
Proposta de Planck
A matéria não emite energia de maneira contínua e sim
em determinadas quantidades (Quantum) que estão na
forma de fótons!
Bohr
Átomo é formado pelo núcleo e a eletrosfera!
No núcleo estão os prótons e na eletrosfera os elétrons!
A Pergunta que não quer calar?
Como os elétrons se movimentam na eletrosfera, eles se
movimentam?
Sim eles se movimentam ao redor do núcleo assim
como os planetas se movimentam ao redor do sol!
Então eles não caem ao núcleo?
Os elétrons possuem energia própria(cinética e
potencial)
Não, pois se movimentam somente em certos níveis de
energia sem ganhar ou perder energia!
Espectro do Arco íris e Dos
elementos Químicos
Principais características do modelo
de Bohr
Na eletrosfera os elétrons estão em movimentos
circulares ao redor do núcleo. A forma do movimento é
chamado de órbita circular.
Nesse movimento os elétrons não absorvem ou emitem
energia, ou seja, energia constante!
Na eletrosfera existem regiões de energias diferentes.
Essas regiões foram chamadas de níveis de energia ou
camadas eletrônicas.
Principais características
do modelo de Bohr
Os elétrons em um mesmo nível possuem a
quantidade de energia deste nível!
Para que um elétron possa saltar para um nível de
maior energia ele deve absorver energia (fótons)
suficiente (quantum) para que esteja com a mesma
energia da camada a ser atingida.
Principais características
do modelo de Bohr
Para que o elétron consiga voltar para a camada
original a quantidade de energia por ele absorvida
anteriormente deve ser liberada
Fogos de artifício
Porque os focos de artifício possuem cores características?
Pois fogos que são formados por elementos diferentes
emitem cores diferentes, pois a quantidade de energia que o
elétron do fósforo irá receber não será a mesma que a do
Potássio
OBRIGADO