1
DESENVOLVIMENTO DO SISTEMA DIGESTÓRIO EM AVES
José Henrique Stringhini, Cristiane Ferreira Prazeres Marchini, Fabiana Ramos dos Santos,
Januária Silva Santos, Candice Bergmann Silva Garcia Tanure, Julian David Nieto Buiriticá, Pedro
Moraes Rezende, Marcos Barcellos Café
Departamento de Produção Animal, Escola de Veterinária e Zootecnia
Universidade Federal de Goiás, Goiânia, Goiás
As espécies aviárias apresentam particularidades inerentes em seu desenvolvimento. O
estágio embrionário é realizado fora do organismo materno, em um sistema físico-químico
complexo caracterizado pelo ovo. Além de ser fertilizado, este ovo deve conter todos os
nutrientes essenciais para o desenvolvimento do embrião (CAMPOS, 2003).
A potencialidade do desempenho de frangos de corte tem relação direta com a qualidade
dos ovos. Essa qualidade do ovo é importante parâmetro para caracterizar a embriogênese e, por
consequência, interfere nos índices de eclodibilidade e isso afeta a qualidade do pinto neonato
(TONA et al., 2003). Sabe-se também que essa qualidade interfere diretamente no desempenho
da ave durante as diferentes fases de desenvolvimento.
O processo de incubação possui grande importância no ciclo de produção avícola. Essa fase é
caracterizada por ser a mais longa em todo o ciclo produtivo. Durante esse período ocorre a fase
embriogênica de diferenciação tecidual que perdura por cerca de sete dias e, posteriormente,
ocorre o crescimento tecidual e a preparação para o nascimento.
As transformações que acontecem no período de incubação são constantes. Durante 21
dias, ocorrerá uma série de eventos que darão origem ao novo ser. O desenvolvimento do
embrião após a postura do ovo embrionado é muito rápido, ocorrendo alterações a cada hora
(CESARIO & GONZALES, 2003).
Neste trabalho, foi proposto discutir o desenvolvimento embrionário das aves no período
pré e pós eclosão.
Desenvolvimento intestinal no período de incubação
Nas aves o desenvolvimento do trato gastrintestinal se inicia nas primeiras 24 horas de vida
do embrião. Ao quinto dia de vida embrionária, ocorre a diferenciação da boca, assim como a
2
formação do proventrículo e da moela. No sexto dia de vida tem-se início a formação do bico. Ao
décimo quarto dia de vida embrionária ocorre a introdução do intestino na cavidade abdominal e
no décimo sétimo dia ocorre a abertura do Divertículo de Meckel e no meio intestinal inicia-se o
mecanismo fisiológico da absorção do saco vitelínico(Maiorka & Rocha, 2009).
Caracterização do intestino delgado na fase embrionária
Embriologicamente, o intestino é derivado de endoderme rodeado por mesoderme
esplâncnico e pode ser dividido em intestino anterior, intestino médio, intestino grosso ao terceiro
dia incubação (Moore & Persaud, 2008). A endoderme dá origem ao revestimento epitelial do
intestino e aos ductos das glândulas mucosas, ao passo que a mesoderme dá origem à parede
muscular e ao tecido conjuntivo (Dibner & Richards, 2004; Dibner et al., 2007).
No sexto dia de incubação, observa-se a presença da alça duodenal, do intestino delgado e
dos cecos. O intestino primitivo é aberto e está ligado à gema através do divertículo de Meckel,
assim as paredes do saco vitelino e as paredes do intestino são contínuas (Freeman & Vence,
1974). O intestino grosso primitivo dará origem à cloaca e à bolsa de Fabricius no 4o dia de
incubação (Dibner & Richards, 2004; Dibner et al., 2007).
DESENVOLVIMENTO INTESTINAL NA FASE EMBRIONARIA
No período de incubação, a taxa de crescimento do intestino delgado é maior que os demais
órgãos. Aos 18 dias de incubação a proporção do peso do intestino delgado do embrião é maior
que a proporção do peso corporal do mesmo (UNI et al., 2003a,b)
Neste momento, as vilosidades podem ser divididas em duas fases principais de
desenvolvimento: vilosidades maiores geralmente apresentado forma de pêra e as vilosidades
menores, mais estreitas e com forma semelhante a foguete. No entanto, no 19o dia de incubação
observa-se uma nova fase de desenvolvimento de vilosidade (Uni et al., 2003a).
As células epiteliais do intestino delgado do embrião de pinto são colunares até a eclosão.
No 21o dia de incubação, cada vilo apresenta somente uma cripta rudimentar.
As células caliciformes contendo mucinas aparecem pela primeira vez, ao longo do vilo, no
13o dia de incubação, e a maioria das células contém mucinas ácidas no 18o dia de incubação e
correspondem a 13% das células epiteliais (Uni et al., 2003b). A densidade de células caliciformes
aumenta ao longo do vilo aos 20-21 dias de incubação em todos os segmentos do intestino
delgado, sendo que o número aumenta ao longo dos segmentos mais distais do intestino delgado.
3
A partir do 20-21o dia de incubação as células caliciformes produzem mucinas ácidas e neutras
(Ozaydin & Celik, 2012). De acordo com Ozaydin & Celik (2012) o número de células caliciformes
aumenta no sentido distal dos segmentos intestinais.
As células caliciformes são observadas em criptas rudimentares no 21 o dia de incubação
(Ozaydin & Celik, 2012). As proporções entre mucina neutra e ácida produzidas pelas células
caliciformes foram semelhantes entre a fase imediatamente após a eclosão e o 7 o dia de idade
(Uni et al., 2003b; Ozaydin & Celik, 2012).
As células enteroendócrinas têm formato piramidal ou oval com grânulos marrons escuros
localizados na posição infra-nuclear, estão presentes no epitélio e subepitélio ao longo dos vilos e
são visualizadas pela primeira vez no 13o dia de incubação. No 18o dia, podem ser contadas de 1 a
4 células na maioria dos vilos e algumas poucas células argirofílicas são observadas no duodeno,
enquanto que células argentafins não são observadas. Apresentam distribuição uniforme ao longo
dos segmentos do intestino delgado aos 20-21 dias de incubação, sendo também nesta idade
observadas em criptas rudimentares (Ozaydin & Celik, 2012).
Células em proliferação são observadas no epitélio, no tecido conectivo e na camada
muscular da mucosa no estágio inicial de incubação. A partir do 20-21o dia de incubação, o
número de células PCNA positivas tende a diminuir no tecido conectivo e na muscular da mucosa
do intestino delgado. Ao longo do vilo e na cripta, a maioria das células epiteliais são PCNApositivas, bem como a maioria das células da cripta nesta mesma idade de incubação. A
proliferação das células epiteliais ao longo do vilo que ocorre neste período de desenvolvimento
embrionário tem importante papel no rápido crescimento do vilo, o que resulta em aumento da
superfície absortiva intestinal (Ozaydin & Celik, 2012).
No 11o, 13o, 15o e 18o dia de incubação, as células apoptóticas são observadas no
mesotélio, enquanto que são raramente observadas no epitélio e no ápice do vilo. Poucas células
apoptóticas foram observadas no ápice dos vilos entre 20-21 dias de incubação. A morfologia do
intestino delgado muda rapidamente nos estágios tardios da incubação. Assim, o desenvolvimento
da cripta é crucial na maturação intestinal. O aumento no número e tamanho das criptas fornece
enterócitos para o aumento da superfície absortiva intestinal à medida que o vilo cresce (Ozaydin
& Celik, 2012).
A morfologia do intestino delgado também muda rapidamente com o crescimento
acelerado da muscular externa e das vilosidades. No 15 o dia de incubação, as vilosidades são
rudimentares, no entanto, no 17o dia são observadas vilosidades em diferentes fases do
desenvolvimento. Nesta idade as vilosidades podem ser vistas em duas fases de desenvolvimento:
4
(V1) vilosidades maiores, em forma de pêra e (V2) vilosidades menores (aproximadamente 65 %
do tamanho das vilosidades maiores), mais estreitas e com forma de foguete. Adjacente a cada
vilosidades maior há uma vilosidade menor. Padrão similar foi observado entre 18-19 dias de
incubação, com vilosidades em ambas as fases de desenvolvimento. A taxa de crescimento de das
vilosidade V1 e V2 entre 19-20 dias de incubação foi de 30 a 40% (Uni et al., 2003a).
As mudanças que ocorrem no desenvolvimento morfológico do TGI próximo à eclosão
incluem basicamente a diferenciação dos enterócitos e a definição das criptas, bem como, o
grande aumento da superfície absortiva do intestino (Sklan, 2001).
Ozaydin & Celik (2012) consideram estas mudanças celulares que ocorrem no
desenvolvimento do intestino delgado no período embrionário, especialmente a partir do 18 o dia
de incubação prepararam o TGI das aves para o período pós-eclosão no qual ocorre a rápida
transição para a nutrição exógena.
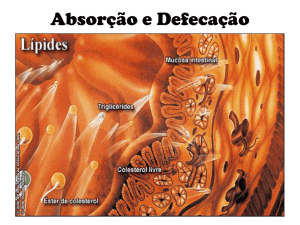
Apesar da existência do órgão responsável pela absorção dos nutrientes, este ainda é
afuncional. No período de incubação, os nutrientes para o embrião advêm dos lipídios presente no
saco vitelínico e das proteínas presentes no albúmen. Estes são diretamente transportados para o
sangue pelo processo de endocitose (Santos et al., 2010).
No terço final de incubação parte do albúmen se mistura com o conteúdo do saco
amniótico. Visto o crescimento contínuo do embrião, há aumento da pressão intraovo e o
diferencial de pressão criado em decorrência do crescimento embrionário é contínuo, faz com que
haja o consumo oral desta mistura que passará pelo trato gastrintestinal. Parte do albúmen
absorvido no intestino delgado serve para expandir as reservas de glicogênio corporal do embrião,
além de preparar o organismo do embrião para a eclosão e allimentação exógena (Sugimoto et al.,
1999; Moran Jr., 2007).
A absorção parcial de proteínas a partir dessa mistura ocorre pelos enterócitos, que são
capazes de absorver essa mistura durante o trânsito deste pelo duodeno e jejuno. Grande parte
do gasto energético embrionário no tecido intestinal está concentrado nas últimas 48 horas do
período da eclosão. Isso se deve a preparação do organismo da ave para a digestão dos nutrientes
após o nascimento (Oliveira et al., 2009).
A partir desse início do processo de digestão e de absorção ocorrem alterações nas
características morfológicas e fisiologicas da mucosa do intestino delgado. Os enterócitos deixam
de ser células arredondadas e apolares e passam a assumir sua conformação típica (alongada).
Durante o período de incubação as criptas são estruturas rudimentares e afuncionais. Nas
mudanças morfológicas, estão o aumento do comprimento do intestino, na altura e densidade dos
5
vilos e no número de enterócitos, células caliciformes e células enteroendócrinas. As alterações
fisiológicas estão relacionadas com o aumento na capacidade de digestão e de absorção do
intestino, que ocorrem em decorrência do aumento na produção de enzimas digestivas
pancreáticas e de membrana (Maiorka et al., 2002).
As vilosidades dos embriões possuem enterócitos únicos que são capazes de absorver os
fluidos embrionários contendo macromoléculas. Contudo, na fase embrionária, a função
primordial dos enterócitos é a absorção de imunoglobulinas. O consumo do líquido amnióticoalbumina e a sua absorção são contínuos até que o líquido desapareça e inicie o processo de
bicagem interna (Moran Jr., 1985).
UTILIZAÇÃO DO CONTEÚDO DO SACO DA GEMA
À medida que se aproxima a eclosão, o saco vitelino residual não utilizado no período de
incubação é internalizado na cavidade tóracoabdominal como uma extensão do intestino, quando
compreende 20 a 50% do peso corporal dos pintos (Noble & Ogunyemi, 1989). Evidências
confirmam que próximo, ou mesmo no momento da eclosão, parte da gema residual é absorvida
no intestino (Esteban et al., 1991) e fornece os nutrientes digestíveis que podem estimular as
funções absortivas e digestivas do intestino delgado (Noy et al., 1996; Sulaiman et al., 1996).
A gema contém aproximadamente 50% de lipídeos à eclosão que contribuem para a
manutenção da ave jovem durante os primeiros dias após a eclosão (Anthony et al., 1989; Noy et
al., 1996). Depois do nascimento, os resíduos da gema são transportados para a circulação via
sistema vascular e para o intestino, através do divertículo do saco vitelínico(Esteban et al., 1991;
Noy et al., 1996). O tamanho do saco vitelínico diminui exponencialmente após a eclosão,
passando de 4,6 g à eclosão (Nitsan et al., 1991) para menos de 1g, conteúdo que permanece
depois de 96 horas após o nascimento, quando as células linfóides começam a se reunir,
obstruindo o divertículo do saco vitelínico(Olah & Glick, 1984; Noy et al., 1996).
O período imediato após-eclosão é caracterizado por uma transição da utilização do
conteúdo do saco vitelínico, rico em lipídeos, como fonte de nutrientes para alimentação exógena,
rica em carboidratos e proteínas (Sklan, 2001). Esta transição é acompanhada pelo rápido
desenvolvimento físico e funcional do trato gastrointestinal (Uni et al., 1999) e demora 2 a 3 dias
para ser completada (Vieira, 2004).
Atividade enzimática pré-eclosão
6
Apesar da ave não ter ingerido alimento até o momento da eclosão, as enzimas do
intestino e pâncreas, bem como a capacidade de transporte de nutrientes estão presentes
(Buddington, 1992). A capacidade de digestão dos nutrientes, no entanto, não está totalmente
estabelecida neste momento (Krogdahl & Sell, 1989). Mudanças ontogenéticas ocorrerem, tanto
antes como após a eclosão, que incluem aumento nos níveis de enzimas pancreáticas e intestinais
(Noy & Sklan, 1995; Sklan & Noy, 2000), aumento da área de absorção total do trato GI (Iji et al.,
2001: Sklan et al., 2003), e mudanças em transportadores de nutrientes (Buddington & Diamond,
1989; Sklan et al., 2003).
CARACTERIZAÇÃO DO INTESTINO DELGADO NO PERÍODO PÓS-ECLOSÃO
Após a eclosão, o TGI é um tubo oco e fibromusculoso (Artoni, 2004) constituído de quarto
túnicas concêntricas denominadas, da luz para a periferia, de mucosa, submucosa, muscular e
serosa.
A mucosa do intestino delgado é formada pelos vilos e estes são envoltos pelas criptas que
contém as células colunares indiferenciadas ou pluripotentes. Estas células migram para a região
apical do vilo e se diferenciam em células colunares (enterócitos), enteroendócrinas (secretoras de
hormônios e polipeptídeos), caliciformes (produtoras de muco) (Boleli et al., 2002) células de
Paneth se originam e se desenvolvem na base da cripta e não migram ao longo do vilo durante o
seu processo de maturação (Van der Flier & Clevers, 2009). Este conjunto de células formam um
epitélio simples, colunar prismático, com borda estriada e com células caliciformes revestido pela
lâmina própria formada de tecido conjuntivo frouxo e pela muscular da mucosa, constituída de
camadas de células musculares lisas, circular interna e longitudinal externa (Gartner & Hiatt,
1999).
A membrana apical dos enterócitos é ainda aumentada pela formação dos microvilos que
proporciona um aumento de 30 vezes na área da superfície da membrana absortiva (Bals, 2000).
Este aumento da área de superfície permite uma maior absorção de nutrientes, e proporciona um
ponto de ancoragem para uma variedade de enzimas envolvidas na digestão extracelular de
nutrientes, é impermeável aos microorganismos e macromoléculas. Linfócitos intraepiteliais,
incluindo células plasmáticas secretoras de anticorpos, são encontrados na lâmina, e as células de
Paneth, secretoras de peptídeos antimicrobianos são encontrados nas criptas (Dibner et al., 2007).
As células caliciformes são células secretórias altamente polarizadas, de curto tempo de
7
vida, com sua membrana apical aberta para o lúmen intestinal. Estas células são especializados
para secretar uma mistura de glicoproteínas denominadas mucinas, que são o componente
principal do muco gastrointestinal (Quigley, 2001; Van Dijk et al., 2002). O muco cobre e lubrifica a
mucosa do trato GI, protegendo-o contra danos mecânicos, ácido do estômago e microorganismos
patogênicos como vírus e bactérias Gram-negativas e Gram-positivas, leveduras, fungos,
protozoários, nematóides e vírus envelopados (Bals, 2000; Alberts et al., 2002).
Externamente à túnica mucosa, encontra-se a túnica submucosa constituída de tecido
conjuntivo denso e fibroelástico, rico em vasos sanguíneos e linfáticos, e pode conter nódulos
linfóides como ocorre na túnica mucosa (Gartner & Hiatt, 1999).
A terceira túnica é a muscular. Possui, em geral, uma camada de células musculares lisas,
circular interna e longitudinal externa que, atuando em conjunto, promovem a peristalse e a
segmentação (Gartner & Hiatt, 1999).
A túnica serosa, mais externa, é formada por tecido conjuntivo frouxo envolto por
mesentério (Dellmann & Brown, 1982).
DESENVOLVIMENTO INTESTINAL PÓS-ECLOSÃO
Grandes alterações morfológicas e fisiológicas como a proliferação, diferenciação,
maturação celular, apoptose e na estrutura da mucosa do intestino delgado ocorre nos primeiros
dias após a eclosão (Dibner & Richards, 2004)
ENTERÓCITOS
A ontogenia dos enterócitos do pintainho pode ser dividida em dois períodos. Nas
primeiras 24 horas após a eclosão, os enterócitos adquirem polaridade e uma membrana de borda
em escova distinta. O segundo período envolve a hipertrofia, que é expresso principalmente pelo
aumento do comprimento da célula, assim ganham morfologia típica de enterócitos em 24 horas
pós-eclosão (Geyra et al., 2001a).
O número de enterócitos das vilosidades aumenta, mas ao longo dos vilos a densidade dos
enterócitos não se altera de forma significativa ao longo deste período no duodeno e no íleo, mas
aumentaram ligeiramente no jejuno (Uni et al., 1995b; Uni et al., 1996).
Todos os enterócitos do intestino delgado estão em proliferação à eclosão. Com a idade, a
proporção de células em proliferação diminui rapidamente atingindo 50% nas criptas entre 24-48
hs e, ao longo do vilo a proporção de enterócitos em proliferação decresce rapidamente atingindo
8
6-15% 10 dias após a eclosão (Geyra et al., 2001b).
CÉLULAS CALICIFORMES
Após a eclosão e até o 7o dia pós-eclosão, os segmentos proximal, médio e distal do
intestino delgado contem proporções semelhantes de células caliciformes produtoras de mucinas
ácidas e neutras. Um aumento na densidade de células caliciformes é observado ao longo do
duodeno em relação ao eixo do íleo (Uni et al., 2003b).
As células caliciformes constitui cerca de 23 % das células epiteliais intestinais no jejuno e
26% no íleo no dia da eclosão e esta proporção permanece semelhante durante o 7o dia após o
nascimento. O número de células caliciformes por unidade de área aumenta no duodeno, jejuno e
íleo com a idade, contudo, o aumento da densidade das células caliciformes é mais rápida no
jejuno e íleo. Não há diferenças na densidade das células caliciformes ácidas ou neutras foram
observados após a eclosão (Uni et al., 2003b).
VILOSIDADE
O desenvolvimento da mucosa intestinal pode ser mensurado pelo aumento da altura e
quantidade dos vilos, o que corresponde a um aumento em número de suas células epiteliais
(enterócitos, células caliciformes e enteroendócrinas). Esse processo decorre primariamente de
dois eventos citológicos associados: renovação celular (proliferação e diferenciação), resultante
das divisões mitóticas sofridas por células totepotentes (“stem cells”) localizadas na cripta e ao
longo dos vilos, e perda de células (extrusão) (apoptose), que ocorre normalmente no ápice dos
vilos. O equilíbrio entre esses dois processos determina o “turnover” (síntese-migração-extrusão)
constante, ou seja, a manutenção do tamanho dos vilos e, portanto, a manutenção da capacidade
digestiva e de absorção intestinal (Maiorka et al., 2002; Maiorka et al., 2003).
No momento da eclosão, basicamente, todas as células estão em proliferação, mas a
mitose torna-se restrita às criptas em desenvolvimento durante as primeiras 72 horas após a
eclosão (Geyra et al., 2001a).
O volume das vilosidades é ampliado de três a cinco vezes no intestino delgado próximo de
eclosão. No duodeno, o maior aumento no volume das vilosidades ocorre antes ou aos 4 dias de
idade e a taxa de crescimento diminui em seguida. Em contraste, no jejuno e íleo, o aumento do
volume das vilosidades foi mantido até 10 dias de idade, após o que a taxa de crescimento diminui
9
(Uni et al., 1995). O volume das vilosidades no duodeno atinge um patamar após 7 dias embora
continue a aumentar no jejuno e íleo (Uni et al., 1998a).
Entretanto, o aumento no volume do vilo com a idade é maior no jejuno e no íleo que no
duodeno, e neste segmento intestinal um aumento significativo na absorção ocorre no 7o-14o dia
de idade (Noy & Sklan, 1995).
A altura do vilo aumenta duas vezes em 48 horas após a eclosão e atinge o seu máximo em
6-8 dias no duodeno e depois de 10 dias no jejuno e íleo (Geyra et al., 2001a).
A área de superfície das vilosidades aumenta de forma constante no duodeno e contínua
até o 10o dia de idade, enquanto que as superfícies das vilosidades do jejuno e do íleo aumentam
mais lentamente após o 4o dia pós-nascimento (Geyra et al., 2001a). Assim, a área do vilo do
duodeno torna-se maior que do jejuno e íleo (Iji et al., 2001).
O maior número de vilosidades por secção transversal intestinal à eclosão foi encontrado
no íleo. No duodeno e jejuno do número de vilosidades por secção transversal intestinal aumenta
após a eclosão, atingindo um patamar após 72 horas no duodeno e 216 horas no jejuno (Geyra et
al., 2001a) .
Diferentes padrões de desenvolvimento temporal das vilosidades são observados no
duodeno, jejuno e íleo (Geyra et al., 2001a) .
Uni et al. (1998b) relataram que o crescimento das vilosidades duodenais estava quase
completa no 7o dia, enquanto que no jejuno e íleo houve desenvolvimento continuado para além
do dia 14. Estes resultados são paralelos à medição do comprimento da massa do intestino e com
a idade (Obst & Diamond, 1992).
O crescimento do vilo na ave jovem é estimulado pela presença do alimento no lume
intestinal e envolve a produção de células nas criptas que atingem a maturidade ao migrarem
ascendentemente pelo vilo (Moran Jr., 1985). O acesso ao alimento aumenta consideravelmente a
altura do vilo, enquanto que a privação prejudica o desenvolvimento do vilo e diminui o tempo de
turnover das células epiteliais (Uni et al., 1995a).
CRIPTA
Embora as criptas intestinais sejam pequenas e rudimentares e somente uma cripta por
vilo seja observada à eclosão, o número destas estruturas aumenta rapidamente logo após a
eclosão (Uni et al., 2000, Geyra et al., 2001a).
As criptas começam a se formarem no dia da eclosão e se definem dentro de 2 a 3 dias,
10
aumentando tanto em número de células quanto em tamanho (Uni et al., 2000; Geyra et al.,
2001a).
O aumento na profundidade da cripta com a idade é observado em todos segmentos do
intestino delgado, sendo que no duodeno e jejuno estabiliza-se no 14o dia de idade, e no íleo no
28o dia (Marchini et al., 2011). Concomitantemente, o número de células por cripta aumenta até o
4o dia pós-eclosão (Uni et al., 2000). O aumento no número e no tamanho das criptas tem dois
efeitos diretos: fornecimento de enterócitos para aumentar a área de superfície de absorção
intestinal à medida que as vilosidades crescem e aumento da taxa de renovação celular (Geyra et
al., 2001a). Portanto, o aumento no tamanho e no número de células na cripta é sugestivo de um
potencial aumento da proliferação celular embora a população de células tende a declinar com a
idade em todos os segmentos do intestino delgado (Iji et al., 2001).
PROLIFERAÇÃO
A diferenciação das células epiteliais do intestino pode ser medida pela relação entre
células apoptóticas e em proliferação (Jeurissen et al., 2002). A proliferação de células epiteliais
intestinais em frangos não se restringe à cripta, mas ocorre também ao longo da vilosidade
durante a primeira semana após a eclosão (Uni et al., 1998b). Entretanto, este padrão muda
rapidamente com a idade, sendo que a maioria das células PCNA-positivas são localizadas nas
criptas e na região proximal do vilo. Na 3a semana de idade; a maioria (55%) das células na cripta
estavam em proliferação, 32% na metade inferior de vilo e 8% no ápice (Uni et al., 1998a). Após a
proliferação, as células migram e se diferenciam em direção ao ápice da vilosidade. Em seguida, as
células tornam-se apoptóticas e deixam a camada mucosa. Uma diferença na proporção entre a
apoptose e a proliferação pode indicar se a mucosa intestinal tem uma diferenciação equilibrada
(Jeurissen et al., 2002).
À eclosão, quase todas as células estão em proliferação, no entanto, a proporção de células
PCNA positivas na cripta diminui rapidamente com o tempo, em todos os três segmentos do
intestino, atingindo cerca de 50% das células em proliferação em 72 horas após esse período
(Geyra et al., 2001a).
A maior parte da divisão de enterócitos ocorre nas criptas e é seguido por uma migração
das células em direção ao ápice do vilo. No entanto, em contraste com os mamíferos, a
proliferação dos enterócitos no jejuno do pintainho também ocorre ao longo das vilosidades (Uni
et al., 1998b). As células sofrem diferenciação à medida que migram, tornando-se enterócitos
11
absortivos funcionais, células caliciformes ou células enteroendócrinas. Quando as células
alcançam o ápice das vilosidades, elas sofrem apoptose e são eliminadas para o lúmen intestinal.
Esta é um fenômeno altamente coordenado, com descamação das células mortas equilibrada pela
substituição de células imaturas pela atividade mitótica das células pluripotentes das criptas. Este
epitélio renova-se mais rapidamente do que qualquer outro tecido do organismo (Imondi & Bird,
1966).
A taxa de migração celular aumenta com a idade. Em pintos com 1 dia e 7 dias de idade, a
migração completa ocorreu em 96 horas após o nascimento da célula, quando atinge a zona de
extrusão, no ápice do vilo. No 14o dia, a migração do enterócito dura 96 horas em aves mais velhas
(Uni et al., 1998a; Geyra et al., 2001a).
APOPTOSE
No ápice da vilosidade, as células epiteliais sofrem apoptose e são descartadas para o
lúmen intestinal. O tempo de vida médio das células epiteliais é de 48-72 horas (Jeurissen et al.,
2002).
A apoptose pode ser desencadeada quando as células recebem estímulos que induzem à
morte celular. Entre este estímulos está a falta de nutrientes para o metabolismo celular. Privação
de glutamina em ratos induz à apoptose, sugerindo que a glutamina serve como fator específico
de sobrevivência dos enterócitos (Ramachandran et al., 2000).
INTESTINO
O crescimento do intestino e de outros órgãos se faz por hiperplasia ou hipertrofia celular,
ou a combinação de ambos processos. É mais intenso entre a eclosão e o 7o dia de idade e é
acompanhado principalmente pelo aumento no tamanho das células (hiperplasia) (Iji et al., 2001).
O crescimento preferencial dos intestinos na fase inicial ocorre na presença ou ausência de
alimento, embora na falta de alimento este crescimento ocorra mais lentamente (Noy & Sklan,
1999).
O comprimento intestinal e de seus segmentos aumenta com a idade (Iji et al., 2001,
Marchini et al., 2011). Embora o comprimento intestinal aumente cerca 20-30% e entre 5 a 10%
no seu diâmetro externo entre o 4o e 14o dia de idade, a ingestão de alimento aumenta em 5 a 8
vezes (Uni et al., 1995a).
O aumento temporal no peso e no comprimento do intestino ocorrem de forma
diferenciada nos diferentes segmentos intestinais, sendo que o duodeno apresenta crescimento
12
mais rápido que o jejuno e o íleo (Uni et al., 1999).
À eclosão os três segmentos do intestino delgado apresenta áreas de superfície
semelhantes que aumentaram na mesma forma com até 72 h. No entanto, após este tempo, a
área de superfície do jejuno aumentou mais do que nos outros segmentos intestinais, atingindo
valores duas vezes mais elevados que nos outros segmentos intestinais (Geyra et al., 2001a).
O duodeno é o segmento intestinal de maior área de absorção, uma vez que apresenta
maior densidade e altura de vilos comparado ao jejuno, que por sua vez apresenta maior
densidade e altura de vilos comparado ao íleo (Uni et al., 1995a).
O TGI tem sido considerado como fator limitante na ingestão da ração e crescimento de
linhagens selecionadas para alto peso corporal (Nitsan et al., 1991).
No primeiros dias pós-eclosão o peso relativo do TGI aumenta mais rapidamente que o
peso corporal (Sell et al., 1991) e tem seu pico ao 7 dias de idade e declina subsequentemente (Iji
et al., 2001). Mudanças no tamanho de TGI e na mucosa intestinal (Cook & Bird, 1973) altera a
taxa de passagem e a eficiência de absorção.
Na eclosão, as alterações fisiológicas dentro do intestino permite ao pintainho passar de
uma fonte de nutriente (gema) constituída essencialmente por lipídeos para uma dieta que
contém carboidratos. Tecidos gastrointestinais e a superfície de absorção do intestino delgado
desenvolvem mais rapidamente do que outros tecidos, como o músculo (Lilja, 1983). Essas
alterações ocorrem em todas as três secções do intestino: no duodeno, jejuno e íleo. Faz todo o
sentido que o sistema digestório deve se desenvolver para fornecer a energia e os nutrientes para
a manutenção e maturação de outros sistemas corporais. Vários fatores podem influenciar a taxa
de maturação intestinal, incluindo estresse, estado de saúde e disponibilidade de nutrientes
(Fairchild, 2002).
Práticas usuais de incubação resultam em uma transição de 24 a 48 horas entre o
nascimento e o alojamento das aves. O acesso ao alimento é, assim, atrasado e pode diminuir o
crescimento pela diminuição no desenvolvimento da mucosa intestinal (Uni et al., 1998a). O jejum
durante 36 horas resulta inicialmente em crescimento retardado em todos os segmentos do
intestino. No jejuno, onde o crescimento em pintos normais continua após 7 dias de idade, o
tamanho das vilosidades permanecem menores até o 11 o dia, no entanto, a diminuição inicial do
tamanho do duodeno e do íleo foi superada em 5 dias. A profundidade de criptas, que continuou a
aumentar em todo o intestino em pintos normais, diminui com o jejum de 36 horas. Além do
crescimento mais lento em pintos mantidos durante 36 horas sem alimentação, observa-se
alterações na estrutura da cripta entre 7 e 9 dias. O acesso retardado ao alimento pode também
13
diminuir a área da superfície das vilosidades no jejuno aos 3 e 4 dias e no íleo no segundo dia de
idade em comparação com animais alimentados. Após a alimentação, a área de superfície das
vilosidades aumenta e tende a ser mais parecida com a das aves alimentadas (Uni et al., 2003b).
Estas alterações podem refletir na falta de nutrientes para a síntese celular na ausência de
alimentação. A regressão das criptas e o atraso na produção de enterócitos pode explicar o
retardamento do crescimento nestes pintainhos (Uni et al., 1998a).
A densidade das células caliciformes, que contém mucinas ácidas e neutras aumenta em
aves em jejum no duodeno no 2o dia e no jejuno aos 2 e 3 dias de idade. Mudanças na dinâmica de
mucina pode afetar as funções de absorção e proteção do intestino delgado. No entanto, não só o
número de células caliciformes muda, mas tamanho e o volume das células caliciformes está
igualmente alterado em pintos em jejum (Uni et al., 2003b).
A camada de muco no intestino delgado desempenha papel importante na proteção das
células epiteliais do intestino delgado e no transporte entre o lúmen e a membrana com borda em
escova e, assim, a ontogenia do seu desenvolvimento pode afetar as funções de absorção e de
proteção do intestino delgado (Uni et al., 2003).
Na primeira semana o intestino delgado incrementa seu peso mais rapidamente que a
massa corporal e com rápidas trocas morfológicas no crescimento das vilosidades no duodeno,
jejum e íleo. A taxa acelerada de desenvolvimento após o nascimento se reflete no
desenvolvimento do intestino e, por conseguinte na superfície de absorção (Geyra et al., 2001a,b;
Uni et al., 2003).
ATIVIDADE ENZIMÁTICA PÓS-ECLOSÃO
No período inicial pós-eclosão, a ave jovem deve fazer a transição da dependência
metabólica da nutrição endógena proveniente da gema rica em lipídios para a alimentação
exógena rica em carboidratos e proteínas. Esta transição é um pré-requisito para o crescimento
rápido e envolve mudanças dramáticas no trato gastrointestinal, incluindo a secreção de enzimas
digestivas e o início da absorção de aminoácidos e hexoses (Uni et al., 1995a) .
Parelelamente às alterações morfológicas do intestino delgado, a capacidade do intestino
para digerir e absorver os nutrientes aumentam de forma constante durante a primeira semana
após a eclosão (Uni et al., 1999; Sklan, 2001). A atividade da enzima do pâncreas é observada no
intestino delgado antes da eclosão e aumenta após o nascimento (Sklan & Noy, 2000). Além disso,
a atividade das enzimas na borda em escova dos enterócitos também aumentam rapidamente nos
dias pós-nascimento (Uni et al., 1999). No intestino delgado a máxima atividade da lipase foi
14
observada no 4o dia de idade, da tripsina e da quimiotripsina, no 11 o e da amilase no 17o (Nitsan et
al., 1991).
A diminuição na taxa de passagem é observada especialmente no duodeno, o maior local
de atividade de enzimas e de absorção de nutrientes. A atividade enzimática decresce distalmente
no intestino delgado com a idade. A produção de lipase, tripsina, secreções biliares (incluindo sais
biliares e ácidos graxos) e secreção de amilase aumenta com a idade (4 a 21 dias) no duodeno
enquanto que o consumo de ração aumenta aproximadamente sete vezes neste mesmo período.
Concomitantemente ocorre a diminuição na taxa de passagem para que haja a suficiente
atividade enzimática por hidrólise e absorção de açúcares e lipídeos. Porém, a proteólise é mais
limitada nos primeiros dias após a eclosão (Noy & Sklan, 1995).
O progressivo aumento da área de absorção, das secreções pancreáticas e da capacidade
hidrolítica na mucosa intestinal sugerem que a ingestão de ração, crescimento intestinal com a
idade da ave e atividade enzimática são eventos coordenados nas aves jovens para manter a
eficiência na absorção dos nutrientes (Sklan, 2001).
Enormes alterações na estrutura microscópica do sistema gastrointestinal ocorrem na
primeira semana após a eclosão, assim como ao longo da vida da ave, seguida de várias mudanças
dietéticas (Dibner, 1996). As células epiteliais intestinais têm elevada taxa metabólica para
suportar suas funções secretória e absortiva e são constantemente renovadas pela proliferação de
células-tronco nas criptas (Sell et al., 1991).
Durante as primeiras semanas de vida, o enorme crescimento do sistema GI não só
ultrapassa o de outros sistemas, mas também é essencial devido à sua capacidade de digerir
eficientemente os ingredientes da dieta de aves, uma vez que a ave deve alcançar seu potencial
genético (Sell et al., 1991). O intestino, como a principal interface entre um organismo e seu
ambiente nutricional, desempenha papel crítico no desenvolvimento da ave recém-eclodida (Noy
& Sklan, 1995).
O desenvolvimento intestinal pode limitar o crescimento de aves na primeira semana de
vida. Fatores tais como atraso no fornecimento da alimentação ou a presença de contaminantes
na dieta podem retardar o desenvolvimento do sistema gastrointestinal na ave jovem e, deste
modo, ter um efeito negativo sobre o desempenho e eficiência produtiva (Dibner, 1996).
15
DESENVOLVIMENTO COMPARATIVO DO APARELHO DIGESTÓRIO DE FRANGOS DE CRESCIMENTO
LENTO E RÁPIDO
Os efeitos da seleção no peso corporal dos animais resultam em diferenças entre as
linhagens com relação ao tamanho relativo dos órgãos ao nascimento e durante seu crescimento.
Rougiére et al. (2009) e Verdal et al. (2010) afirmaram existir particularidades nas características
morfológicas dos órgãos digestivos e da mucosa intestinal entre linhagens divergentes quanto ao
aproveitamento nutricional. Segundo estes autores aves com maior compartimento gástrico
(proventrículo e moela) teriam a eficiência digestiva superior em relação àquelas que apresentam
maior desenvolvimento do intestino delgado.
Assim, Santos (2012) afirmou que é necessária a realização de estudos mais
aprofundados referentes ao conhecimento das particularidades do trato gastrintestinal de
diferentes linhagens e melhor aplicar os conceitos relativos ao fornecimento de nutrientes, sua
digestão e metabolismo no organismo dos diferentes genótipos. A autora comparou dados
biométricos de orgãos digestórios e da mucosa intestinal de frangos de corte de crescimento lento
(Isa Label) e rápido (Cobb). Neste estudo, observou-se maior peso relativo dos órgãos digestórios
nas aves de crescimento lento, excetuando-se o peso do intestino delgado aos 42 dias de idade.
Não houve diferenças entre as linhagens para o peso relativo do fígado e do intestino grosso (sete
dias de vida), do intestino delgado (21 dias de idade) e do fígado (42 dias de idade). O peso
relativo do pâncreas não diferiu entre as linhagens nas diferentes idades de avaliação (Tabela 1).
Tabela 1. Peso corporal, comprimento do tratogastrintestinal (TGI) e peso relativo (%) de órgãos
do sistema digestório de frangos de corte de crescimento lento (Isa Label) e rápido (Cobb) aos 7,
21 e 42 dias de idade
I Label
2
Varáveis
PC (g)
TGI (cm)
E+P, %
Prov+M, %
ID, %
IG, %
Fíg, %
Pân, %
97,7b
98,7a
1,50a
9,19a
9,44a
2,37a
3,22a
0,51a
Cobb
7 dias
142,5a
105,9a
1,28b
7,89b
7,72b
2,19a
4,16a
0,44a
CV1
2,8
5,35
7,14
8,79
5,51
13,3
15,5
9,81
I Label
Cobb
21 dias
416,90b 613,90a
141,40b 173,10a
0,85a
0,74b
6,16a
4,86b
8,24a
7,70ª
1,85a
1,48b
3,01a
2,53b
0,37a
0,32a
CV1
2,18
7,74
18,71
7,82
5,69
11,49
6,26
11,62
I Label
Cobb CV1
42 dias
1.292b 2.412a
1,91
163,90b 220,70a 8,06
0,55a
0,48b 15,28
3,63a
3,16b
7,89
3,94b
5,23a
9,61
1,23a
0,83b 18,51
2,14a
2,09a
8,08
0,24a
0,18a 18,75
1
Médias seguidas de letras distintas na linha, diferem entre si pelo teste de Tukey (5%). Coeficiente de variação, %;
2
Peso vivo (PV), esôfago + apo (E+P), proventrículo + moela (Prov+M), intestino delgado (ID), intestino grosso (IG),
fígado (Fíg) e pâncreas (Pân)
16
Aos sete dias de idade, foram observados maior altura de vilo (µm), profundidade de
cripta (µm) e relação vilo:cripta do jejuno para as aves Cobb. Também, verificou-se no íleo desta
linhagem maior altura de vilo em relação à Isa Label (Tabela 2). As demais variáveis avaliadas
apresentaram resultados semelhantes para as duas linhagens. Aos 21 dias de idade, não se
observou diferença estatística para as medidas morfométricas dos segmentos intestinais das
linhagens Isa Label e Cobb (Tabela 2). Porém, os frangos da linhagem Cobb apresentaram maior
altura de vilo do duodeno aos 42 dias de idade. Não houve diferenças estatísticas para os outras
variáveis avaliadas.
Tabela 2. Altura de vilo (µm), profundidade de cripta (µm) e relação vilo:cripta (V:C) do duodeno,
jejuno e íleo de frangos de corte de crescimento lento (Isa Label) e rápido (Cobb) aos sete, 21 e 42
dias de idade
I Label
Variáveis
Cobb CV1
Duodeno
I Label
Vilo (µm)
Cripta (µm)
V:C
755,0a
220,7a
3,47a
887,1a
233,0a
3,82a
11,47
10,29
9,94
463,9b
176,1b
2,66b
Vilo (µm)
Cripta (µm)
V:C
1.312a
301,9a
4,19a
1.278
315,8a
4,30a
9,35
5,61
6,94
914,4a
255,1a
3,91a
Vilo (µm)
Cripta (µm)
V:C
1.324b
272,1a
4,99a
1.553a
307,2a
5,15a
5,64
8,92
16,22
1.138a
223,1a
5,18a
Cobb CV1
Jejuno
7 dias
638,5ª
14,9
213,1a
9,03
3,07a
7,38
21 dias
1.001a
13,46
262,2a
22,58
3,94a
13,98
42 dias
1.029a
12,06
176,4a
13,89
5,94a
10,23
CV1
I Label
Cobb
Ileo
371,8b
151,4a
2,55a
581,3a
183,8a
3,18a
16,6
17,4
19,8
616,9a
142,5a
4,49a
643,8a
152,4a
4,74a
7,82
19,49
21,01
676,4a
120,4a
5,76a
715,7a
135,9a
5,43a
9,83
7,36
13,03
1
Médias seguidas de letras distintas na linha, diferem entre si pelo teste de Tukey (5%), Coeficiente de variação, %
Com este experimento, a autora concluiu que existem particularidades das linhagens Isa
Label e Cobb quanto ao desenvolvimento dos órgãos do sistema digestório nas diferentes idades.
Nas pesquisas de Rougiére et al. (2009) e Verdal et al. (2010) relacionou-se o maior peso do
compartimento gástrico (proventrículo + moela) ao incremento no aproveitamento energético das
rações. Especificamente, Verdal et al. (2010) verificaram que aves de alto aproveitamento
energético possuem maior atividade do proventrículo e moela, enquanto as de baixo
aproveitamento energético tem maior peso dos órgãos viscerais, comprimento e modificações
histológicas intestinais. Ainda de acordo com Verdal et al. (2010), a maior altura de vilosidades
pode ser apenas uma tentativa fisiológica de compensar a baixa funcionalidade da área gástrica.
Os autores também observaram que frangos que apresentavam menor compartimento gástrico
17
possuíam intestinos mais longos e pesados, principalmente no jejuno e íleo, tendo ainda nestes
segmentos maior altura de vilosidades e profundidade de criptas.
CONSIDERAÇÕES FINAIS
Portanto, com base neste processo, deve-se salientar a importância de adequar o
desenvolvimento intestinal à velocidade de crescimento da ave, o que reforça todo cuidado
necessário com as normas de manejo e da utilização de alimentos adequados a essas
características digestivas e fisiológicas próprias. Dietas adaptadas a esse processo são vitais para o
bom desenvolvimento intestinal nesse período.
REFERÊNCIAS
ALBERTS, B.; JOHNSON, A.; LEWIS, J.; RAFF, M.; ROBERTS, K.; WALTER, P. The airways and the gut.
2002. In: Molecular Biology of the Cell, Fourth Edition, Garland Science, New York, NY. pp. 12751276.
ANTHONY, N. B.; DUNNINGTON, E. A.; SIEGEL, P. B. Embryo h of normal and dwarf chickens from
and low56-day body weight. Archiv fur Geflugelkunde, v. 53, p.116 – 122, 1989.
ARTONI, S. M. B. Anatomia do sistema digestório das aves. In: Curso de Fisiologia da Digestão e
Metabolismo de Nutrientes em Aves, UNESP Jaboticabal, Out. 2004. 1 CD-ROM.
BALS, R. 2000. Epithelial antimicrobial peptides in host defense against infection. Resp. Res. 1:141150.
BOLELI, I. C.; MAIORKA, A.; MACARI, M. Estrutura funcional do trato digestório. In: MACARI, M.;
FURLAN, R. L.; GONZALES, E. (Ed.). Fisiologia Aviária aplicada a frangos de corte. 2. ed. Jaboticabal:
FUNEP/UNESP, 2002. p. 75-95.
BUDDINGTON, R. Intestinal nutrient transport during ontogeny of vertebrates. American Journal
of Physiology, v.32, p. R503– R509, 1992.
BUDDINGTON, R.; DIAMOND, J. 1989. Ontogenetic development of intestinal nutrient
transporters. Annu. Rev. Physiol. 51:601–619.
CAMPOS, E. J. Nutrição da matriz e do embrião. In: Manejo da incubação. Campinas: FACTA,
Fundação Apinco de Ciências e Tecnologia Avícolas, 2003. cap. 4, p. 454-470
COOK, R. y BIRD, F. (1973) Poultry Sci. 52, 2276-2280.
CROSNIER, C.; STAMATAKI, D.; LEWIS, J. Organizing cell renewal in the intestine: stem cells, signals
and combinatorial control. NATURE REVIEWS | GENETICS, VOLUME 7 | MAY 2006 | 349-359).
DELLMANN, H. D; BROWN, E. M. Histologia veterinária, Rio de Janeiro: Guanabara Koogan, 1982,
397 p.
DIBNER, J. J.; KITCHELL, M. L.; ATWELL, C. A.; IVEY, J. The effect of dietary ingredients and age on
the microscopic structure of the gastrointestinal tract in poultry. Journal of Applied Poultry
Research, v.5, p.70-77, 1996.
18
DIBNER, J. J.; KNIGHT, C.; YI, G. F.; RICHARDS, J. D. Gut Development and Health in the Absence of
Antibiotic Growth Promoters. Asian-Australasian Journal of Animal Science v. 20, n. 6: 1007 - 1014,
2007
DIBNER, J. J.; RICHARDS, J. D. The Digestive System: Challenges and Opportunities. Journal of
Applied Poultry Research, v.13, p.86–93, 2004.
DIBNER, J. Nutritional requirements of young poultry. In: MEETING OF ARKANSAS NUTRITION
CONFERENCE, 1996, Fayetteville. Proceedings... Fayetteville: Arkansas Poultry Federation, 1996.
p.15-27.
ESTEBAN, S.; RAYO, J. M.; MORENO, M.; SASTE, M.; RIAL, R.; TUR, J. 1991. A role played by the
vitelline diverticulum in the yolk sac resortion in young posthatched chickens. J. Comp. Phys.
FAIRCHILD, B. D. Broiler tip … Early chick development. Disponível em
http://www.poultry.uga.edu/extension/tips/documents/2002%20May%20B%20tip%20B%20F_LH.
web.pdf
FREEMAN, B. M., VINCE, R. L. 1974. Development of the Avian Embryo. Chapman and Hall,
London.
GARTNER, L. P.; HIATT, J. L. Tratado de Histologia, Rio de Janeiro: Guanabara Koogan, 1999, 426 p.
GEYRA, A.; UNI, Z.; SKLAN, D. Enterocyte dynamics and mucosal development in the posthatch
chick. Poultry Science, v.80, p.776–782, 2001a
GEYRA, A.; UNI, Z.; SKLAN, D. The effect of fasting at different ages on growth and tissue dynamics
in the small intestine of the young chick. British Journal of Nutrition, v.86, p.53-61, 2001b.
IJI, P. A.; SAKI, A.; TIVEY, R. Body and intestinal growth of broiler chicks on a comercial starter diet.
I. Intestinal weight and mucosal development. British Poultry Science, v. 42, n. 4, p. 505-513, 2001.
IMONDI, A.; BIRD, F. The turnover of intestinal epithelium in the chick. Poultry Science v. 45,
p.142-147, 1966.
JEURISSEN, S. H. M.; LEWIS, F.; VAN DER KLIS, J. D.; MROZ, Z.; REBEL, J. M. J.; TER HUURNE, A. A. H.
M. Parameters and techniques to determine intestinal health of poultry as constituted by
immunity, integrity, and functionality. Current Issues on Intestinal Microbiology, v.3, p.1-14, 2002.
KROGDAHL, A., SELL, J.. Influence of age on lipase, amylase, and protease activities in pancreatic
tissue and intestinal contents of young turkeys. Poultry Science, v.68, p.1561–1568, 1989.
LILJA, C.. A comparative study of postnatal growth and organ development in some species of
birds. Growth, v.47, p.317-339, 1983.
MAIORKA, A., BOLELI, I. C., MACARI, M. Desenvolvimento e reparo da mucosa intestinal. In:
MACARI, M.; FURLAN, R.L.; GONZALES, E. (ed.). Fisiologia Aviária: Aplicada a frangos de corte. 2
ed. Jaboticabal: FUNEP, 2002. p. 113-123.
MAIORKA, A.; ROCHA, C. Dietas iniciais, desenvolvimento do trato gastrointestinal e impacto sobre
o desempenho de frango de corte. V Intestinal Health Food Safety Seminar, 2009.
MAIORKA, A; BOLELI, I. C.; MACARI, M. Desenvolvimento e reparo da mucosa intestinal. In:
Fisiologia aviária aplicada a frangos de corte. Campinas: FACTA, Fundação Apinco de Ciências e
Tecnologia Avícolas, 2002. cap. 8, p. 113-124.
MAIORKA, E. SANTIN, F. DAHLKE, I. C. BOLELI, R. L. FURLAN, M. MACARI. Posthatching Water and
Feed Deprivation Affect the Gastrointestinal Tract and Intestinal Mucosa Development
of Broiler
Chicks. Journal of Applied Poultry Research, v.12, p.483–492, 2003.
19
MARCHINI, C. F. P.; SILVA, P. L.; NASCIMENTO, M. R. B. M., BELETTI, M. E.; SILVA, N. M.;
GUIMARÃES, E. C. Body weight, intestinal morphometry and cell proliferation of broiler chickens
submitted to cyclic heat stress. International Journal of Poultry Science, v.10, n.6, p. 455-460,
2011.
MOORE, K. L.; PERSAUD, T. V. N. Embriologia básica. Elsivier do Brasil, 365 páginas, 2008.
MORAN JR, E. T.Nutrition of the Developing Embryo and Hatchling. Poultry Science, v. 86, p.10431049, 2007.
MORAN JR., E.T. 1985. Digestion and absorption of carbohydrates in fowl and events through
perinatal development. Journal of Nutrition, v.115, n.2, p.665-671.
NITSAN, Z.; BEN-AVRAHAM, G.; ZOREF, Z.; NIR, I. Growth and development of digestive organs and
some enzymes in broiler chicks after hatching. British Poultry Science, v. 32, p. 515-523, 1991.
NOBLE, R. C.; OGUNYEMI, D. Lipid changes in the residual yolk and liver of the chick immediately
after hatching. Biology of the neonate, 56: 228-236, 1989.
NOY, Y., SKLAN, D. Energy utilization in newly hatched chicks. Poultry Science, v.78, p.1750-1756,
1999.
NOY, Y.; SKLAN, D. Digestion and absorption in the young chick. Poultry Science, v. 74, n. 2, p. 366373, 1995.
NOY, Y.; UNI, Z.; SKLAN, D. Routes of yolk utilization in the newly hatched chick. Poultry Science,
v.75 (Suppl. 1), p.13, 1996 (Abstr.).
OBST, B. S.; DIAMOND, J. 1992. Ontogenesis of intestinal nutrient transport in domestic chickens
(Gallus gallus) and its relation to growth. Auk 109:451–464.
OLAH, I. GLICK, B. 1984. Meckels diverticuluum. 1. Extramedullary myelopoiesis in the yolk sac of
hatched chickens (Gallus domesticus). Anat. Rec. 208:243-252.
OLIVEIRA, J. E.; DRUYAN, S.; UNI, Z.; ASHWELL, C. M.; FERKET, P. R. Prehatch intestinal maturation
of turkey embryos demonstrated through gene expression patterns Poultry Science, v. 88,
p.2600–2609, 2009.
OZAYDIN, T.; CELIK, I. Histological, histochemical and immunohistochemical investigations on the
developing small intestines of broilers embryos. Journal of Animal and Veterinary Advances, v. 11,
n. 16, p. 2936-2944, 2012.
QUIGLEY, J., 2001. Calf Note #34-Intestinal mucin. In: Calf Notes.com. Disponível em
http://www.calfnotes.com/pdffiles/CN034.pdf
RAMACHANDRAN, A., MADESH M., BALASUBRAMANIAN, K. A. Apoptosis in the intestinal
epithelium: its relevance in normal and pathophysiological conditions. J. Gastroenterology and
Hepathology, v. 15, n. 2, p. 100-120, 2000.
SANTOS, T. T.; CORZO, A.; KIDD, M. T.; MCDANIEL , C. D.; TORRES FILHO, R. A.; ARAÚJO, L. F.
Influence of in ovo inoculation with various nutrients and egg size on broiler performance. Journal
of Applied Poultry Research, v. 19, p. 01-12, 2010.
SELL, J. L.; ANGEL, C. R.; PIQUER, F. J.; MALLARNO, E. G.; AI-BATSHAN, H. A.. Developmental
patterns of selected characteristics of the gastrointestinal tract of young turkeys. Poultry Science,
v.70, p. 1200-1205, 1991.
SKLAN, D. Development of the digestive tract of poultry. World’s Poultry Science Journal, v. 57, n.
4, p415-428, 2001.
20
SKLAN, D., NOY, Y. Hydrolysis and absorption in the small intestines of posthatch chicks Poultry
Science, v.79, n.9, p.1306–1310, 2000.
SKLAN, D.; GEYRA, A.; TAKO, E.; GAL-GABER, O.; UNI, Z. 2003. Ontogeny of brush border
carbohydrate digestion and uptake in the chick. Br. J. Nutr. 89:747–753.
SUGIMOTO, Y.; SANUKI, S.; OHSAKO, S.; HIGASHIMOTO, Y.; KONDO, M.; KURAWAKI, J.; IBRAHIM,
H. R.; AOKI, T.; KSUSAKABE, T.; KOGA, K. Ovalbumin in developing chicken eggs migrates from egg
white to embryonic organs while changing its conformation and thermal stability. The Journal of
Biological Chemistry. 274:11030–11037, 1999.
SULAIMAN, A.; PEEBLES, E.; PANSKY, T.; KELLOGG, T.; MASLIN, W.; KEIRS, R. Histological evidence
for a role of the yolk stalk in gut absorption of yolk in the post- hatch broiler chick. Poultry Science
75(Suppl. 1):48, 1996. (Abstr.)
TONA, K.; BAMELIS, F.; KETELAERE, B.; BRUGGEMAN, V.; MORAES, V. M. B.; UNI, Z.; TAKO, E.; GALGARBER, O.; SKLAN, D. Morphological, molecular, and functional changes in thechicken small
intestine of the late-term embryo. Poultry Science, v. 82, p.1747–1754, 2003.
UNI Z, SMIRNOV A AND D. SKLAN. Pre- and Posthatch Development of Goblet Cells in the Broiler
Small Intestine: Effect of Delayed Access to Feed. 2003 Poultry Science 82:320–327
UNI Z, GANOT S, SKLAN D. 1998. Posthatch development of mucosal function in the broiler small
intestine.PoultryScience77:75-82.
UNI Z, TAKO E, GAL-GARBER O, SKLAN D. 2003. Morphological, molecular and functional changes
in the chicken small intestine of the late-term embryo.PoultryScience82:1747-1754.
UNI Z. NOY, Y. y SKLAN, D. 1996 Br. Poultry Sci. 36, 63-71.
UNI Z.; NOY, Y.; SKLAN, D. 1999.Posthatch development of small intestinal function in the
poultry.Poultry Science, v.78, n.1, p.215-222.
UNI, Z., GEYRA, A.; BEN-HUR, H.; SKLAN, D. Small intestinal development in the Young chick: crypt
formation and enterocyte proliferation and migration. Br. Poult. Sci., 41(5): 544-551, 2000.
UNI, Z., NOY, Y.; SKLAN, D. 1999. Posthatch development of small intestinal function in the poult.
Poult. Sci. 78:215–222.
UNI, Z.; FERKET, R. P. Methods for early nutrition and their potential. World’s Poultry Science
Journal, v. 60, p. 101-111, Mar. 2004.
UNI, Z.; NOY, Y.; SKLAN, D. 1996. Developmental parameters of the small intestines in heavy and
light strain chicks pre- and post-hatch. Br. Poultry Sci. 36: 66-71.
UNI, Z.; NOY, Y.; SKLAN, D. Development of the small intestine in heavy and light strain chicks
before and after hatching. Br. Poult. Sci., v. 36, p.63-71, 1995b.
UNI, Z.; NOY, Y.; SKLAN, D. Posthatch changes in morphology and function of the small intestines
in heavy- and light-strain chicks. Poultry Science, v. 74, n. 10, p. 1622-1629, 1995a.
UNI, Z.; PLATIN, R.; SKLAN, D. Cell proliferation in chicken intestinal epithelium occurs both in the
crypt and along the villus. J. Comp Physiol B, 168(4): 241-247, 1998b.
UNI, Z.; SMIRNOV, A.; SKLAN, D. Pre- and posthatch development of goblet cells in the broiler
small intestine: effect of delayed access to feed. Poultry Science, 82:320–327, 2003.
UNI, Z.; TAKO, E.; GAL-GARBER, O. SKLAN, D. Morphological, molecular, and functional chages in
the chickens small intestine of the late-term embryo. Poultry Science, Champaign, v. 82, p. 17471754, 2003.
21
UNI, Z.; TAKO, E.; GAL-GARBER, O.; SKLAN, D. Morphological, Molecular, and Functional Changes in
the Chicken Small Intestine of the Late-Term Embryo. 2003, Poultry Science, 82:1747–1754.
van der FLIER, L.G.; CLEVERS, H. (2009). Stem cells, self-renewal, and differentiation in the
intestinal epithelium. Annu. Rev. Physiol. 71: 241–260.
VAN DIJK, J.; HUISMAN, J.; KONINKX, J. 2002. Structural and functional aspects of a healthy
gastrointestinal tract. In: Structural and functional aspects of a healthy gastrointestinal tract. In:
Nutrition and Health of the Gastrointestinal Tract. (Ed. M. Blok, H.
VIEIRA, S. L. Digestão e utilização de nutrientes após a eclosão de frangos de corte. 2004. V
SIMPÓSIO BRASIL SUL DE AVICULTURA 05 a 07 de abril de 2004 – Chapecó, SC – Brasil. P. 26-41.




![Alimentação seleciona tipo de flora intestinal [em humanos].](http://s1.studylibpt.com/store/data/005364369_1-848e597800655660c691a1b0cee4b7cd-300x300.png)