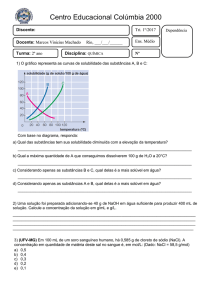
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
06, 07, 08 e 11/07/2015
Termoquímica II
1. . (BRASÍLIA) A energia de ligação média para a ligação C – H no metano CH4(g) é
aproximadamente:
Dados: ΔHf0 (entalpia de formação-padrão)
CH4(g) = -17,9 kcal/mol
H(g) = +52,1 kcal/mol
C(g) = +170,9 kcal/mol
a) +99 kcal/mol
b) +60 kcal/mol
c) +73 kcal/mol
d) +397 kcal/mol
2. (FGV-SP) Em um conversor catalítico, usado em veículos automotores em seu cano de escape
para redução da poluição atmosférica, ocorrem várias reações químicas, sendo que uma das
mais importantes é:
1 CO(g) + ½ O2(g) → 1 CO2(g)
Sabendo-se que as entalpias das reações citadas abaixo são:
C(grafita) + ½ O2(g) → CO(g) ∆H1 = -26,4 kcal
C(grafita) + O2(g) → CO2(g) ∆H2 = -94,1 kcal:
a) exotérmica e absorve 67,7 kcal/mol.
b) exotérmica e libera 120,5 kcal/mol.
c) exotérmica e libera 67,7 kcal/mol.
d) endotérmica e absorve 120,5 kcal/mol.
e) endotérmica e absorve 67,7 kcal/mol.
3. (UERJ/2005) As equações químicas a seguir representam reações de síntese, realizadas em
diferentes condições, para a obtenção de uma substância hipotética XY.
I. X2(g) + Y2(g) → 2 XY (l) + Q1
II. X2(g) + Y2(g) →2 XY (s) + Q2
III. X2 (g) + Y2(g) →2 XY (g) + Q3
Considere Q1, Q2 e Q3 as quantidades de calor liberadas, respectivamente, nas reações I, II e III.
A relação entre essas quantidades está expressa na seguinte alternativa:
a) Q1 > Q2> Q3
b) Q2 > Q1> Q3
c) Q3 > Q1> Q2
d) Q3 > Q2> Q1
4. (Uel) Sabendo que a combustão completa da glicose com ar libera cerca de 1 x 10 2 kcal/mol de
oxigênio (O2), a energia liberada na queima de 5 mols de glicose, será, em kcal,
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
06, 07, 08 e 11/07/2015
Dado: Glicose = C6H12O6
a) 1 x 103
b) 2 x 103
c) 3 x 103
d) 4 x 103
e) 5 x 103
5. (Unitau) Temos a reação:
2ClO(g) Cl2(g)+O2(g) ΔH= -18,20 cal
Pode-se afirmar, apenas com estes dados, que:
a) a reação é espontânea
b) a reação não é espontânea
c) a reação será espontânea se ∆S for positivo
d) a reação somente será espontânea em temperaturas abaixo de 0°C
e) a reação somente será espontânea em temperaturas acima de 0°C.
6. (Puc-rio) Aerossóis contêm compostos clorados, como o Freon-11 (CFCl3), que, na
estratosfera, atuam na remoção da camada de ozônio.
A reação total deste processo é:
O3 (g) + O (g) 2 O2 (g)
As reações a seguir são as etapas da reação total:
O3(g) + Cl(g) O2(g) + ClO(g)
ΔH¡ = -120kJ
ClO(g) + O(g) Cl(g) + O2(g)
ΔH¡ = -270 kJ
Portanto, o ΔH¡ da reação de remoção do ozônio é:
a) -150kJ
b) +150kJ
c) -30kJ
d) +390kJ
e) -390kJ
7. (MACKENZIE 2010/2) Considere as equações termoquímicas abaixo.
I. C (graf) + O2(g) → CO2(g) ΔH°= – 394 kJ/mol
II. H2(g) + ½ O2(g) → H2O (l) ΔH° = – 242 kJ/mol
III. C (graf) + 2 H2 (g) → CH4(g) ΔH° = – 74 kJ/mol
IV. 2 C (graf) + 3 H2(g) + ½ O2(g) → C2H5OH (l) ΔH° = – 278 kJ/mol
É correto afirmar que:
a) a combustão completa de um mol de gás metano libera 402 kJ.
b) todos os processos representados pelas equações dadas são endotérmicos
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
06, 07, 08 e 11/07/2015
c) a combustão completa de um mol de etanol libera 618 kJ
d) o etanol, em sua combustão, libera, por mol, mais energia do que o metano
e) a combustão de um mol de etanol produz 89,6 L de CO2, nas CNTP
8. (Fuvest) As reações, em fase gasosa, representadas pelas equações I, II e III, liberam,
respectivamente, as quantidades de calor Q1, Q2 e Q3 (medidas em J), sendo Q3 > Q2 > Q1.
I. 2 NH3 + 5/2 O2 → 2 NO + 3 H2O, ΔH1 = - Q1
II. 2 NH3 + 7/2 O2 → 2 NO2 + 3 H2O, ΔH2 = - Q2
III. 2 NH3 + 4 O2 → N2O5 + 3 H2O, ΔH3 = - Q3
Assim sendo, a reação representada por
IV. N2O5 → 2 NO2 + ½ O2, ΔH4 será
a) exotérmica, com ΔH4 = Q3 – Q1
b) endotérmica, com ΔH4 = Q2 – Q1.
c) exotérmica, com ΔH4 = Q2 – Q3.
d) endotérmica, com ΔH4 = Q3 – Q2
e) exotérmica, com ΔH4 = Q1 – Q2
9.
9. O gás propano é um dos integrantes do GLP (gás liquefeito de petróleo) e, desta forma, é um
gás altamente inflamável. Abaixo está representada a equação química NÃO BALANCEADA de
combustão completa do gás propano.
C3H8(g) + O2(g) →CO2(g) + H2O(v)
Na tabela, são fornecidos os valores das energias de ligação, todos nas mesmas condições de
pressão e temperatura da combustão.
Assim, a variação de entalpia da reação de combustão de um mol de gás propano será igual a:
a) – 1670 kJ.
b) – 6490 kJ
c) + 1670 kJ
d) – 4160 kJ
e) + 4160 kJ
10. (VUNESP 2005/2) A oxidação do carbono a dióxido de carbono pode ocorrer em dois passos:
C (s) + ½ O2(g) → CO (g) ΔH0= – 110,5 kJ
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
06, 07, 08 e 11/07/2015
CO (g) + ½ O2(g) → CO2(g) ΔH0= – 283,0 kJ
A reação total e o valor da entalpia total da reação são, respectivamente:
a) C (s) + ½ O2(g) → CO2(g); ΔH0= – 393,5kJ
b) C (s) + O2(g) → CO2(g); ΔH0= + 393,5kJ
c) C (s) + O2(g) → CO2(g); ΔH0= – 393,5kJ
d) C (s) + O2(g) → 2CO (g); ΔH0= + 393,5kJ
e) C (s) + O2(g) → 2CO (g); ΔH0= – 393,5kJ
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.
Material de Apoio para Monitoria
Química
Monitores: Luciana Lima e Rafael França
06, 07, 08 e 11/07/2015
Gabarito
1. A
2. C
3. B
4. C
5. C
6. E
7. D
8. D
9. A
10. C
Este conteúdo pertence ao Descomplica. É vedada a cópia ou a reprodução não autorizada previamente e por escrito.
Todos os direitos reservados.