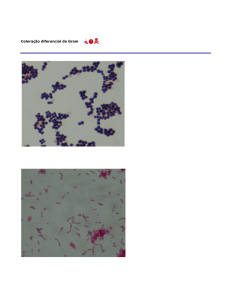
MICROBIOLOGIA - AULAS PRÁTICAS
Execução e observação microscópica de preparações coradas
Objectivos:
1 - Familiarização com pincípios básicos de microscopia de campo claro.
2 – Utilização de técnicas de coloração simples e diferencial de esfregaços
na diferenciação de estirpes bacterianas
Introdução:
Ao longo da história da microscopia desenvolveram-se numerosas técnicas
para visualizar, diferenciar e separar bactérias em termos de características
morfológicas e estruturas celulares. Os procedimentos usados e respectivos
objectivos podem sumarizar-se da forma apresentada no Quadro I.
Quadro I - Tipos de coloração aplicados a microrganismos
Coloração
Simples
Diferencial
Separação de grupos
Visualização
de
características morfológicas
usando um só corante Coloração Gram
(cocci, bacilli, spirilli e vibria e
respectivo
arranjo
em
cachos, cadeias, pares ou Coloração
ácido- resistente
tétradas)
Visualização de
estruturas
Coloração de:
flagelos, cápsulas,
esporos, grânulos
de reserva, etc...
As colorações de esfregaços de bactérias envolvem as seguintes fases:
1
Coloração de esfregaços bacterianos
Cultura fresca
Esfregaço e fixação
Coloração com ou sem contra-coloração
Lavagem
Secagem
Observação
A coloração diferencial requer no mínimo o uso de três reagentes, que são
aplicados sequencialmente a esfregaços fixados pelo calor.
O primeiro reagente é um corante primário que se destina a corar todas as
células.
A seguir é necessário descorar total ou parcialmente as células, ou partes
delas, consoante as suas afinidades químicas com um agente descolorante.
Finalmente procede-se à coloração com um contrastante.
Material necessário:
Microscópio
Ansa de repicagem
Chama
Água
Tinas de coloração
Lâminas
Reagentes para coloração
Culturas puras
Luvas
2
Método:
1º
Prepare um esfregaço a partir de cada uma das culturas que lhe foram
distribuídas. Não se esqueça de identificar cada esfregaço.
1 - Preparação das lâminas:
Desengordure as lâminas com alcool a 95% e pouse-as sobre toalhas de
papel até à sua utilização. Cole uma etiqueta num dos cantos de cada
lâmina.
2 - Preparação do esfregaço:
Um esfregaço nunca deve ser demasiado denso e espesso.
a - Preparação do esfregaço a partir de culturas líquidas:
Aplique sobre a lâmina uma ou duas vezes a ansa de inoculação após a sua
imersão com técnica asséptica na cultura em meio líquido. Deixe secar.
b - Preparação do esfregaço a partir de culturas em meio sólido:
Transfira, com uma agulha ou ansa de inoculação estéril, uma colónia para
uma gota de água previamente colocada na lâmina. Suspenda as células da
colónia na água com movimentos circulares da ansa. O esfregaço deverá
ocupar uma área circular com o diâmetro ligeiramente inferior à largura da
lâmina e ter um aspecto confluente mas semi-transparente, evitando-se que
fique demasiado denso. Deixe secar.
3 - Fixação pelo calor:
Passe o esfregaço seco ao ar, rapidamente duas ou três vezes pela chama.
2º Aplique as seguintes colorações aos esfregaços preparados.
A - Coloração Gram
1 - Coloração primária pelo cristal de violeta/oxalato de amónia:
Inunde a preparação fixada com uma gota de cristal de violeta/oxalato de
amónia. Espere um minuto. Lave com água da torneira.
2 - Aplicação do mordente:
Inunde a preparação com uma gota de mordente (solução iodada de Gram).
Espere um minuto. Lave com água da torneira.
3 - Descoloração:
Deite o reagente descolorante gota a gota sobre a preparação até que não se
veja mais cristal de violeta a ser removido. Lave com água.
3
4 - Coloração contrastante pela safranina:
Inunde a preparação com uma gota de safranina. Espere um minuto. Lave
com água da torneira. Seque a preparação.
5 - Coloque uma gota de óleo de imersão sobre as preparações e observe-as
ao microscópio com a objectiva de 100x.
6 - Anote os resultados do teste de Gram para cada uma das culturas
analisadas, e descreva sucintamente o tipo de células observadas.
B - Coloração Ácido-resistente
1 - Coloração primária pela carbol-fucsina:
Inunde a preparação fixada, com carbol-fucsina e aqueça-a durante 5
minutos, sem deixar ferver, nem deixar secar. Adicione mais corante se
necessário. Deixe arrefecer antes de lavar com água.
2 - Descoloração:
Adicione o agente descolorante álcool-ácido gota a gota sobre a preparação
até que não se veja mais carbol-fucsina a ser removida.
3 - Coloração contrastante pelo azul de metileno:
Inunde a preparação com uma gota de azul de metileno. Espere 2 minutos.
Lave com água e seque a preparação.
4 - Coloque uma gota de óleo de imersão sobre as preparações e observe-as
ao microscópio com a objectiva de 100x.
5 - Anote os resultados do teste para cada uma das culturas analisadas, e
descreva sucintamente o tipo de células observadas.
C - Coloração de esporos
1 – Sobre o esfregaço fixado da cultura da estirpe do género Bacillus, que lhe
foi fornecida, aplique uma gota da solução de verde de malaquite a 5% (Nota:
use luvas)
2 – Aqueça à chama durante 5 minutos sem deixar ferver. A aplicação do
corante a quente destina-se a facilitar a penetração do corante nos esporos.
3 – Lave com água.
4 - Coloração contrastante pela safranina:
Inunde a preparação com uma gota de safranina. Espere 30 segundos.
5 - Lave com água.
4
6 - Seque a preparação ao ar.
7 - Coloque uma gota de óleo de imersão sobre a preparação e observe-a ao
microscópio com uma ampliação de 1000x.
8 - Classifique os endósporos observados de acordo com a sua localização
na célula e anote o resultado.
D - Coloração de cápsulas
1 - Coloração primária pelo cristal de violeta:
Inunde a preparação fixada com uma gota de solução aquosa de cristal de
violeta. Espere 2 minutos.
2 - Lave com uma solução de sulfato de cobre a 20%.
3 – Lave com água e deixe secar ao ar, à temperatura ambiente.
4 - Coloque uma gota de óleo de imersão sobre a preparação e observe-a ao
microscópio com a objectiva de 100x.
5 – Registe a presença de cápsulas incolores em redor de células coradas
de violeta.
E - Coloração de grânulos de poli-β-hidroxibutirato
1 – Core um esfregaço fixado de Bacillus com negro do Sudão a 0,03%
durante 10 minutos.
2 – Escorra a preparação e seque com papel absorvente.
3 – Inunde a preparação com uma gota de safranina durante 30 segundos.
4 – Lave com água e deixe secar a preparação ao ar.
5 – Coloque uma gota de óleo de imersão sobre a preparação e observe-a ao
microscópio com a objectiva de 100x.
6 – Anote a presença ou ausência de grânulos de reserva corados de negro
do seio do citoplasma corado de vermelho pela safranina.
5
F - Coloração de grânulos metálicos segundo Leuschow e Mackenthum
1 – Fazer uma suspensão bacteriana, com 100 ml de água destilada estéril e
uma colónia da estirpe a ser observada;
2. – filtrar os 100 ml da suspensão através de uma membrana de nitrato de
celulose, 0,45 μm;
3. – colocar a membrana numa estufa a 100 ºC, até secar completamente;
4. – saturar a membrana em óleo de imersão até ficar transparente,
5. – colocar a membrana numa lâmina, cobrir com uma lamela e observar ao
microscópio com uma ampliação de x400 a x600.
BIBLIOGRAFIA:
ALCÂNTARA, F., CUNHA, M.A. & ALMEIDA, M.A., 1996. Microbiologia, práticas
laboratoriais, Universidade de Aveiro, 297 p.
CAPPUCCINO, J.G. & SHERMAN, N., 1983. Microbiology, a laboratory manual, AddisonWesley Publishing Company, Reading, 466 p.
CULLIMORE, D. R., 1992. Practical manual of groundwater microbiology, Lewis Oublishers,
Boca Raton, 412 p.
GERHARDT, P., MURRAY, R.G.E., WOOD, W.A. & KROEG, N.R. (Eds.), 1994. Methods for
general and molecular bacteriology, American Society for Microbiology, Wasghington D.C.,
791 p.
6
REAGENTES:
Corantes:
Cristal de Violeta/oxalato de amónia para Gram = mistura das seguintes soluções:
Solução A =2g de cristal de violeta + 20 ml de álcool etílico a 95%.
Solução B = 0,8g de oxalato de amónia + 80 ml de água destilada
Cristal de violeta para cápsulas = 1 g de cristal de violeta + 100ml de água destilada
Safranina = 10ml de uma solução a 2,5% de Safranina O em álcool etílico a 95% + 90 ml de
água destilada. Dissolver e filtrar por papel
Carbol Fucsina = mistura das seguintes soluções:
Solução A = 0,3g de fucsina básica + 10 ml de álcool etílico a 95%.
Solução B = 5g de fenol + 95 ml de água destilada
Azul de Metileno = 0,3g de azul de metileno + 100ml de água destilada
Dissolver e filtrar por papel.
Verde de Malaquite = 5g de verde de malaquite + 100ml de água destilada
Dissolver e filtrar por papel.
Negro do Sudão = 0,3g de negro de Sudão + 100ml de água destilada
Dissolver e filtrar por papel.
Mordentes:
Solução iodada de Gram (Lugol) = 1g de iodo + 2g de iodeto de potássio + 300ml de água
destilada. Na câmara de exaustão (Hotte) triturar em almofariz o iodo e o
iodeto de potássio e adicionar água até perfazer o volume indicado.
Sulfato de cobre a 20% = 20g de CuSO4. 5H2O + 80 ml de água destilada
Descolorantes:
Álcool a 95% = 95 ml de álcool etílico + 5ml da água destilada
Álcool-ácido = 97ml de álcool etílico a 95% + 3ml de ácido clorídrico concentrado
7