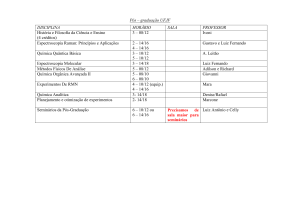
Espectroscopia
• Espectroscopia de Ultravioleta (UV)
• Espectroscopia de Infravermelho (IV)
• Espectroscopia de Ressonância Magnética Nuclear (RMN)
• Espectrometria de massa
Bib.Adicional:
•Silverstein, R.M., Bassler, G.C., Morrill, T.C., Spectrometric Identification of
Organic Compounds, 7th Ed, Wiley, 2002
•Base de dados experimentais de compostos orgânicos
http://riodb01.ibase.aist.go.jp/sdbs/cgi-bin/cre_index.cgi?lang=eng
1
Espectrometria de massa
As moléculas são ionizadas por acção de electrões
de alta energia (normalmente). A relação
massa/carga (m/e) dos iões produzidos é medida de
um modo muito preciso pela combinação da
aplicação de um campo magnético e eléctrico.
Permite:
• Determinação do peso molecular
• Composição atómica
• Identificação de blocos estruturais
(pela fragmentação observada)
2
Parte do espectro electromagnético da luz
U.V.
Electrónicas
Visível
R.M.N.
I.V.
Vibracionais
Rotacionais
Spin nuclear
(Res.Mag.Nuclear)
Tipo de transições observadas
3
Espectroscopia de Ultravioleta
• A absorção desta luz de energia relativamente
elevada produz excitação electrónica. Numa gama
de 200 a 800 nm só é observada absorção
significativa se existirem electrões π conjugados.
Permite:
• Observar o tipo de conjugação electrónica da
molécula em estudo
4
Espectroscopia de Infravermelho
A absorção de luz na zona do infravermelho efectua
transições nos estados vibracionais e rotacionais de
grupos de átomos numa molécula.
Devido a absorções características este tipo de
espectroscopia permite:
• Identificação de grupos funcionais
5
Espectroscopia de Ressonância Magnética Nuclear
As moléculas são colocadas sobre a acção de um campo
magnético forte “criando” níveis energéticos para átomos com
momento angular de “spin” diferente de zero. Absorção de
radiação de baixa energia (radiofrequências) causa excitação
de certos núcleos sendo medida de uma forma muito precisa
a frequência e intensidade da radiação absorvida pelos
diversos átomos. Os espetrómetros são ajustados a certos
núcleos (p.e. 1H, 13C, 19F ou 31P) permitindo para um dado
núcleo distinguir e contar átomos em partes distintas das
moléculas.
• Permite (entre outras aplicações):
• Determinação da estrutura carbonada
• Determinação da estereoquímica de um composto
6
Espectroscopia de Ressonância Magnética Nuclear
7
Diagrama esquemático de um espetrómetro de RMN
8
Espetrómetro de RMN
9
Interior de um aparelho de RMN
10
Momento Magnético Nuclear
Os dois tipos de núcleos mais estudados por RMN têm Spin I = 1/2, tendo
por isso dois níveis energéticos distintos (-½ e +½ ou α e β), sendo eles:
• 1H – isótopo mais abundante do hidrogénio
•13C – isótopo não radioactivo do carbono com abundância de ca. 1,1%
(Atenção : 12C tem I = 0 não sendo visível por RMN)
11
Estados de
spin na
presença de
um campo
magnético
externo B0
(para I = 1/2)
Orientado contra
o campo → >E
Orientado a favor
do campo → <E
∆E = h·ν
Circulação electrónica e campo magnético
•
No entanto, o campo sentido por
cada protão (1H) não é idêntico
pois a circulação electrónica
também induz um campo
magnético que se opõe ao
externo, dizendo-se que os
protões estão blindados.
•
Assim sendo, protões em
AMBIENTES ELECTRÓNICOS
diferentes vão “sentir” campos
diferentes e absorver radiação
de diferente frequência.
•
À frequência de absorção dá-se
o nome de frequência de
ressonância.
13
Exemplo de um espectro de RMN
É um gráfico frequência de
ressonância vs. intensidade
Utilizado
como
referência:
δ=0,0 ppm
H3 C
H3C
CH3
Si
CH3
Tetrametilsilano
Convencionou-se uma escala para medição da frequência de
ressonância independente do campo do aparelho a que se deu o nome
de desvio químico (δ), expressa em partes por milhão (ppm).
14
Desvio Químico num espectro de RMN
δ (ppm) =
frequência de absorção (Hz)
frequência do aparelho (MHz)
δ grande
Campo baixo
Núcleos desblindados
δ pequeno
Campo alto
Núcleos blindados
Protões em AMBIENTES ELECTRÓNICOS idênticos dizem-se
15
EQUIVALENTES e apresentam o mesmo desvio químico
Desvios Químicos habituais
16
Desvios
Químicos
habituais
17
Desblidagem em C—H de benzenos e aldeídos
• A circulação electrónica nos compostos aromáticos e no
grupo carbonilo causa desblindagem dos H directamente
ligados a estes grupos
δ (H—C=O) = 9,5-9,9
δ (C—Har.) = 6,0-9,5
18
Protões equivalentes
Protões (ou outros núcleos) que estejam sujeitos ao mesmo tipo de
campo magnético ressoando a igual desvio químico dizem-se
MAGNETICAMENTE EQUIVALENTES
Um modo rápido para verificar se dois núcleos são equivalentes consiste em
substituir os núcleos em questão por um “grupo” arbitrário e comparar as
duas “novas” moléculas obtidas. Se forem iguais ou enantiómeros, temos
núcleos equivalentes (caso contrário não o serão). Por exemplo:
CH3
A
A
H
CH3
H
H
C
H
H
H
H
H
H
CH3
C
B
H
CH3 D
CH3
H
H
H
H
H
H
H
H
B
CH3
A,B,C e D são a
mesma molécula
CH3
CH3
H
CH3
CH3
Todos os H
Aromáticos
são equivalentes
(dão origem
a apenas 1
sinal em RMN)
19
Protões equivalentes e integração
No 1,4-dimetilbenzeno há apenas
dois tipos de protões diferentes
A área dos picos é proporcional ao número de protões que lhes dá
origem. O integral do pico é apresentado sobre a forma de desnível
que é mensurável. No caso acima temos uma relação 1,0:1,5 (4H:6H)
20
Protões não equivalentes e acoplamento
•
•
•
•
•
•
Além do campo externo aplicado e
do campo criado pela circulação
eletrónica o “spin” de núcleos
próximos também influencia o
campo sentido por um dado tipo de
protões.
A este tipo de efeito dá-se o nome
de acoplamento spin-spin sendo
transmitido através das ligações
químicas (normalmente à distância
máxima de 3 ligações).
Só há acoplamento entre núcleos
não equivalentes.
O acoplamento mais vulgar em 1H
RMN é do tipo H/H.
Um sinal é desdobrado por n protões
equivalentes em (n+1) picos.
O sinal desdobrado é designado por
dupleto (2 sinais), tripleto (3),
quarteto (4), etc...
(n+1)=2 sinais
Dupleto (d)
21
Acoplamento de protões em RMN (cont.)
Acoplamento com dois protões equivalentes
• O acoplamento dá-se
normalmente entre
protões no carbono
adjacente.
• Com 2H’s adjacentes:
3 combinações de spin
diferentes são possíveis
(aa, ab e bb), sendo
que ab pode ser ab ou
ba).
• Sinal tripleto (t).
22
Acoplamento de protões em RMN (cont.)
Acoplamento com três protões equivalentes
O desvio químico (δ)
será sempre o do
CENTRO
do grupo de picos
23
O grupo etilo
O acoplamento Ha/Hb é idêntico ao Hb/Ha.
A intensidade do acoplamento é medida pela constante de acoplamento
(J), expressa em Hz (J comuns 0 – 18 Hz)
δ2
δ1
24
Constante de acoplamento
Num aparelho de 300 MHz, 1 ppm = 300 Hz (para calcular J
faz-se uma proporção).
Tipo de átomos de H
H
2J
3J
O
CH
2-3
H
H
12-18
H
H
2J
4J
6-8
CH CH
3J
3J
12-15
H
3J
6-12
H
H
0-2
H
H
H
J (Hz)
0-3
25
Acoplamento com mais do que um tipo de protões
Analisam-se as interações uma a uma. O resultado
global dará o desdobramento do grupo. Ex:
26
Resumo das informações básicas fornecidas por um
espectro de RMN
• Desvio químico, δ (Chemical Shift)
- Reflete o ambiente electrónico em torno de um protão
- Distingue protões em ambientes diferentes (protões
equivalentes estão no mesmo ambiente electrónico)
• Desdobramento do sinal (singleto, dupleto,
tripleto...)
- Spin nuclear dos átomos na vizinhança (número e tipo
de protões na vizinhança)
- Acoplamento com protões (normalmente) a 3 ligações
de distância
• Integração da área do pico
- É proporcional ao número de protões equivalentes que
lhe dão origem
27
1,1,2-tricloroetano
28
Brometo de etilo
3H
2H
29
Propionato de metilo
1.5
1.5
1
30
Aldeído benzílico
5
1
2
31
RMN e protões móveis
Protões que possam efectuar ligações por pontes de hidrogénio
apresentam δ’s variáveis e apresentam-se muitas vezes como bandas
largas (ao invés dos picos afilados habituais).
Valores típicos de δ (ppm)
Ácidos
RCOOH
10,5-12,0
Fenóis
ArOH
4,0-7,0
Álcoois
ROH
0,5-5,0
Aminas
RNH2
0,5-5,0
Amidas
RCONH2
5,0-8,0
Ao adicionar D2O ao tubo de RMN observa-se a troca do protão
móvel por deutério que já não vai ser observável por RMN (nesta
zona do espectro) desaparecendo o sinal inicial.
32
Etanol
D2O
OH
Protões que
estabeleçam pontes de
hidrogénio quando
colocados na presença
de D2O, são trocados
deixando de ser visíveis
num espectro de 1H
RMN.
Ex etanol
Não visível nesta
zona do espectro
~2,6 ppm
b
a
c
OD
Desaparece com D2O
OH
a
b
c
33
N,N-Diisopropilamina na presença de D2O
a
b
N
H
c
a
c não é visível pois é
trocado por deutério
b
34
A influência do campo magnético num espectro de RMN
A utilização de campos magnéticos mais intensos torna os sinais de RMN
mais fortes conseguindo também separar melhor os diversos sinais presente
no espectro.
35
A influência do campo magnético num espectro de RMN
60MHz
Expansões dos sinais
300MHz
36
13C
RMN
O isótopo mais abundante do carbono (12C) tem spin nuclear nulo, não
sendo visível no RMN. No entanto, o seu isótopo pesado (13C) tem spin
nuclear ½ podendo ser observado por RMN. A sua baixa abundância
(1,1%) torna o sinal de fraca intensidade (6000 × mais fraco que 1H).
A quantificação do número de C’s equivalentes normalmente não é
possível (a integração do sinal não é proporcional ao nº de carbonos).
Exemplo de um espectro:
• Acoplamento 13C—13C não é observado dado que é muito pouco provável uma
molécula ter os dois C’s adjacentes 13C.
• Acoplamento 13C—1H é forte e observável, permitindo determinar o número de
H’s ligados a um dado carbono.
• Para simplificar o espectro é aplicada uma 2ª frequência que “impede” o
acoplamento 13C—1H. Neste tipo de espectro (com desacoplamento de protão)
cada sinal representa um tipo de carbono diferente (todos os sinais são singletos)
Scan pavia 151
Desacoplamento em 13C
Desvios
químicos
habituais
em 13C
RMN
39
Desvios químicos habituais em 13C RMN
40
Desdobramento do sinal em 13C RMN não desacoplado
O acoplamento principal é do tipo 13C—1H.
41
Propanol
26
10
10
64
OH
26
64
2,2-Dimetilbutano
29
29
36
9
30
9
36
30
Ciclo-hexanol
35,5
OH
70,11
35,52
25,6
24,38
25,64
24,4
70,1
Ciclo-hexanona
42
O
27
211
42
27
25
211
25
Ciclo-hexeno
25
23
127
127
25
23
o-Diclorobenzeno
Cl
130,5
127,7
Cl
132,6
130,5
127,7
132,6
47
m-Diclorobenzeno
Cl
126,9
135,1
126,9
128,7
128,7
130,4
135,1
130,4
Cl
p-Diclorobenzeno
Cl
132,6
129,8
129,8
132,6
Cl
49