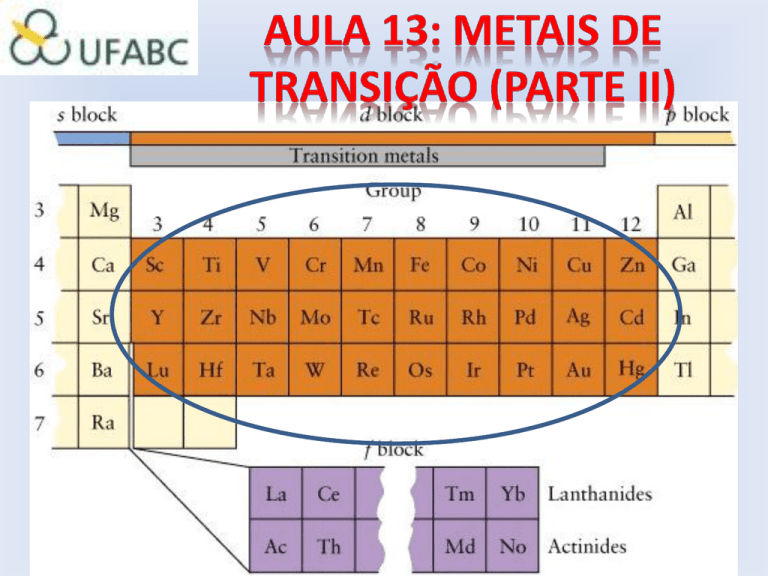
Abundância e Ocorrência
Métodos de Obtenção
Redução química a
altas temperaturas –
com Carbono
Redução química a
altas temperaturas –
com Hidrogênio
Métodos de Obtenção
• Placas de Cu impuro são usadas como anodos, chapas finas de Cu
puro são os catodos.
• O sulfato de cobre ácido é usado como o eletrólito.
• A voltagem através dos eletrodos
é planejada para produzir Cu no
catodo.
• As impurezas metálicas não se
depositam no catodo.
Métodos de Obtenção
Uso de altas temperaturas para a obtenção do metal livre.
O coque reage com o oxigênio para formar CO (o agente redutor):
2C(s) + O2(g) 2CO(g), H = -221 kJ
O CO é também produzido pela reação do vapor d’água no ar com C:
C(s) + H2O(g) CO(g) + H2(g), H = +131 kJ
Uma vez que essa reação é endotérmica, se o alto-forno fica quente
demais, adiciona-se vapor d’água para resfriá-lo sem interromper a
reação química.
Em torno de 250C, o calcário é calcinado (p/ decomposição e
eliminação dos voláteis).
Também em torno de 250C, os óxidos de ferro são reduzidos pelo
CO:
Fe3O4(s) + 4CO(g) 3Fe(s) + 4CO2(g), H = -15 kJ
Fe3O4(s) + 4H2(g) 3Fe(s) + 4H2O(g), H = +150 kJ
O ferro fundido é produzido bem abaixo no alto-forno e removido no
fundo.
A escória (materiais de silicato fundido) é removida acima do ferro
derretido.
Se o ferro vai ser transformado em aço, ele é derramado diretamente
em uma fornalha básica de oxigênio.
O ferro fundido é convertido em aço, uma liga de ferro.
Para remover as impurezas, o O2 é soprado através da mistura
derretida.
O oxigênio oxida as impurezas.
LIGAS
aço: cada Kg de Fe produzido exige 1,75 Kg de
minério de ferro, 0,75 Kg de carvão coque e 0,25 Kg
de calcário.
CaO retira impurezas do minério como Al, Si e P:
escória
CaO (s) + SiO2 (s) CaSiO3 (l)
CaO (s) + Al2O3 (s) Ca(AlO2)2 (l)
CaO (s) + P4O10 (s) 2 Ca3(PO4)2 (l)
Ferro gusa: 90-95% Fe; 3-5% C; 2% Si
O2
AÇO
Qual a equação química
que representa o processo?
3Fe2O3 + CO 2Fe3O4 + CO2
Fe3O4 + CO 3FeO + CO2 (X2)
FeO + CO Fe + CO2
Fe2O3 + 3CO 2Fe + 3CO2
CO2+ C 2CO
Qual a equação química
que representa o processo?
3Fe2O3 + CO 2Fe3O4 + CO2
2Fe3O4 + 2CO 6FeO + 2CO2
FeO + CO Fe + CO2 (X6)
Fe2O3 + 3CO 2Fe + 3CO2
CO2+ C 2CO
Qual a equação química
que representa o processo?
3Fe2O3 + CO 2Fe3O4 + CO2
2Fe3O4 + 2CO 6FeO + 2CO2
6FeO + 6CO 6Fe + 6CO2
Fe2O3 + 3CO 2Fe + 3CO2 (X12)
CO2+ C 2CO
Qual a equação química
que representa o processo?
3Fe2O3 + CO 2Fe3O4 + CO2
2Fe3O4 + 2CO 6FeO + 2CO2
6FeO + 6CO 6Fe + 6CO2
Fe2O3 + 3CO 2Fe + 3CO2
12CO2+ 12C 24CO
Qual a equação química
que representa o processo?
3Fe2O3 + CO 2Fe3O4 + CO2
2Fe3O4 + 2CO 6FeO + 2CO2
6FeO + 6CO 6Fe + 6CO2
Fe2O3 + 3CO 2Fe + 3CO2
12CO2+ 12C 12CO
4Fe2O3 + 12C 8Fe + 12CO
Dado o processo de obtenção de
Ferro metálico a partir da Hematita
(Fe2O3), qual a massa de carvão (C)
necessária para a produção de uma
tonelada de Fe?
Métodos de Obtenção
extração de metais de minérios com a utilização de água
• Lixívia é a dissolução seletiva do mineral desejado.
• Os agentes típicos da lixívia são ácidos diluídos, bases, sais e,
algumas vezes, água.
• O ouro pode ser extraído de minério de baixo grau através de
cianidação:
– O NaCN é borrifado sobre o minério triturado e o ouro é
oxidado:
4Au(s) + 8CN-(aq) + O2(g) + 2H2O(l) 4Au(CN)2-(aq) + 4OH-(aq)
– O ouro é então obtido através de redução:
2Au(CN)2-(aq) + Zn(s) Zn(CN)42-(aq) + 2Au(s)
Configuração Eletrônica
Estado Oxidação
Sc
[Ar] 3d1 4s2
+3
Y
La
Ac
[Kr] 4d1 5s2
[Xe] 5d1 6s2
[Rn] 6d1 7s2
+3
+3
+3
Esses 4 elementos recebem coletivamente o nome de
“terras raras”
Todos têm configuração d0 em compostos: sem
elétrons
desemparelhados
(diamagnéticos)
compostos incolores (não tem transição d-d).
e
reagem com O2 formando óxidos do tipo M2O3
reagem lentamente com a água a frio e mais rapidamente a
quente liberando H2 e formando óxidos básicos ou hidróxidos.
todos eles reagem com CO2
Ex: Sc(OH)3 (s) + CO2 (g) Sc2(CO3)2 (s)
todos os elementos do grupo 3 reagem com H2 quando aquecidos
a 300C formando hidretos.
não apresentam tendência de formar complexos
Quando formam [Sc(OH)6]3- , [ScF6]3- NC = 6
Y e La NC maiores e preferencialmente com agentes quelantes
Ocorrência, separação e obtenção
é difícil remover os elementos desse grupo de seus compostos
porque:
- seus pontos de fusão são muito altos
- reagem com a água
- seus óxidos são muito estáveis para permitir o uso de
aluminotermia (aquecimento com alumínio)
Os metais são obtidos por redução de cloretos e fluoretos de
metais do grupo 3 por aquecimento a 1000C com Ca
Meia-vida 6 h
Usado em lâmpada de alta luminosidade, Utilizado em ligas de alumínio empregadas
tipo metal haleto, na forma de iodeto de na fabricação de materiais esportivos.
escândio (Scl3)
Empregado na estabilização do
óxido de zircônio utilizado em
implantes.
Usado na produção de
gemas de zircônia artificiais.
Usado na produção de
cerâmicas
supercondutoras de
cuprato de bário e itrio.
Configuração Eletrônica
Estados de Oxidação
Ti
[Ar] 3d2 4s2
(-1), (0), (+2), +3, +4
Zr
Hf
[Kr] 4d2 5s2
[Xe] 4f14 5d2 6s2
(0), (+2), (+3), +4
(0), (+2), (+3), +4
( ) estados de oxidação instáveis ou de existência duvidosa
O estado de oxidação mais comum dos três elementos é +4.
Nesse caso têm configuração d0 em compostos: sem elétrons
desemparelhados (diamagnéticos) e compostos brancos ou incolores
(não tem transição d-d).
a EI para os três elétrons desses elementos é muito alta, logo, os
seus compostos anidros são covalentes.
o Zr e o Hf têm tamanhos (contração lantanídica) e configurações
eletrônicas semelhantes, logo têm propriedades químicas quase
idênticas
a separação desses elementos é muito difícil e só é possível ser
feita por troca iônica (coluna de sílica gel) em solução alcoólica. A
mistura é eluída com álcool / HCl. O Zr é eluído primeiro.
Método de Kroll
Reatividade
acima de 600C esses elementos se tornam reativos e são
capazes de formar:
- óxidos do tipo: MO2
- haletos do tipo: MX4
- nitretos intersticiais do tipo: MN
- carbetos intersticiais do tipo: MC
[Ti(H2O)6]3+ Ti : 3d1
Complexos de fórmula [TiX4L2] são octaédricos
Outros nos de coordenação são raros: Et4N[TiIVCl5]-,
[TiCl4.AsH3]
Todos os compostos com os elementos
c/ estado de oxidação +3 são coloridos e
paramagnéticos d1
TiCl3 é um importante catalisador de
Ziegler-Natta (p/ polimerização de etileno
a polietileno) – Nobel de química em 1963
[Ti(H2O)6]3+ (violeta) é um poderoso ag.
redutor e pode ser oxidado pelo ar
Zr(III) e Hf(III) são instáveis em água só
são encontrados em compostos no estado
sólido
fabricação de Implantes
Ligas c/ alumínio
Ligas c/ aço
pigmento e “carga”
Devido a resistência química do
produção de materiais
metal é usado em cadinhos
abrasivos e lixas
resistentes a sais fundidos
Utilizado na produção de gemas
sintéticas de silicato de zircônio
Utilizado na fabricação de
processadores de computadores de
última geração substituindo o silício
na tecnologia conhecida como Hi-K.
Dióxido de Háfnio
usado como material
refratário.
Carbeto de Háfnio um dos compostos
binários com maior ponto de fusão
conhecido aproximadamente 4000oC.
Usado em ligas metálicas
empregadas na fabricação de
turbinas de aviões e soldagem
Usado como absorvedor
de nêutrons térmicos em
reatores nucleares.
Configuração Eletrônica
Estados de Oxidação
V
[Ar] 3d3 4s2
(-1), (0), (+1), (+2), +3, +4 e +5
Nb
[Kr] 4d4 5s1
(-1), (0), (+1), (+2), (+3), (+4) e +5
Ta
[Xe] 4f14 5d3 6s2
(-1), (0), (+1), (+2), (+3), (+4) e +5
( ) estados de oxidação instáveis ou de existência duvidosa
A estabilidade dos compostos aumenta com o aumento do número
de oxidação (tendência contrária dos grupos representativos).
Os átomos desse grupo são menores que os do grupo do Ti
Nb e Ta apresentam raios covalentes e iônicos quase idênticos:
propriedades são semelhantes e difíceis de serem separados
Em altas temperaturas reagem com diversos
não metais
nitretos do tipo MN
RC
PF
V
1,22
1700
Nb
1,34
2468
Ta
1,34
3000
carbetos: MC - muito duros e refratários, MC2 - iônicos, reagem com
água liberando acetileno.
hidretos não estequiométricos: quantidade de hidrogênio depende da
temperatura e da pressão: VH0,71 , NbH0,86 e TaH0,76
V é utilizado como catalisador; Nb é usado como usado em ligas de aço
Ta é usado em pinos, placas e outros materiais empregados no reparo
de fraturas. Ele não é rejeitado por ser muito inerte.
Óxidos
Sulfetos
Haletos
Suas ligas são usadas na
fabricação de ferramentas de
aço cromo-vanádio
Micronutriente importante
Produção de
ao homem e animais
(suplemento alimentar) catalisadores usados na
fabricação de H2SO4
Fabricação de capacitores eletrônicos.
Produção de tubos empregados em
trocadores de calor e condução de
produtos químicos corrosivos.
Pode formar filmes eletrocrômicos de qualquer coloração a
partir da sua anodização em solução de ácido fósfórico
Adicionado em ligas metálicas para
aumentar a resistência mecânica
Configuração Eletrônica
Estados de Oxidação
Cr
[Ar] 3d5 4s1
0, +2, +3, (+4), (+5), +6
Mo
[Kr] 4d5 5s1
0, (+2), +3, +4, +5, +6
W
[Xe] 4f14 5d4 6s2
0, (+2), +3, +4, +5, +6
( ) estados de oxidação instáveis ou de existência duvidosa
São metais relativamente abundantes
São duros, têm alto ponto de fusão,
baixa volatilidade e resistência a
corrosão
Cr(VI) é fortemente oxidante, o Cr(II)
é redutor, e o Cr(III) é o mais estável
deles
Mo(VI) e W(VI) são os mais estáveis
-O crômio pode ser dissolvido por HCl e H2SO4. Não é dissolvido por
HNO3 ou água régia (HCl / HNO3 ) (3:1).
- crômio pode ser obtido pela redução do Cr2O3
- O Mo e W são praticamente inertes, mas dissolvem em misturas
HNO3 / HF; KNO3 / NaOH fundidos ou Na2O fundido.
- Só reagem com O2 em altas temperaturas:
2 Cr 1 12 O2
Cr2O3
M 1 12 O2
MO3 (M Mo e W)
- Em temperatura ambiente, a reação com O2 forma apenas um filme
superficial de óxido
-O Cr2O3 é utilizado industrialmente como pigmento verde de tintas,
borrachas e cimento e como catalisador na produção de butadieno
(NH4 ) 2 Cr2O7
Cr2O3 N 2 4H 2O
“experimento do vulcão”
laranja
verde
http://www.youtube.com/watch?v=RrbQHW74hQw
Na ausência de ar, o Cr reage com ácido para formar uma solução azul
de Cr2+ :
Cr(s) + 2H+(aq) Cr2+(aq) + H2(g)
Na presença de ar: 4Cr2+(aq) + O2(g) + 4H+(aq) 4Cr3+(aq) + 2H2O(l)
Na presença de Cl-: forma o íon verde [Cr(H2O)4Cl2]+.
Solução aquosa: normalmente +6.
Meio básico: o CrO42- é o íon mais estável.
Meio ácido: o Cr2O72- é o íon mais estável.
O cromato é um íon amarelo bem mais escuro
do que o dicromato.
Cr
Cr
trans
cis
~20% no aço inoxidável
Óxido de cromo
(Cr2O3) adicionado
ao vidro para dar
cor verde.
Por ser um metal muito duro e brilhante é
usado na cromação de peças.
CrO2
É um micronutriente importante para
animais e plantas, sendo adicionado em
fertilizantes, rações e suplementos
alimentares.
Na forma de sulfeto é usado como
aditivo em óleos lubrificantes e graxas.
É empregado na
fabricação de fios
resistentes a corrosão
em ambientes agressivos,
utilizado em soldagens
Filamentos de W
usado em lâmpadas.
Usado na fabricação de eletrodos para
soldagens TIG (Tungsten Inert Gas)
Usado na fabricação do carbeto de
tungstênio largamente usado em
ferramentas de corte e furação.
~18 % de W =
Aço rápido
Configuração
Eletrônica
Estados de Oxidação
Mn
[Ar] 3d5 4s2
0, (+1), +2, (+3), +4, (+5), (+6), +7
Tc
[Kr] 4d6 5s1
0, (+2), (+3), +4, (+5), +6, +7
Re
[Xe] 4f14 5d5 6s2
0, (+1), (+2), +3, +4, (+5), +6, +7
( ) estados de oxidação instáveis ou de existência duvidosa
O Mn ocorre naturalmente na forma de MnO2; quase todos os seus
compostos são coloridos (transições d-d); nas formas mais oxidadas é
um agente oxidante importante.
O Tc é o primeiro elemento artificial criado (produzido a partir do
bombardeamento de átomos de Mo com nêutrons). Todos os seus
isótopos são radioativos.
O Re é muito raro e ocorre em quantidades traço associadas a
minérios de Mo.
Mn2+ é d5
Spin baixo,
campo forte
Spin alto,
campo fraco
ou
[Mn(CN)6]4[Mn(CNR)6]2+
[Mn(CN)5(NO)]3-
Mn(NH3)6]2+
[MnCl6]4[Mn(en)3]2+
Configuração de spin baixo é pouco estável, facilmente oxidável
Complexos de spin alto e spin baixo são octaédricos
Complexos quadrado planares com ftalocianina de Mn
Os complexos com haletos são tetraédricos (verde amarelados),
[MnCl4]2-, [MnBr4]2-, [MnI4]2-, mas, em solução aquosa, duas águas se
coordenam formado complexo octaédrico rosa
Por que MnO4- é colorido (violeta) se a configuração eletrônica é d0?
Resp.: Devido às transições de transferência de carga
utilizado em ligas metálica de alta dureza, empregados em
trilhos de trens, e em ligas altamente ferromagnéticas, junto
com Cu, Sb e Al.
no aço confere maior resistência à tração
seus compostos são utilizados como agentes oxidantes, como
catalisadores, como fármaco, pigmento para tinta na cor preta
Mn é essencial ao crescimento das plantas, por isso MnSO4
é adicionado aos fertilizantes como micro nutriente.
meio milhão de ton/ano de MnO2 são utilizado na produção
de “pilhas secas”
suas ligas são supercondutores, podendo ser
utilizadas para criar campos magnéticos
intensos.
99Tc é utilizado na medicina para a localização
de tumores no cérebro, baço, fígado e tiróide,
por meio de técnicas de cintilação
Sais (NaTcO4) são armazenados em recipientes
de chumbo
é utilizado em ligas com W para construção de
resistências de fornos elétricos, contatos elétricos
arcos voltaicos e lâmpadas que operem em
temperaturas superiores a 2000 oC (Re e W possuem
os maiores pontos de fusão)
é usado para pratear jóias.
como catalisador na
indústria química
(hidrogenação)
Configuração Eletrônica
Estados de Oxidação
Fe
[Ar] 3d6 4s2
0, +2, 3, (+4), (+5), (+6)
Ru
[Kr] 4d7 5s1
0, +2, +3, 4, (+5), +6, (+7), +8
Os
[Xe] 4f14 5d6 6s2
0, (+1),(+2), (+3), +4, (+5), +6, (+7), +8
( ) estados de oxidação instáveis ou de existência duvidosa
O Fe é o 4º elemento e 2º metal em abundância (50 g/kg) na Terra;
não muito duro e bastante reativo; reage com ácidos não oxidantes
formando Fe+2 e com ácidos oxidantes formando Fe+3.
O Ru e o Os são “metais nobres” , e portanto, pouco reativos.
Obtidos a partir do depósito anódico que se acumula no refino
eletrolítico do Ni.
Brasil está entre os maiores produtores de minérios de ferro
Ferro dissolve em ác. não oxidantes diluídos à frio formando Fe2+ e
liberando H2
Se o ác. estiver morno e na presença de ar forma também Fe3+
Ácidos oxidantes geram apenas Fe3+
Ru e Os são metais nobres e resistem ao ataque por ácidos
Os reage com água régia
Fe + Cl2
Fe + O2
Fe + HCl
Ferrugem
Caso particular de
Corrosão
Para prevenir a corrosão o ferro recebe um revestimento protetor para impedir o
acesso da água:
• Folhas-de-flanders: eletrodeposição de fina camada de Sn
• Galvanização: eletrodeposição de Zn
• Zarcão: pintura com vermelho de Chumbo
• Parkerização ou bonderização: tratamento c/ ác.
fosfórico ou soluções ácidas de Mn(H2PO4)2 ou Zn(H2PO4)2
• Ânodo de sacrifício
Fe(II) é d6
ou
Fe(III) é d5
ou
Os sais de Fe (II) são verde pálido e são facilmente oxidados a
sais de Fe (III).
Forma 3 óxidos não estequiométricos: FeO, Fe2O3 e Fe3O4
O Fe (II) forma um elevado número de complexos, quase
sempre octaédricos, sendo o mais importante o grupo heme da
hemoglobina e na mioglobina.
Em ligas com o cromo e níquel forma o aço inox utilizado em utensílios de cozinha e
talheres
Pigmentos
Indústria de base
Utilizado em joalheria como endurecedor de ligas de Pt e de Pd
Utilizado em ligas destinadas a próteses odontológicas
Como catalisador em reações orgânicas
O Óxido de Rutênio é usado na fabricação de sensores de
temperatura empregados em medição de temperaturas
criogênicas.
Empregado em compostos antitumorais para tratamento de
câncer como o complexo Ru(III) denominado NAMI-A,
[ImH][trans-RuCl4 (dmso-S)(Im)] (Im = imidazole).
É muito duro e pouco dúctil
Usado na composição de ligas metálicas destinadas a fabricação
de instrumentos resistentes ao atrito (eixos)
O tetróxido de Os é usado na química orgânica como oxidante e
catalisador e contraste em microscopia ótica e eletrônica
Pode ser empregado como filamento em lâmpadas
incandescentes devido ao seu alto ponto de fusão
Configuração Eletrônica
Estados de Oxidação
Co
[Ar] 3d7 4s2
(-1), 0, (+1), +2, +3 , (+4)
Rh
[Kr] 4d8 5s1
(-1), 0, (+1), +2, +3 , +4 , (+6)
Ir
[Xe] 4f14 5d9
(-1), 0, (+1), (+2), +3 , +4 , (+5), (+6)
( ) estados de oxidação instáveis ou de existência duvidosa
Co(II) e Co(III) são os estados mais
comuns sendo o Co(II) mais estável
Para os demais elementos os estados
mais estáveis são Rh(III) , Ir(III) e Ir(IV)
O Co é mais duro que o Fe; é ferromagnético; tem cor brancoazulada e é razoavelmente inerte – não reage com água, H2 e N2, mas
reage com O2, halogênios, S, C e P em temperaturas elevadas.
O Rh e Ir são duros e inertes; resistem aos ácidos. Reagem com O2
e halogênios em altas temperaturas
Ir é o elemento mais denso da tabela periódica
Os três elementos desse grupo formam um grande número de
compostos de coordenação
Co(II) tem configuração d7
[Co(H2O)6]2+ bem como a maioria dos complexos octaédricos de
Co(II) são de spin alto
Complexos tetraédricos tb são comuns – ligantes monodentados e
volumosos como o Cl-, Br-, SCN-, I-, OH[Co(H2O)6 ]2 4Cl [Co(Cl ) 4 ]2 6H 2O
rosa
azul
Incorporado na
sílica gel
Co(III) tem configuração d6
[Co(H2O)6]3+ bem como a maioria dos complexos octaédricos de
Co(III) são de spin baixo, exceto o [CoF6]3- que é de spin alto
Força do campo ligante aumenta da
esquerda p/ direita
molibdato de cobalto catalisador na indústria petrolífera
para a hidrodessulfuração e reforma de petróleos.
60Co (emissor ) na esterilização de alimentos e
materiais cirúrgicos a frio
Compostos de cobalto usados em cerâmica, vidros,
pigmentos de tintas, ligas de aços especiais, na agricultura e
como micronutriente.
Super liga
em aço
Vitamina B12
CoO com
sílica e
K2CO3
ligas com Pt para dar maior dureza e resistência
catalisadores em diversas reações químicas. Ex: oxidação da
amônia a óxido nítrico.
em joalharia para revestimento de objetos de Ag e ouro branco
para melhorar o aspecto da jóia, tornando-a muito branca e mais
resistente.
Sensores de temperatura
Galvanoplastia: deixa os metais c/ coloração negra
entra na composição de ligas (5 a 10%) com Pt para tornar a
liga mais dura e resistente que a Pt pura
Essas ligas são usadas em cadinhos, equipamentos cirúrgicos,
jóias, etc.
O 192Ir utilizado em equipamento para radiografia industrial
Usado na confecção do padrão de peso do kilograma, que é
uma liga de 90% Pt e 10% Ir, e se encontra no Bureau
International des Poids et Mesures (BIPM) na França
velas de ignição de longa vida útil (fins militares pois é muito
cara)
Os complexos de Irídio são utilizados em telas finas e flexiveis
chamadas OLEDs (Organic light-emitting diodes).
Configuração Eletrônica
Estados de Oxidação
Ni
[Ar] 3d8 4s2
-1, 0, (+1), +2, (+3) e (+4)
Pd
[Kr] 4d10
0, +2 e +4
Pt
[Xe] 4f14 5d9 6s1
0, (+1), +2, +4, (+5) e (+6)
( ) estados de oxidação instáveis ou de existência duvidosa
O Ni é o mais reativo do grupo, é branco prateado e
ferromagnético. Reage lentamente com Flúor. É usado no
recobrimento de outros metais como proteção contra a corrosão.
A Pt e o Pd são branco acinzentados. O Pd reage com HCl na
presença de O2 e Cl2. A Pt somente reage com água régia (HCl +
HNO3) formando H2[PtCl6].
Os três metais são inertes na forma maciça e não reagem com o
ar ou c/ a água à temperatura ambiente
O estado de oxidação +2 é o mais comum p/ Ni
sais hidratados de Ni são verdes, [Ni(H2O)6]2+, sais anidros são
amarelos
Seus complexos são, geralmente, octaédricos ou quadrado
planares. Mas são conhecidos alguns complexos com estruturas
tetraédricas, bipiramides trigonais e pirâmides de base quadrada
d8, octaédrico,
paramagnético,
azuis
[Ni(NH3)6]2+
[Ni(H2O)2(NH3)4]2+
[Ni(en)3]2+
Ligantes de campo forte os
elétrons são obrigados a
emparelhar, formando
complexos quadrado planares
diamagnéticos
[Ni(CN)4]2-
Os complexos de Pd(II) e Pt(II) são quadrado planares
ligas: aços inoxidáveis, cupro-níquel (cunhagem de moedas),
cromo-níquel (cutelaria), cobre-niquel-zinco (prata alemã)
Banhos de proteção contra a corrosão (NiSO4)
Catalisadores para a indústria têxtil
Baterias
Usado na cunhagem de moedas - primeira moeda de Paládio em
comemoração a coroação do Rei Taufa´ahua Tupou IV de Tonga em
1967.
catalisador de reações de hidrogenação e na indústria petrolífera
ligas usadas em odontologia, conectores em componentes
eletrônicos, jóiais
catalisador em reações de hidrogenação em química orgânica.
purificação de gases por oxidação catalítica
liga Pt-Rh é usada no processo de fabricação de seda artificial,
fibras de vidro e termopares.
liga de Pt-Ir é usada em joalharia, utensílios de laboratório,
eletrodos e contatos elétricos.
liga Pt-Pd é usada em próteses
cis-diaminodicloroplatina(II): usado como quimioterápico
Comparações horizontais
Fe
Co
Ni
Ru
Rh
Pd
Os
Ir
Pt
Metais ferrosos
Mais reativos
Grupo da platina
Mais “nobres”
Fe3+ é o estado usual do ferro, mas Co3+ é forte oxidante (a não ser complexado),
Ni é divalente em compostos simples
Reatividade: Fe>Co>Ni
Reatividade: Ru<Rh<Pd e Os<Ir<Pt
Diferenças entre os dois grupos são:
• Tendência do aumento da estabilidade dos elementos
nos estdos de oxidação superiores
• Desaparecimento de formas iônicas simples
• Caráter “nobre” crescente
tendências
esperadas em um
grupo vertical
Configuração Eletrônica
Estados de Oxidação
Cu
[Ar] 3d10 4s1
+1, +2, (+3)
Ag
[Kr] 4d10 5s1
+1, +2, (+3)
Au
[Xe] 4f14 5d10 6s1
+1, +3, +5
( ) estados de oxidação instáveis ou de existência duvidosa
Os elementos desse grupo possuem as condutividades térmicas e
elétricas mais elevadas que se conhecem, mas tendem a ser pouco
reativos
A reatividade química diminui do Cu para o Au. O Cu é inerte a
ácidos não oxidantes, mas reage com ácidos oxidantes (HNO3 e H2SO4)
A Ag e o Au muitas vezes ocorrem na forma elementar. A maior parte
do Cu é produzida a partir do mineral calcopirita CuFeS2.
Os compostos simples de Au decompõem-se rapidamente ao metal.
Estados mais estáveis variam com o metal: Cu(II), Ag(I) e Au(III)
Cu+ e Au+ se desproporcionam em solução aquosa, e por isso só
podem existir na forma de compostos insolúveis ou complexos
• Embora a configuração eletrônica se pareça com o grupo 1, eles
possuem pouca sememelhanças entre si
• Pouca blindagem dos elétrons d faz com que sejam pequenos, densos
e duros
• A energia de ionização são elevadas resultado em compostos com
maior caráter covalente
•Elétrons d participam da ligação metálica resultando em PF maiores
que metais do grupo 1
•Altas energias de ionização e potencial de redução positivos (abaixo do
H2) demostram caráter nobre. Não reagem com H2O nem com ácidos.
Entretanto, Cu é lentamente oxidado quando exposto ao ar úmido, formando um
revestimento verde de azinhavre – Carbonato básico de cobre, Cu(CO)3.Cu(OH)2
O conjunto pesa um total de ~24.600 t,
das quais ~28 t são cobre, ~113 t são
aço, e ~24.400 t de cimento no pedestal.
?
Sculptor Frederic Auguste Bartholdi was commissioned
to design a sculpture with the year 1876 in mind for
completion, to commemorate the centennial of the
American Declaration of Independence. The Statue was
a joint effort between America and France and it was
agreed upon that the American people were to build
the pedestal, and the French people were responsible
for the Statue and its assembly here in the United
States. On October 28th 1886, the dedication of the
Statue of Liberty took place in front of thousands of
spectators.
http://www.statueofliberty.org/default_sol.htm
Objetos de Ag lentamente perdem o brilho quando expostos ao ar
devido à presença de pequenas quantidades de H2S no ar:
Ag + H2S Ag2S que é preto
Cu(I) é d10 e por isso a maioria dos compostos são incolores e
diamagnéticos. Mas há alguns compostos coloridos, Cu2O (amarelo ou
vermelho), Cu2CO3 (amarelo) devido às transições de tranferência de
carga
Haletos de prata são muito utilizados em filmes fotográficos: AgCl, AgB
e AgI
Maioria dos complexos e compostos de Cu(II) apresenta estrutura
octaédrica distorcida (ligações em trans são mais longas que as outras
quatro), e são azuis ou verdes
O íon, Cu(II), é d9 restando apenas 1 orbital p/ o qual o elétron pode
ser promovido
Ag(II) é estável em complexos como [Ag(py)4]2+, [Ag(bpy)2]2+
Au(III) é d8 e forma complexos quadrado planares assim como a Pt
Au + HNO3 HCl H3O+[AuCl4]-.3H2O AuCl3
Condução de eletricidade
Tubulações e trocadores de calor
Circuito Impresso
CuSO4 + Ca(OH)2 - defensivo agrícola
(calda bordalesa) e como algicida na purificação da água.
Bronze: liga de Cu e Sn
Latão: liga de Cu e Zn
fotografia
eletrodeposição (banhos)
baterias e pilhas
liga prata-cobre – cunhagem de moedas
ligas de prata usadas na fabricação de radiadores para automóveis
prata metálica como catalisador (reações de oxidação de alcoóis)
Purificador de água
joalheria
odontologia
revestimento de partes de satélites por ser um bom refletor
de infravermelho
circuitos eletrônicos
Nanopartículas de Au
Configuração Eletrônica
Estados de Oxidação
Zn
[Ar] 3d10 4s2
+2
Cd
[Kr] 4d10 5s2
+2
Hg
[Xe] 4f14 5d10 6s2
+1 e +2
todos os elementos do grupo têm orbitais d completos
valência fixa: não possuem transição eletrônica d - d compostos
brancos
são mais moles que os demais elementos de transição talvez porque
os elétrons d não participem das ligações metálicas
têm PF são muito mais baixos que os outros elementos de transição
são menos nobres que os elementos dos grupos anteriores o
caráter nobre aumenta com o aumento das energias de ionização e
a reatividade diminui do Zn para o Hg
Compostos de Hg(II) são mais covalentes que os demais do grupo
O íon monovalente Hg+ não existe, eles se dimerizam – [Hg-Hg]2+ (se
ligam utilizando seus elétrons s)
Zn22+ e Cd22+ são instáveis e desproporcionam em água
p/ estados de oxidação maiores que dois seria necessário destruir
simetria da camada d completa
Os três elementos exibem poucas propriedades associadas a
elementos de transição típicos (devido a camada d completa):
• não é possível ocorrer transições d-d: maioria dos compostos
são brancos e os quando coloridos apresentam transiçào de
transferência de carga
• Os metais são mais moles porque os elétrons d não participam
das ligações
• PF e PE são baixos: Hg é líquido a temperatura ambiente devido
a grande energia de ionização que dificulta a participação dos
elétrons na formação das ligações metálicas
Zn e Cd se dissolvem em ac. não oxidantes diluídos liberando H2 e
Hg não reage
Os três reagem com ac. oxidantes, como HNO3 e H2SO4
concentrados, formando sais e liberando uma mistura de óxidos de
nitrogênio e de SO2, respectivamente
Zn é o único do grupo que tem propriedades anfóteras de modo
semelhante aos aluminatos
Formam sulfetos insolúveis
Formam ligas com diversos metais. Com Hg são denominadas
amálgamas.
Zn2+ e Cd2+ formam complexos com ligantes doadores de O, N e S, e
também com haletos. Geralmente são tetraédricos. Mas podem
formar complexos octaédricos.
Hg2+ forma complexos com ligantes doadores de N, P e S ecom
menos facilidade com doadores de O. Geralmente são octaédricos
distorcidos (2 ligações mais curtas e 4 mais longas)
ligas metálicas: latão e bronze e ligas para soldas
baterias.
revestimento de peças de aço para prevenir a corrosão.
é um elemento essencial para o crescimento de homens e animais.
Medicamentos
Na forma de sulfeto de Zinco (ZnS) dopado com metais como o Cu e
Bi se produz pigmentos fosforescentes utilizados em televisores e
relógios.
eletrodeposição e em vários tipos de soldas.
bateria recarregável (Ni-Cd)
compostos de cádmio são usados para produzir as cores verde e azul nas
telas de TV.
ligas de baixo ponto de fusão e reduzido coeficiente de atrito
tintas: CdS é um pigmento amarelo e CdSe - é um pigmento vermelho
termômetros, barômetros, lâmpadas de vapor de mercúrio,
chaves elétricas.
baterias
catalisador
HgS
Bibliografia
1.
Atkins, P., Jones, L., Princípios de Química - Questionando a Vida Moderna e o Meio
Ambiente, 3 ed., Porto Alegre: Bookman, 2006.
2.
Shriver, D. F., Atkins, P., Química Inorgânica, Ed Artmed, 2003 .
3.
Lee, J. D., Química Inorgânica Não Tão Concisa. Edgard Blucher Ltda, 3’ ed., São Paulo, 1980
4.
http://www.quimlab.com.br/guiadoselementos
5.
http://periodictable.com/index.html