METABOLISMO DE LIPÍDEOS
1. Β-oxidação de ácidos graxos - Síntese de acetil-CoA - ciclo de Krebs Cadeia transportadora de elétrons e fosforilação oxidativa
2. Síntese de corpos cetônicos
3. Síntese de colesterol
4. Síntese de triglicerídeos
Profa. Dra. Celene Fernandes Bernardes
Referências: Princípios de bioquímica – Lehninger
Bioquímica – Campbell
Bioquímica Ilustrada - champe
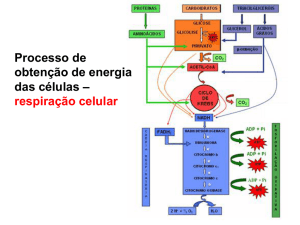
Após uma refeição rica em calorias, GLICOSE, ÁCIDOS GRAXOS e AMINOÁCIDOS entram no fígado. A liberação de insulina em
resposta a alta concentração de glicose no sangue, estimula a captação de glicose pelos tecidos. Parte da glicose é exportada para o
cérebro para suprir a sua necessidade energética, e também para os músculos e tecido adiposo. No fígado, o excesso de glicose é
oxidado a acetil-coA, que, posteriormente pode, via ciclo de Krebs e cadeia transportadora de elétrons, gerar ATP, como pode ser
utilizado na síntese de glicogênio e ser armazenado no fígado e músculos. Outra parte da glicose pode ser convertida em ácido graxo
para síntese de triglicerídeo (TAG) que são exportados para tecido adiposo e músculos. Excesso de aminoácidos pode ser convertido
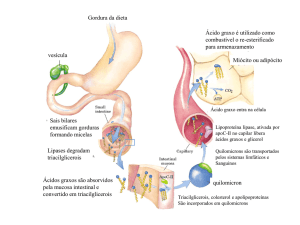
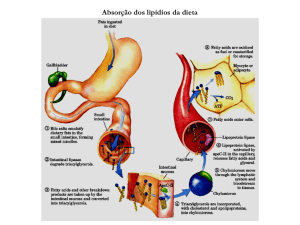
para piruvato e acetil-CoA, que também são utilizados na síntese de lipídeos. Ácidos graxos da dieta podem ser transferidos
diretamente, via sistema linfático, do intestino para músculos e tecido adiposo.
Estado de jejum – após algumas horas sem ingestão de alimentos, a principal função do fígado é fornecer glicose para o cérebro.
Glicogênio hepático é degradado e a glicose-1-fosfato produzida é convertida a glicose-6-fosfato e, posteriormente, em glicose livre,
que é liberada no sangue. Aminoácidos resultantes da degradação de proteínas e glicerol proveniente de triglicerídeos do tecido
adiposo, são usados para síntese de glicose (gliconeogênese). O fígado utiliza ácido graxo como principal fonte de energia e o excesso
de acetil-CoA é convertido em corpos cetônicos e exportados para outros tecidos, aonde serão convertidos em energia. O cérebro é
especialmente dependente de corpos cetônicos quando ocorre baixo suprimento de glicose.
GLUCAGON
Referência – Bioquímica - ChampeBioquímica - Lehninger
METABOLISMO ENERGÉTICO DE LIPÍDEOS
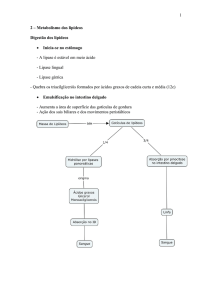
1. Lipólise dos triglicerídeos de reserva ou dos obtidos através da dieta
2. Oxidação de ácidos graxos na matriz mitocondrial
Referência – Metabolismo – Marek Dominiczak
Entrada de ácidos graxos na matriz mitocôndrial -
Ácidos graxos originados da dieta
(digestão de triglicerídeos) ou de
estoques intracelulares (lipólise
hormônio dependente)
Referência – Bioquímica – Lehninger
Bioquímica - Marks-
Entrada de ácidos graxos na mitocôndria através do transporte acil carnitina/carnitina –
No citosol, os ácidos graxos são ativados (R-CO-SCoA) e reagem com a carnitina, formando ácido graxocarnitina (R-CO-carnitina), num processo catalisado pela enzima carnitina acil-transferase I (na figura
anterior está exemplificada para o ácido graxo palmítico = CPT-1). Nesta forma, os ácidos graxos entram
no espaço intermembranas e são transportados para a matriz através da membrana mitocondrial interna,
num processo de difusão facilitada. Na matriz, o grupo acil do ácido graxo é transferido para a coenzima A,
liberando a carnitina que retorna para o espaço intermembranas. Este processo é catalisado pela enzima
carnitina acil-transferase II. A enzima carnitil-acil transferase I é inibida por alta concentração de malonilCoA (precursor da síntese de ácidos graxos), por alta concentração de acetil-coA no citosol e alta
concentração de ATP, sinalizando que os ácidos graxos não precisam entrar na mitocôndria para serem
oxidados e gerarem ATP. Esta enzima é que regula a beta-oxidação de ácidos graxos.
Oxidação de ácidos graxos: β-oxidação,
ciclo de Krebs, cadeia mitocondrial de
transporte de elétrons e síntese de ATP.
Estágio 1 - A cadeia hidrocarbonada de ácidos graxos
é oxidada de dois em dois carbonos, à partir da
extremidade acetil, liberando acetil-CoA. Este
processo é denominado de β-oxidação de ácidos
graxos.
Estágio 2 – Os grupos acetil são oxidados a CO2
através das reações do ciclo de Krebs.
Estágio 3 – elétrons derivados de reações de
oxidação nos estágios 1 e 2 são transportados para o
O2 via cadeia transportadora de elétrons mitocondrial,
liberando energia para síntese de ATP através do
processo da fosforilação oxidativa.
Referência – Bioquímica - Lehninger
β-oxidação de ácidos graxos - através da
sequência de reações demonstradas ao lado,
um resíduo acetil é removido do ácido graxo na
forma de acetil-CoA. A cadeia de ácido graxo
fica com dois átomos de carbono a menos e
pode reiniciar a sequência de reações, até que
todo o ácido graxo tenha sido convertido em
unidades de acetil-CoA.
Referência – Bioquímica - Lehninger
Ácido graxo
β-oxidação
ciclo Krebs
acetil-CoA
CO2 + H2O + energia
RENDIMENTO ENERGÉTICO
oxidação de uma molécula do ácido graxo Palmítico (16 CARBONOS)
a) Uma volta pelo ciclo da β –oxidação
Palmitotil-CoA + CoA + FAD + NAD+ + H2O
(16 carbonos)
miristoil-CoA + acetil-CoA + FADH2 + NADH + H+
(14 carbonos) (2 carbonos)
b) Oxidação total do ácido graxo = sete voltas pelo ciclo da β –oxidação
Palmitotil-CoA + 7CoA + 7FAD + 7NAD+ 7H2O
(16 carbonos)
8acetil-CoA + 7FADH2 + 7NADH + 7H+
(2 carbonos)
Considerando 3ATP para cada NADH e 2ATP para cada FADH2
8 acetil-CoA (no ciclo de Krebs) = 8 x 12 ATP = 96 ATP
7 FADH2 (na cadeia respiratória) = 7 x 2 ATP = 14 ATP
7 NADH (na cadeia respiratória) = 7 x 3 ATP = 21 ATP - total de 131 ATP
Considerando informações mais recentes, aonde a oxidação de 1 FADH2 resulta 1,5
ATP e um NADH, 2,5 ATP, o rendimento energético da oxidação completa do ácido
palmítico resultaria em 108 ATP.
Referência – Bioquímica - Lehninger
Síntese de corpos cetônicos no fígado e utilização nos tecidos periféricos - Em
situação de jejum ou baixa concentração de glicose plasmática ocorre a síntese de corpos
cetônicos no fígado, a partir do catabolismo de ácidos graxos e aminoácidos.
Os corpos cetônicos são oxidados pelos tecidos extra-hepáticos, resultando em energia através
do ciclo de Krebs.
Corpos cetônicos no plasma sanguíneo = cetose
Síntese de corpos cetônicos
pK 3,5
+ H+
HO
pK 4,7
+ H+
HO
Formação de corpos cetônicos à partir de acetil-CoA - Normalmente, a síntese de corpos cetônicos
é relativamente baixa. Quando acumula acetil-CoA (por exemplo no diabetes hiperglicêmico ou em baixa
concentração de glicose) a enzima tiolase catalisa a condensação de 2 moléculas de acetil-CoA
formando acetoacetil-CoA, que, em seguida deriva os três compostos denominados de corpos cetônicos
(acetoacetato, acetona e β-hidroxibutirato). As reações de síntese de corpos cetônicos ocorrem na
matriz de mitocôndrias hepáticas. O HMG-CoA é também um intermediário na síntese de esterol.
No pH do plasma sanguíneo, os corpos cetônicos dissociam, liberando H+ e podendo acarretar acidose
metabólica (cetoacidose)
Regulação coordenada da síntese e consumo de ácidos graxos – Quando carboidratos são
fornecidos pela dieta, a oxidação de ácidos graxos não é necessária. Duas enzimas regulam o processo: a
acetil-CoA carboxilase (ACC = primeira enzima da síntese de ácido graxo) é ativada, direcionando o processo
para a síntese de ácido graxo e a enzima carnitina acil transferase I é inibida, limitando o transporte de ácido
graxo para a matriz mitocondrial e, consequentemente, inibindo a oxidação dos mesmos. A ingestão de alta
concentração de carboidrato e consequente aumento do nível de glicose no sangue desencadeia a síntese de
insulina que ativa a ACC. A ACC ativa a formação de malonil-CoA (primeiro intermediário da síntese de ácido
graxo) e a malonil-CoA inibe a carnitina acil-transferase I, prevenindo a entrada e oxidação de ácido graxo na
matriz mitocondrial. Quando diminui o nível de glicose sanguínea, o glucagon ativa a proteína quinasedependente de AMPc (PKA), que inativa a ACC. A concentração de malonil-CoA diminui e ácido graxo pode
entrar na matriz mitocondrial, aonde será oxidado. Devido o glucagon estimular a mobilização de ácidos
graxos do tecido adiposo, ocorre aumento de ácido graxo no sangue facilitando a obtenção de energia devido
à oxidação mitocondrial hepática destes compostos.
Regulação da síntese de triglicerídeos pela insulina – A
insulina estimula a conversão de carboidratos e aminoácidos da dieta
para ácidos graxos. Em baixa concentração de insulina (por exemplo no
diabetes) diminui a síntese de ácido graxo e o acetil-CoA resultante do
catabolismo de carboidratos e aminoácidos é convertido em corpos
cetônicos.
Biossíntese de colesterol
Regulação do balanço da síntese e captação de colesterol da dieta - Glucagon promove
a fosforilação e consequente inativação da HMG-CoA redutase (enzima da síntese de colesterol
endógeno). Insulina promove a desfosforilação e ativação da mesma enzima.