http://dioquimica.blogspot.com.br/2011/09/blog-post.html
http://tiagosilva.org/files/imagepicker/t/Tiago/tabela-periodica1.jpg
http://redeglobo.globo.com/globociencia/noticia/2012/03/saiba-como-tabela-periodica-foi-preenchida-ao-longo-dos-seculos.html
Tabela periódica: periodicidade das propriedades físicas e químicas dos elementos.
http://portaldoprofessor.mec.gov.br
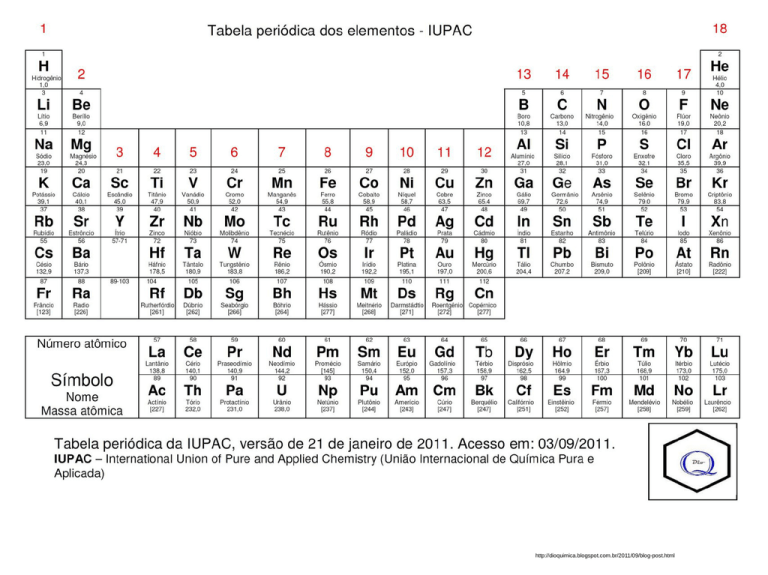
Tabela periódica
http://pt.wikipedia.org/wiki/Tabela_peri%C3%B3dica
http://conhecerparadebater.blogspot.com.br/2011/08/pesos-atomicos-nao-sao-constantes-da.html
Massa atômica e isótopos
http://www.tabelaperiodicacompleta.
com/elemento-quimico/hidrogenio
http://fisicosequimicos.blogspot.com.br/2010_12_01_archive.html
http://www.sempretemmais.com/wp-content/uploads/2012/03/tabela_periodica_medeiros.jpg
Propriedades Periódicas dos
Elementos Químicos
Raio atômico
http://www.tabelaperiodicacompleta.com/pr
opriedades-periodicas
http://wikiciencias.casadasciencias.
org/index.php/Raio_at
%C3%B3mico
Propriedades Periódicas dos
Elementos Químicos
Raio atômico
http://wikiciencias.casadasciencias.org
/index.php/Raio_at%C3%B3mico
https://flaviogimenes.wordpress.com/2011/04/
Propriedades Periódicas dos
Elementos Químicos
Raio atômico e carga nuclear efetiva
Mg
12
carga nuclear efetiva
S: número de elétrons entre o núcleo e o(s) elétron(s) em questão.
Raio atômico e carga nuclear efetiva
x
3,3+
Raio atômico e carga nuclear efetiva
Aumento vertical:
aumenta número de camadas (distância entre as cargas – prótons e elétrons) –
menor atração dos elétrons pelo prótons e;
aumenta a blindagem dos elétrons internos – menor carga nuclear efetiva.
Redução horizontal (esquerda para direita):
mesmo número de camadas:
blindagem semelhante.
Aumento da carga nuclear
Exercício
1) Preveja o comprimento das ligações C-S, C-H e S-H para a molécula de CH SH
3
(metilcarptana usada para dar mau cheiro ao gás de cozinha).
Raios atômicos (Å): C (0,77), S (1,02) e H(0,37).
Exercício
2) Recorrendo à tabela periódica, organize os seguintes átomos em ordem crescente
de tamanho:
P, S, As e Se.
15 16 33
34
Tamanho de átomos e íons
Exercício
1) Ordene os átomos e íons a seguir em ordem crescente de tamanho: Mg
2+
2+
, Ca e Ca.
Exercício
222)Qual dos átomos e íons é maior: S , S ou O ?
Tamanho de átomos e íons
Íons isoeletrônicos
Exercício
2- - +
2+
1) Coloque os íons S , Cl , K e Ca em ordem decrescente de tamanho.
Exercício
+
2+
3+
2)Qual dos seguintes íons é o maior: Rb , Sr ou Y ?
Propriedades Periódicas dos
Elementos Químicos
Energia de ionização
Energia necessária para remover um elétron de
um átomo.
Primeira Energia de ionização (I ) para o átomo de sódio:
1
Na(g)
+
Na (g) + e
Segunda Energia de ionização (I ) para o átomo de sódio:
1
+
Na (g)
2+
Na (g) + e
Propriedades Periódicas dos
Elementos Químicos
Energia de ionização
Energia necessária para remover um elétron de um
átomo.
http://www.tabelaperiodicacompleta.com/propriedades-periodicas
1 EI
Menos e
-
2 EI
Menor raio
3 EI
... EI
Maior atração sobre e
Maior EI
Energia de ionização
Exercício
1) Quem terá a maior terceira energia de ionização, Ca ou S?
Exercício
2) Três elementos estão indicados na tabela periódica abaixo. Baseado em suas
localizações, determine qual terá a segunda maior energia de ionização.
Propriedades Periódicas dos
Elementos Químicos
Energia de ionização
http://zeus.qui.ufmg.br/~qgeral/?attachment_id=460
Propriedades Periódicas dos
Elementos Químicos
Afinidade eletrônica
Energia liberada quando um elétron é
adicionado a um átomo.
Cl(g) + e
-
-
Cl (g) DE = -349 kJ / mol
2 5
[Ne] 3s 3p
Ar(g) + e
-
2 6
[Ne] 3s 3p
2 6
[Ne] 3s 3p
-
Ar (g) DE>0
2 6 1
[Ne] 3s 3p 4s
Afinidade eletrônica
Propriedades Periódicas dos
Elementos Químicos
Eletronegatividade
Atração do núcleo de um átomo sobre os
elétrons compartilhados numa ligação
química
http://www.tabelaperiodicacompleta.com/propriedades-periodicas
Escala de Eletronegatividade de Pauling:
a primeira e mais usada
Propriedades Periódicas dos
Elementos Químicos
Eletronegatividade
Propriedades Periódicas dos
Elementos Químicos
Revisão
Metais - óxidos
●
●
Oxigênio – abundante no ambiente.
São básicos (maioria) e os solúveis em água
formam hidróxidos, quando dissolvidos:
Óxido metálico + água
hidróxido metálico
Na2O(s)
+ H2O(l)
2NaOH (aq)
CaO(s)
+ H2O(l)
Ca(OH)2 (aq)
●
Íon óxido + água
hidroxila
O2-(aq) + H2O(l)
2OH-(aq)
Metais - óxidos
●
São básicos (maioria) e reagem com ácidos
formando sal e água:
Óxido metálico + ácido
sal
+
água
Na2O(s) + 2HCl(aq)
2NaCl(aq) + H 2O(l)
CaO(s) + 2HCl(aq)
CaCl2(aq) + H2O(l)
Não-metais - óxidos
●
●
Oxigênio – abundante no ambiente.
São ácidos (maioria) e os solúveis em água
formam ácidos, quando dissolvidos:
Óxido não-metálico + água
CO2(g)
+
ácido
H2O(l)
H2CO3(aq)
P4O10(s) + 6H2O(l)
4H3PO4(aq)
CÁ
HC
SO2(g) + H2O(l)
H2SO3(aq) U I
SO3(g) + H2O(l)
H2SO4(aq) V D
AA
Combustão de combustíveis fósseis (do petróleo e carvão)
Não-metais - óxidos
●
São ácidos (maioria) e reagem com bases
formando sal e água:
Óxido não-metálico + base
CO2(g) + 2NaOH(aq)
sal
+ água
Na2CO3(aq) + H2O(l)
Metalóides
●
Propriedades intermediárias entre metais e
não-metais
Ex.: Silício
● Aparência de metal;
●
quebradiço
(não maleável);
pior condutor de
calor e eletricidade
do que metais
(semicondutor):
➔ circuitos integrados e
➔ chips de computador.
●
Grandes cristais de Si
são separados em finos
wafers (finas placas) para
uso em circuitos.
Bibliografia
Química, a ciência central. Theodore l. Brown, H. Eugene LeMay, Jr.,
Bruce E. Bursten; São Paulo: Pearson Prentice Hall, 2005.
Demais referências nos slides.