2.a SÉRIE - LIVRO 1
ENSINO MÉDIO
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
© 2006-2009 – IESDE Brasil S.A. É proibida a reprodução, mesmo parcial, por qualquer processo, sem autorização por escrito dos autores e do
detentor dos direitos autorais.
I229
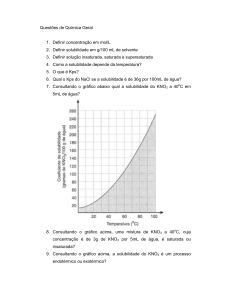
IESDE Brasil S.A. / Ensino Médio / IESDE Brasil S.A.
— Curitiba : IESDE Brasil S.A., 2009.
[2.a Série –
Livro 01]
600 p.
ISBN: 978-85-387-0319-8
1. Ensino Médio. 2. Educação. 3. Estudo e Ensino. I. Título.
CDD 370.71
Disciplinas
Autores
Língua Portuguesa
Literatura
Matemática
Física
Química
Biologia
História
Geografia
Francis Madeira da S. Sales
Márcio F. Santiago Calixto
Rita de Fátima Bezerra
Fábio D’Ávila
Danton Pedro dos Santos
Feres Fares
Haroldo Costa Silva Filho
Jayme Andrade Neto
Renato Caldas Madeira
Rodrigo Piracicaba Costa
Cleber Ribeiro
Marco Antonio Noronha
Vitor M. Saquette
Edson Costa P. da Cruz
Fernanda Barbosa
Fernando Pimentel
Hélio Apostolo
Rogério Fernandes
Jefferson dos Santos da Silva
Marcelo Piccinini
Rafael F. de Menezes
Rogério de Sousa Gonçalves
Vanessa Silva
Duarte A. R. Vieira
Enilson F. Venâncio
Felipe Silveira de Souza
Fernando Mousquer
Produção
Projeto e
Desenvolvimento Pedagógico
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
QUÍMICA
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
Hidrólise Salina
e produto de
solubilidade
Hidrólise salina
Hidrólise salina e solo
EM_2S_QUI_029
Corel Image Bank.
O pH do solo depende da sua composição.
Terrenos pantanosos têm pH por volta de 3,5,
devido à presença de grande quantidade de ácidos
provenientes do húmus.
Terrenos sedimentares, formados por sílica (SiO2),
devido à formação em pequena quantidade de ácido
silícico (H4SiO4), apresentam pH próximo de 6,0.
Terrenos de origem vulcânica, ricos em silicatos
de cálcio e magnésio, devido à sua hidrólise, apresentam pH superior a 7: SiO4–4 + 4 HOH
H4SiO4
+4 OH–
Regiões de solo calcário (carbonatos de cálcio,
magnésio etc.) já apresentam pH muito maior, por
volta de 9.
Para corrigir a acidez dos solos, podemos adicionar CaO: CaO + H2O
Ca(OH)2
Ca+2 + 2 OH–
É muito mais barato,
no entanto, adicionamos
CaCO3, o qual, por hidrólise ácida, também produz
Ca(OH)2.
Dica: no seu jardim,
você pode jogar cascas de
ovo para diminuir a acidez, pois a casca do ovo é
composta de CaCO3.
A dissolução de sais em água pode originar
soluções ácidas, básicas ou neutras.
Este fenômeno é conhecido por hidrólise.
A hidrólise de um sal é a reação do sal com
água, produzindo ácido e base. É, portanto, a reação
inversa da salificação ou neutralização.
O cátion do sal identifica a base da qual ele
deriva, enquanto o ânion identifica o ácido.
Sal
Base de
origem
NH4OH: fraca
NaOH: forte
NH4Br
NaCN
Ácido de
origem
HBr: forte
HCN: fraco
Sais podem ser separados em quatro grupos,
segundo a base e o ácido de origem:
Sal
NH4Br
NaCN
NH4CN
NaBr
Base
de origem
NH4OH: fraca
NaOH: forte
NH4OH: fraca
NaOH: forte
Ácido
de origem
HBr: forte
HCN: fraco
HCN: fraco
HBr: forte
Sal de ácido forte e base fraca
NH4Br + H2O
NH4+ + Br- + H2O
NH4+ + H2O
HBr + NH4OH
H+ + Br- + NH4OH
H+ + NH4OH
O íon NH4+ sofre a hidrólise, liberando íons H+,
que conferem à solução caráter ácido.
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
1
Sal de ácido fraco e base forte
NaCN + H2O
Na+ + CN- + H2O
CN + H2O
-
HCN + NaOH
HCN + Na+ + OHHCN + OH-
Não ocorre hidrólise, pois ambos os íons gerados
na dissolução do sal, mesmo reagindo com a água
formariam os ácido e base forte originais, que se
dissociam fortemente. A solução resultante é neutra
(pH = 7).
Ácido
Base
Caráter da solução
Forte
Fraca
ácida
O íon CN – sofre a hidrólise, liberando íons OH–,
que conferem à solução caráter básico.
Sal de ácido fraco e base fraca
HCN + NH4OH
NH4 + CN + H2O
HCN + NH4OH
-
não se ionizam
Os íon NH4+ e CN – sofrem a hidrólise, mas como
o ácido e a base são fracos, não há liberação de H+ ou
OH –, não alterando significativamente o pH.
A solução resultante será ácida se o ácido formado apresentar constante de ionização mais alta
que a da base. A solução resultante será básica se
a base apresentar constante de ionização mais alta
que a do ácido. A solução resultante será neutra
se as constantes de ionização do ácido e da base
forem equivalentes.
Ka> Kb: pH ligeiramente menor que 7 (ácido).
Ka< Kb: pH ligeiramente maior que 7 (básico).
``
básica
Fraca
neutra
Forte
Forte
neutra
Constante de hidrólise
A reação de hidrólise, tanto do cátion como do
ânion, constitui um sistema em equilíbrio, de modo
que podemos aplicar a lei da ação das massas (Lei
de Guldberg-Waage).
A constante de hidrólise (Kh) pode ser expressa
em função da constante de ionização do respectivo
ácido ou base fraco.
Generalizando: a constante de hidrólise é igual
ao produto iônico da água dividido pela constante da
“parte fraca” que origina o sal:
Ácido
Forte
Base
Forte
Solução
Neutra
⇒ NH41+ + CN1– + HOH
NH4OH + HCN
HCN ⇒H1+ + CN1– Ka, HCN = 5 x 10–10
NH4OH H41+ + OH1–
Kb, NH4OH = 2 x 10–5
Como a constante de ionização da base fraca é mais alta
que a do ácido fraco, a solução será levemente básica.
Forte
Fraca
Ácida
Kh =
Kw
Kb
Fraco
Forte
Básica
Kh =
Kw
Ka
Fraco
Fraca
Neutra
Forte
Forte
Neutra
Kh =
Kw
Ka . Kb
Não há hidrólise
É a razão entre o número de íons que se encontram hidrolisados e o de íons inicialmente dissolvidos
em água.
número de íons hidrolisados
h =
número de íons inicialmente dissolvidos
Kh = M
Sal de ácido forte e base forte
NaBr + H2O
Na+ + Br- + H2O
2
Não há hidrólise
Grau de hidrólise
Exemplo:
NH4 CN
Forte
Fraco
H2O
HBr + NaOH
H+ + Br- + Na+ + OHH+ + OH-
2
h
Solução-tampão
Solução-tampão, Protetora ou Buffer tem como
finalidade manter o pH do meio praticamente constante, mesmo com adições moderadas de ácidos ou
bases.
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_2S_QUI_029
+
{
NH4CN + H2O
Fraco
``
Doar sangue é um ato de solidariedade
Ivan Meija.
As soluções-tampão são usadas sempre que um
químico necessita de um meio com pH aproximadamente constante. Elas são preparadas dissolvendose os solutos em água.
Pode ser formada por:
•• um ácido fraco com seu sal de base forte.
Exemplo:
HCN
+
NaCN
ácido fraco
sal de base forte
•• ou uma base fraca com seu sal de ácido
forte
``
Exemplo:
NH4OH +
NH4C
base fraca
sal de ácido forte
As soluções-tampão têm grande importância
biológica.
``
Exemplo:
, responsáveis pela
HCO3–/H2CO3 e HPO2 /
manutenção do pH do sangue.
Cálculo de pH e de pOH de
uma solução-tampão
Generalizando:
Cálculo do pH de uma solução-tampão formada por um ácido
fraco com seu sal de base forte
pH = pKa + log
[sal]
[ácido]
EM_2S_QUI_029
Cálculo do pOH de uma solução-tampão formada por uma base
fraca com seu sal de ácido forte
POH=Pkb +log
[sal]
[base]
A doação de sangue é uma ação de solidariedade e cidadania absolutamente importante
para a preservação de vidas e para a sociedade
como um todo.
No entanto, grande parte das pessoas
desconhece que doar sangue é um processo
simples, rápido e indolor. Diariamente, ocorrem
acidentes nas ruas, estradas, residências; como
resultado, muitos pacientes são operados em
situações emergenciais. Outros, aguardam nos
hospitais a presença de possíveis doadores.
O sangue, fluido essencial para a continuidade da vida, não tem até o momento nenhum
substituto, o que torna a doação voluntária
imprescindível para aqueles que necessitam
urgentemente de uma transfusão.
Imagine-se no lugar de alguém que esteja
enfrentando este problema, cuja solução depende de um doador voluntário.
Imagine se você estiver em um hospital
onde o seu tipo de sangue não estivesse disponível nos bancos, ou não fosse encontrado
um doador com um tipo de sangue compatível
com o seu; se o problema não for resolvido a
tempo, talvez você não sobreviva. Isso não é
lamentável?
Entretanto, todas estas eventualidades
poderiam ser evitadas se cada cidadão com
saúde se propusesse a doar sangue pelo menos duas vezes ao ano. Se isso acontecesse, os
bancos de sangue não necessitariam solicitar
tão frequentemente à comunidade doar sangue
em campanhas de doação.
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
3
Equilíbrio em sistemas
heterogêneos
``
Exemplos:
AgC , BaSO4
Quando uma solução apresenta soluto pouco
solúvel, podemos empregar uma constante chamada
produto de solubilidade (Kps, Ks ou PS)
•• para compostos do tipo (A2+)1 (B–)2 ou (A+)2
(B2–)1 Kps = 4M3
``
Exemplos:
Mg(OH)2 , Ag2S
Produto de solubilidade
É o produto das concentrações molares dos íons
elevados aos coeficientes estequiométricos de um
soluto pouco solúvel em sua solução saturada.
•• para compostos do tipo (A+)3 (B3–)1 ou (A3+)1
(B-)3 Kps = 27M4
``
Exemplos:
Ag3PO4 , A(OH)3
•• para compostos do tipo
(A2+)3(B3-)2 ou (A3+)2 (B2–)3
O precipitado de uma solução tem concentração
constante e, portanto, não participa da fórmula.
``
``
Kps = 108M5
Exemplos:
Ca3 (PO4)2 , Fe2 S3
Exemplos:
Sendo M (mol/L) a solubilidade de um composto iônico.
PbF2 (s) → Pb2+ (aq) + 2 F –(aq)
3 Ca2+ (aq) + 2 PO43- (aq)
KPS = [Ca2+]3 [PO43-]2 = (3 M)3 x (2 M)2 = 108M5
•• Se o produto dos íons < Kps
saturada
solução in-
•• Se o produto dos íons = Kps
turada
solução sa-
•• Se o produto dos íons > Kps
rada com corpo de fundo.
solução satu-
Podemos também usar a fórmula matemática
abaixo para acharmos a expressão de KPS.
PS = xx . yy . (M) x + y, isto é:
•• para compostos do tipo (An+)1 (Bn–)1
4
Kps = M2
A concentração de Ca2+ na água do mar é de
cerca de 10–3mol/ L, que é aproximadamente 50
vezes menos que a concentração do Na+.
A concentração é tão baixa assim porque os
corais, os moluscos e outros organismos marinhos
incorporam o cátion Ca2+ para a conversão em carbonato de cálcio na construção de suas conchas
e seus esqueletos.
O processo tem a vantagem do baixo produto de solubilidade do carbonato de cálcio,
KPS = 7,1 . 10–9mol2/ L2.
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_2S_QUI_029
Ca3(PO4)2 (s)
Comstok Complete.
KPS = [Pb2+] [F–]2 = M x (2 M)2 = 4M3
5. O valor numérico do produto de solubilidade de um
certo sulfeto MS é 1,0 . 10-10. Determine a solubilidade
desse sulfeto.
1. Solução aquosa ácida é obtida quando se dissolve em
água o sal:
a) NaHCO3
b) Na2SO4
``
Solução:
M1S1 PS = 11.11. M1 + 1 PS = M2
M = 10 -10 → M = 10–5 mol/ L
M = PS →
c) K2CO3
d) LiC
e) NH4C
``
1. (Unisa) O sal que, em solução aquosa, não produz efeito
sobre o papel de tornassol é:
Solução: E
Uma solução ácida será obtida quando o sal utilizado na
dissolução tiver íon positivo oriundo de base fraca e íon
negativo oriundo de ácido forte.
NH4C
NH4 + C + HOH
1+
(s)
NH4OH + H1+ + C
1–
1–
Kw
Ka
Kh = M αh2
2. (PUC-Campinas) As soluções aquosas e bem diluídas de
bicarbonato de sódio (NaHCO3) e carbonato de sódio
são, respectivamente:
a) básica e ácida.
b) básica e básica.
Kh =
–14
10
2x10–5
5x10–10 = 0,1α2h
50x10– = αh
Kh = 5x10–
c) ácida e básica.
10
d) ácida e ácida.
5x10–9 = α2h
e) neutra e básica.
7x10– ≅ αh
10
5
[OH–] = M α
[OH–] = 0,1x7x10–5
pOH = 5,16
pH = 8,84
[OH-] = 7x10–6
3. (Mackenzie) Um sal formado por base forte e ácido
fraco hidrolisa, ao se dissolver em água, produzindo uma
solução básica. Essa é uma característica do:
3. Descobrir o pH de uma solução-tampão formada por
ácido acético 0,01mol/L e acetato de sódio também
0,01mol/L. Dado: Ka = 2x10–5
a) Na2S
``
d) KNO3
Solução:
[sal]
[ácido]
[0,01]
5
pH = -log2 x 10 – + log
[0,01]
pH = -log2 - log10–5 + log1
pH = -0,3 + 5 + 0
c) (NH4)2SO4
4. (FEI) Os compostos cianeto de sódio (NaCN), cloreto
de zinco (ZnC 2), sulfato de sódio (Na2SO4) e cloreto de
amônio (NH4C ), quando dissolvidos em água, tornam
o meio respectivamente:
pH = 4,7
4. Sabendo que a solubilidade do AgC em água é de 1,3
· 10–5 mol/L, determine o valor numérico do produto de
solubilidade.
``
b) NaCl
e) NH4Br
pH = -logKa + log
EM_2S_QUI_029
c) NaC
e) NH4C
Solução:
Kh =
b) Na2CO3
d) CH3COONa
2. Prepara-se uma solução 0,1mol/L de acetato de sódio
(NaAc). Calcular o pH dessa solução, sabendo que a
constante do ácido acético é 2x10–5. Dados: Log 2 =
0,30; Log 3 = 0,47; Log 5 = 0,70 e Log 7 = 0,84
``
a) CuSO4
a) básico, ácido, ácido, neutro.
b) ácido, básico, neutro, ácido.
c) básico, neutro, ácido, ácido.
d) básico, ácido, neutro, ácido.
Solução:
PS = 11.11. M1 + 1
Ag1C 1
-5 2
10 )
PS = 1,69 . 10-10
PS = M2
→PS = (!,3 .
e) ácido, neutro, básico, básico.
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
5
5. (FEI) Dadas as substâncias NaC , H2O, NH4C , Na2SO4,
CH3COONa, KBr, KOH, NH3, NaOH, HBr, HC , H2SO4
e CH3COOH, indique com quais dessas substâncias
podemos formar:
a) uma solução-tampão de pH ácido.
b) uma solução-tampão de pH básico.
6. Um tampão é constituído de NH4OH(aq) 0,80mol/L e
NH4C (aq) 0,20mol/L. Se, para o hidróxido de amônio,
o valor de pKb é igual a 4,74, o pOH da solução-tampão
é (log 2 = 0,3)
e) Kps = 9x3
11. (PUC) Um composto pouco solúvel de fórmula B(OH)3
cuja solução saturada em dada temperatura vale x mols
/ l, terá constante do produto de solubilidade calculada
pela expressão:
a) Kps = x2
b) Kps = x3
c) Kps = x4
b) 4,44
d) Kps = 27x4
c) 4,74
e) Kps = 3x4
12. (USP) A solubilidade de um certo cloreto MC 2 em água
é de 1,0 x 10–3.mols/litro. O seu produto de solubilidade
será:
e) 5,34
Determine o pH de uma solução-tampão constituída por
ácido acético 0,1mol/L e acetato de sódio 0,01mol/L.
Dado: Ka=2x10–5; log 2=0,3; log 5=0,7
8. (Osec) Sendo a constante de ionização do ácido nitroso
a 25ºC da ordem de 4 . 10–4, podemos afirmar que a
constante de hidrólise do nitrito de sódio vale:
a) 2,5 . 10–11
a) 1,0 x 10–3
b) 1,0 x 10–6
c) 4,0 x 10–9
d) 2,0 x 10–9
e) 2,0 x 10–6
13. (USP) A solubilidade do hidróxido de estrôncio em água,
na temperatura ambiente, é de 4 x 10–2 moles por litro. O
produto de solubilidade do Sr(OH)2, portanto será de:
c) 25 . 10–10
d) 2,5 . 10–14
a) (4,0 x 10–2) (4,0 x 10–2)
e) 0,025 . 10–1
b) (4,0 x 10–2) (4,0 x 10–2)2
9. (Santa Casa) Para qual reação em equilíbrio, representada abaixo, o produto da concentração dos íons
(em mol/L) é denominado constante do produto de
solubilidade?
a) nH2O( ) H+(aq) + OH-(aq)
b) nH2O( )+ NH3(g)
NH4+(aq)+ OH-(aq)
c) nH2O( )+ CaCO3(s)
Ca2+(aq) + CO32-(aq)
d) nH2O( )+ H2SO4( )
H+(aq)+ SO42-(aq)
e) nH 2O( )+C 2H 5C ( ) C 2H 5OH(aq)+H +(aq)+C
(aq)
10. (PUC) Um composto pouco solúvel de fórmula B(OH)2
cuja solução saturada em dada temperatura, vale x mol/
L, terá constante do produto de solubilidade calculada
pela expressão:
a) Kps = 2x2
b) Kps = 4x3
c) (4,0 x 10–2) (8,0 x 10–2)
d) (4,0 x 10–2) (8,0 x 10–2)2
e) (4,0 x 10–2)2 (8,0 x 10–2)
14. Calcule o produto de solubilidade do CaF2 a 18°C, sabendo que a sua solubilidade é 2 . 10–5mol/L
15. Calcule a solubilidade do AgC sabendo-se que, a uma
certa temperatura, o seu produto de solubilidade é igual
a 4 . 10–10.
16. Sabendo-se que o produto de solubilidade do BaSO4
é 1,0 . 10–10, em qual das soluções abaixo haverá precipitação?
Solução I:
[Ba+2] = 1,0 . 10–6 mol/L e [SO4–2] = 1,0 . 10–6 mol/L
Solução II:
[Ba+2] = 1,0 . 10–5 mol/L e [SO4–2] = 1,0 . 10–5 mol/L
Solução III :
[Ba+2] = 1,0 . 10–4 mol/L e [SO4–2] = 1,0 . 10–4 mol/L
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_2S_QUI_029
b) 0,25 . 10–11
6
d) Kps = 2x3
a) 4,14
d) 5,04
7.
c) Kps = x2
17. A solubilidade do cloreto metálico, MeC 2, em água pura é
2,0 . 10-4 mol/L. Determine seu produto de solubilidade.
18. Um sal do tipo XY apresenta produto solubilidade
9,0 . 10–6. A esta temperatura qual a solubilidade em
água do referido sal?
[Dados: log 2 = 0,30; log 3 = 0,47; log 5 = 0,70 e
log 7 = 0,84]
6. Determine o pH de uma solução 0,5mol/L de brometo de
amônio (NH4Br), sabendo que a constante de ionização
do hidróxido de amônio é 1,8 . 10–5.
7.
1. Um químico necessita de uma solução aquosa de um sal
que apresente um pOH maior que 7. Para isso, poderá
usar uma solução de:
a) cloreto de sódio.
b) nitrato de amônio.
c) sulfato de sódio.
d) acetato de potássio.
e) qualquer um dos sais acima citados.
2. (Univ. São Francisco) Adicionando-se à água quantidades estequiométricas de:
I. cloreto de hidrogênio e hidróxido de potássio.
II. ácido sulfúrico e cal extinta.
III. carbonato de sódio e ácido acético.
Tem-se como resultante uma solução básica, apenas de:
a) I
b) II
c) III
[Dados: log 2 = 0,30; log 3 = 0,47; log 5 = 0,70 e
log 7 = 0,84]
São dissolvidos 5,35g de cloreto de amônio (NH4C) em
água suficiente para obter 500ml de solução. Sabendo
que a constante de ionização do hidróxido de amônio é
2 . 10–5, determine o pH da solução.
[Dados: log 2 = 0,30; log 3 = 0,47; log 5 = 0,70 e
log 7 = 0,84]
8. Qual o pH de uma solução 0,8mol/L de acetato de sódio,
sabendo que o grau de hidrólise é 7,5 . 10–6.
[Dados: log 2 = 0,30; log 3 = 0,47; log 5 = 0,70 e
log 7 = 0,84]
9. São preparados 500ml de uma solução de cianeto de
sódio (NaCN). Calcule a massa de cianeto de sódio que
foi dissolvida em água, sabendo que o pH da solução
é igual a 11 e que a constante de ionização do ácido
cianídrico é 2 . 10–9.
10. Calcule o pH de uma solução-tampão formada por
hidróxido de amônio 0,2mol/L e cloreto de amônio
0,02mol/L.
[Dado: Kb = 2 . 10–5 ; log 2=0,3; log 5=0,7]
11. Descubra o pH de uma solução-tampão formada por
ácido carbônico 0,5M e bicarbonato de sódio 0,05M.
[Dado: Ka=5x10–7; log 2=0,3; log 5=0,7]
d) I e II
e) II e III
3. (Unifor) Carbonato de sódio, quando dissolvido em
água, origina solução básica. Isso porque o ânion do
sal interage com a água, originando:
a) ácido fraco.
b) base fraca.
c) sal básico pouco solúvel.
d) sal ácido pouco solúvel.
e) gás de caráter ácido.
4. Calcular o pH de uma solução-tampão formada por
hidróxido de amônio 0,1mol/L e cloreto de amônio
0,02mol/L.
[Dado: Kb = 2x10 ].
5. Temos uma solução 0,05mol/L de cianeto de sódio
(NaCN). Determine o pOH dessa solução, sabendo que
a constante de ionização do ácido cianídrico é 2 . 10–9.
EM_2S_QUI_029
–5
12. Em estudos ligados à Medicina e à Biologia é muito
importante o conceito de solução-tampão, pois os
fluidos biológicos (animais ou vegetais) são, em
­geral, meios aquosos tamponados. Diga quais dentre os seguintes pares de substâncias, quando em
solução aquosa, produzem uma solução-tampão.
Explique o critério que você usou na escolha:
I. HC + NaOH
II. NaOH + NaC
III. HCN + NaCN
IV. N H4OH + NH4C
V. CH3COOH + CH3COONa
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
7
13. São dissolvidos 16,4g de acetato de sódio (CH3COONa)
em água suficiente para obter 500ml de solução. Sabendo
que a constante de ionização do ácido acético é 2 . 10–5,
calcule a molaridade da solução, a constante de hidrólise,
o grau de hidrólise, as concentrações hidrogeniônica e
hidroxiliônica e o pH da solução. [Dados: Log 2 = 0,30;
Log 3 = 0,47; Log 5 = 0,70 e Log 7 = 0,84]
14. Não se pode escrever o produto de solubilidade para o
sal Na2SO4, porque:
a) a fórmula está errada.
b) a substância não é sal.
c) a solução pode estar saturada.
d) porque a substância é bastante solúvel.
e) é possível escrever o P. S. para a substância.
20. (UFF) Assinale a opção que apresenta o pH no qual o
Mg(OH)2 começará a precipitar, a partir de uma solução
de Mg(NO3)2 0,100 M, após adição de NaOH: [KPS do
Mg(OH)2 = 1,0 . 10-11]
a) 4,0
b) 5,0
c) 7,0
d) 9,0
e) 12,0
21. (Cesgranrio) A uma solução 10-3 M de cloreto de magnésio adiciona-se solução concentrada de base forte
considerando-se, assim, desprezível a variação de volume. Calcule o pH necessário para que ocorra início da
precipitação de hidróxido de magnésio (KPS = 10-11).
15. Calcule o produto de solubilidade do Ca3(PO4)2, sabendo
que a sua solubilidade, numa certa temperatura, é de
6,2 . 10-6 g/L.
17. A solubilidade do PbBr2 é 3,67g/L. Qual o produto
de solubilidade do sal em questão na temperatura da
experiência?
18. (Cesgranrio) O CaCO3 é um sal pouco solúvel em água.
Sabendo-se que o produto de solubilidade do CaCO3, a
25 oC, é igual a 4,0 x 10-10, a quantidade máxima desse
sal que se dissolverá em 200mL de água, nessa temperatura, conside­rando desprezível a variação de volume
nessa dissolução, será de:
Das seguintes soluções de sais de sódio, de
concetração 0,01mol/ L
I. carbonato
II. cromato
a) 2,0 . 10-5 g
III. oxalato
b) 4,0 . 10-4 g
IV. sulfeto
c) 8,0 . 10-4 g
V. sulfato
d) 2,0 . 10-2 g
Dados: produto de solubilidade, a 25°C
a) PbS
7,0 . 10–29
e) 4,0 . 10-2 g
19. (UFF) O seguinte equilíbrio ocorre em meio aquoso:
KPS(PbI2) = 8,3 . 10–9
PbI2(s) Pb2+(aq) + 2 I–(aq)
Pode-se afirmar que:
a) se [Pb2+] [I–]2 = KPS, então a solução é insaturada.
b) se [Pb2+] [I–]2 > KPS, então a solução é saturada.
c) se [Pb2+] [I–]2 < KPS, então a solução é supersaturada.
d) se [Pb2+] [I–]2 = KPS, então a solução é saturada.
e) se [Pb2+] [I–]2 > KPS, então a solução é insaturada.
8
22. (PUC) Água e ar contaminados por substâncias
compostas de chumbo podem provocar alterações
cerebrais gravíssimas, se ingeridos em altas concen­
trações ou por tempo prolongado. Suponha que se
queira eliminar, por precipitação, os íons Pb2+(aq)
existentes em uma solução.
b) PbCrO4 1,8 . 10–14
c) PbCO3 1,5 . 10–13
d) PbC2O4 8,3 . 10–12
e) PbSO4
1,3 . 10–9
Qual irá reter maior quantidade de íons Pb2+(aq), na
forma do sal insolúvel?
23. Qual o pH de uma solução saturada de Mg(OH)2?
Dado: PS = 8 . 10-12
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_2S_QUI_029
16. Quantos gramas de BaSO4 são necessários para preparar 1L de solução saturada, sabendo que o produto
de solubilidade desse sal é 1,1 . 10-10 ?
14. 3,2 . 10-14
15. 2 . 10-5
16. Solução I
1. C
17. 3,2 . 10-11
2. B
18. 3,0 . 10-3 mol/L 3. A
4. D
5.
a) CH3COOH, CH3COONa, H2O (solvente).
b) N H3, NH4C , H2O (solvente).
6. A
7.
pH = 3,7
8. A
9. C
10. B
EM_2S_QUI_029
11. D
12. E
13. D
1. D
2. C
3. A
4. pH = 10
5. 3,3
6. 4,8
7.
5
8. 8,77
9. 4,9
10. 10,3
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
9
11. 5,3
12. III, IV e V.
III e V → ácido fraco com seu sal de base forte.
IV → base fraca com seu sal de ácido forte.
13. 0,4; 5x10-9; 3,53x10-5; 7x10-10, 1,4x10-5, 9,16
14. D
15. 3,45 . 10-37
16. 2,44 . 10-3g
17. 4,0 . 10-6
18. B
19. D
20. D
21. 10
22. A solução IV.
10
EM_2S_QUI_029
23. pH = 10,3
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
EM_2S_QUI_029
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br
11
EM_2S_QUI_029
12
Esse material é parte integrante do Aulas Particulares on-line do IESDE BRASIL S/A,
mais informações www.aulasparticularesiesde.com.br