Lúcio Flávio Barbour Fernandes
PERFIL BIOQUÍMICO E CARACTERÍSTICAS CLÍNICAS DOS PACIENTES COM SUSPEITA DE
TROMBOSE VENOSA PROFUNDA E TROMBOEMBOLISMO PULMONAR, TRATADOS NO
HOSPITAL DE CÂNCER
Dissertação apresentada ao programa de
Pós-graduação da Fundação Pio XII –
Hospital de Câncer de Barretos para
obtenção do título de Mestre em Ciências da
Saúde.
Área de Concentração: Oncologia
Orientador: Prof. Dr. Adhemar Longatto
Filho
Co-orientador: Prof. Dr. José Humberto
Tavares Guerreiro Fregnani
Barretos
2015
FICHA CATALOGRÁFICA
Preparada por Rafael de Paula Araújo CRB 8/9130
Biblioteca da Fundação Pio XII – Hospital de Câncer de Barretos
F363p Fernandes, Lúcio Flávio Barbour
Perfil bioquímico e características clínicas dos pacientes com
suspeita de trombose venosa profunda e tromboembolismo
pulmonar, tratados no Hospital de Câncer / Lúcio Flávio Barbour
Fernandes. - Barretos, SP 2015.
89 f. : il.
Orientador: Prof. Dr. Adhemar Longatto Filho
Co-orientador: Prof. Dr. José Humberto Tavares Guerreiro Fregnani
Dissertação (Mestrado em Ciências da Saúde) – Fundação Pio XII –
Hospital de Câncer de Barretos, 2015.
1.Câncer. 2.Trombose venosa. 3.Embolia pulmonar. 4.Interleucina-6
6. 5.Dímero-D. 6.P-Selectina. I. Autor. II. Longatto Filho, Adhemar
CDD 616.200428
FOLHA DE APROVAÇÃO
Lúcio Flávio Barbour Fernandes
Perfil Bioquímico e Característica Clínicas dos Pacientes com Suspeita de Trombose Venosa
Profunda e Tromboembolismo Pulmonar, Tratados no Hospital de Câncer
Dissertação apresentada ao Programa de Pós-Graduação da Fundação Pio XII – Hospital de Câncer de
Barretos para obtenção do Título de Mestre em Ciências da Saúde - Área de Concentração: Oncologia
Data da aprovação: 26/02/2015
Banca Examinadora:
Prof. Dr. Euclides Timoteo da Rocha
Instituição: Fundação Pio XII - Hospital de Câncer de Barretos
Prof. Dr. José Carlos Nicolau
Instituição: Instituto do Coração do Hospital das Clínicas da Faculdade de Medicina da Universidade
de São Paulo – FMUSP
Prof. Dr. Adhemar Longatto Filho
Orientador
Dr. José Humberto Tavares Guerreiro Fregnani
Presidente da Banca
SUPORTE À PESQUISA POR AGÊNCIA DE FOMENTO
Este trabalho recebeu apoio da Fundação de Amparo a Pesquisa do Estado de São Paulo
(FAPESP) através de Auxílio à Pesquisa – Regular (processo número 2013/13124-0).
As opiniões, hipóteses e conclusões ou recomendações expressas neste material são de
responsabilidade dos autores e não necessariamente refletem a visão da FAPESP.
Esta dissertação foi elaborada e está apresentada de acordo com as normas da PósGraduação do Hospital de Câncer de Barretos – Fundação Pio XII, baseando-se no Regimento
do Programa de Pós-Graduação em Oncologia e no Manual de Apresentação de Dissertações
e Teses do Hospital de Câncer de Barretos. Os pesquisadores declaram ainda que este
trabalho foi realizado em concordância com o Código de Boas Práticas Científicas (FAPESP),
não havendo nada em seu conteúdo que possa ser considerado como plágio, fabricação ou
falsificação de dados. As opiniões, hipóteses e conclusões ou recomendações expressas
neste material são de responsabilidade dos autores e não necessariamente refletem a visão
da Fundação Pio XII – Hospital de Câncer de Barretos.
Embora o Núcleo de Apoio ao Pesquisador do Hospital de Câncer de Barretos tenha
realizado as análises estatísticas e orientado sua interpretação, a descrição da metodologia
estatística, a apresentação dos resultados e suas conclusões são de inteira responsabilidade
dos pesquisadores envolvidos.
DECLARAÇÃO DE CONFLITO DE INTERESSE
Os pesquisadores declaram não haver qualquer conflito de interesse relacionado a
este estudo.
Dedico este trabalho à Nicole Maria Pupin Fernandes e João Vitor Pupin Fernandes, que
souberam aceitar minha opção por trilhar um longo caminho, apoiar as escolhas quando
nem mesmo eu sabia o que fazer, estimularam nos momentos difíceis e compreender a
minha ausência em muitos momentos importantes.
AGRADECIMENTOS
Ao meu orientador, Prof. Dr. Adhemar Longatto Filho, por compartilhar comigo parte
de seu enorme conhecimento e pela sua inegável capacidade de fazer amigos, mostrando
que é possível crescer como profissional, com ética, respeito e objetividade, assim como
enriquecer com as inúmeras amizades conquistadas ao longo da jornada de trabalho,
transformando o trabalho árduo em rotina agradável.
Ao meu co-orientador Prof. Dr. José Humberto Tavares Guerreiro Fregnani, que, além
de impressionar pela sua capacidade técnica, é um convite aos novos pesquisadores ao
demonstrar como se faz pesquisa em alto nível, como prazer de quem desempenha suas
atividades com alegria.
Aos membros das bancas de acompanhamento e qualificação, Prof. Dra. Rossana
Verónica Mendoza López e Prof. Dr. Euclides Timoteo da Rocha, pelas contribuições
fundamentais que trouxeram “a luz” em momentos difíceis.
A todos os pacientes que, em meio ao turbilhão de emoções, encontraram forças
para doar muito mais do que seu próprio sangue, mas doaram sim uma esperança de que a
ciência encontre caminhos de sanar ou, pelo menos, minimizar o sofrimento de outros que
virão. Que Deus abençoe todos eles.
À equipe da Pós-graduação do Hospital de Câncer de Barretos, pelos inúmeros e
fundamentais auxílios sempre com muita disposição, demonstrando prazer em ajudar.
Aos colaboradores do Laboratório de Análises Clínicas do Instituto do Coração da
Faculdade de Medicina da Universidade de São Paulo, especialmente a Dra. Célia Maria
Cássaro Strunz e a Adriana de Andrade Ramos Nogueira, pela realização alguns dos exames
fundamentais para o estudo.
À equipe do Núcleo de Apoio ao Pesquisador, especialmente ao Cleyton Zanardo de
Oliveira e Thaís Talarico Hosokawa, pelo auxílio no armazenamento, no processamento e na
análise dos dados.
Aos coordenadores de pesquisa Larissa de Melo Kuil, Júlio Cesar de Souza, Marielle
Borges Martins e Natalia Campacci, pela importante dedicação na condução dos trabalhos
diariamente.
À Rhafaela Lima Causin que, com sua dedicação e responsabilidade, pode ser notada
em cada parte deste estudo, pois, dia após dia, cuidou de todos os detalhes para que ele se
tornasse uma realidade.
À equipe da Medicina Nuclear, representada pelo Dr. Marcelo José Santos e o Dr.
Carlos Augusto Guimarães Menezes, pela contribuição na avaliação dos exames de
cintilografia pulmonar.
À equipe da radiologia, representada pelo Dr. Rodrigo Ribeiro Rossini, Dr. Marcos
Antônio Lopes Pinheiro, Dra. Caroline de Almeida Pereira Amaral, Dr. Samuel Fortes Arantes
da Silva, Dr. Mateus Ferreira Lacerda, Dr. Alexandre Oliveira Cecin, Dr. Maurício Wagner
Souto Ferraz, Dr. Rafael Darahem de Souza Coelho, Dr. Carlos Augusto Guimarães Menezes,
Dr. Fabiano Rubião Lucchesi, Dr. Felipe Pinto Ireno e Dra. Ana Karina Nascimento B.
Junqueira Netto, pela avaliação dos exames de doppler e de tomografia de tórax.
Aos colegas da Pós-graduação: Alini Mafra da Costa, Vanessa Regina Maciel Uzan,
Thiago Rabelo da Cunha, e muitos outros que com apoio mútuo fizeram com que as
barreiras se tornassem mais fáceis de serem vencidas.
Aos amigos Profa. Dra. Vanessa Soares de Oliveira e Almeida e Prof. Dr. Benedito
Aparecido Caiel, pela parceria, pela compreensão e pelo apoio recíproco nesses últimos sete
anos de trabalho árduo, mas que certamente renderão belos frutos.
Aos meus pais, Pedro Lúcio de Salles Fernandes e Fulvia Helena Barbour Fernandes, e
irmãos Luis Henrique Barbour Fernandes, Leandro Barbour Fernandes e Mirela Barbour
Fernandes, assim como todos os familiares, pelo o aprendizado contínuo. Sem terreno firme,
não se constrói uma fortaleza.
À D. Esmeralda Ferreira Molina, ao Sr. Walter Molina e família, pela energia e amor
incondicional que a mim desprenderam, fortalecendo não só o meu corpo, mas também a
minha alma.
Ao Sr. Edison Roberto Pupin, a Sra. Alice Maria Ribeiro dos Santos Pupin e toda a sua
família por me receberem de braços abertos.
À Nicole Maria Pupin Fernandes e João Vitor Pupin Fernandes, aos quais meu amor
transcende as barreiras deste nosso mundo!
“A persistência é o caminho do êxito”
Charles Chaplin
SUMÁRIO
1
INTRODUÇÃO
1
1.1
Conceito
2
1.2
Epidemiologia
2
1.3
Fatores de risco para eventos tromboembólicos
3
1.4
Eventos tromboembólicos e câncer
4
1.5
Fisiopatologia
4
1.6
Quadro clínico
7
1.6.1
Quadro clínico de trombose venosa profunda
7
1.6.1.1
Critérios para o diagnóstico de TVP pela ultrassonografia
10
1.6.1.2
Complicações de trombose venosa profunda
10
1.6.2
Quadro clínico de tromboembolismo pulmonar
10
1.6.2.1
O papel dos exames complementares para avaliação de TEP
11
1.6.2.2
Critérios para o diagnóstico de TEP pela tomografia
13
1.6.2.3
Critérios para o diagnóstico de TEP pela cintilografia pulmonar
13
1.6.2.4
Complicações do tromboembolismo pulmonar
13
1.7
Exames laboratoriais
14
1.7.1
Hemograma
14
1.7.2
Fibrinogênio
14
1.7.3
Fator de necrose tumoral alfa
15
1.7.4
Atividade do fator X ativado
15
1.7.5
Proteína C reativa ultrassensível
16
1.7.6
Interleucina-6
16
1.7.7
Dímero-D
17
1.7.8
P-selectina
17
2
JUSTIFICATIVA
19
3
OBJETIVOS
20
3.1
Objetivo geral (principal)
20
3.2
Objetivos específicos (secundário)
20
4
MATERIAIS E MÉTODOS
21
4.1
Desenho de estudo
21
4.2
População de estudo
21
4.3
Tamanho amostral
21
4.4
Critérios de inclusão
22
4.5
Critérios de exclusão
22
4.6
Considerações éticas
22
4.7
Métodos
23
4.7.1
Seleção dos participantes
23
4.7.2
Coleta e preservação de amostra sanguínea
23
4.7.3
Processamento e análise: INCOR-SP
24
4.7.4
Técnicas utilizadas para os exames laboratoriais
24
4.7.5
Equipamentos de imagem
25
4.8.
Análise estatística
25
5
RESULTADOS
27
6
DISCUSSÃO
57
7
CONCLUSÕES
61
8
REFERÊNCIAS BIBLIOGRÁFICAS
62
Anexo 1
Parecer consubstanciado do Comitê de Ética em Pesquisa
73
Anexo 2
Termo de consentimento livre e esclarecido (TCLE)
77
Anexo 3
Formulário de questões
81
Anexo 4
Procedimento operacional padrão do Biobanco
83
ANEXOS
Anexo 5
Formulário de requisição de material biológico e auxílio do
84
Núcleo de Apoio ao Pesquisador
Anexo 6
Frequência dos tipos de neoplasias encontradas classificados
85
pelo Código Internacional de Doenças (CID)
Anexo 7
Classificação da Eastern Cooperative Oncology Group (ECOG)
86
Anexo 8
Classificação do índice de massa corporal (IMC)
87
Anexo 9
Declaração de compromisso do pesquisador com a Fundação
88
Pio XII
Anexo 10
Declaração de co-responsabilidade do estudo com pesquisador
externo
89
LISTA DE FIGURAS
Figura 1
Esquema da cascata de coagulação proposto por Macfarlane
5
Figura 2
Cascata de coagulação baseada no conceito de iniciação, amplificação e
6
propagação
Figura 3
Representação esquemática do sistema fibrinolítico
7
Figura 4
Fluxograma de investigação diagnóstica para trombose venosa profunda
9
Figura 5
Fluxograma de orientação da Diretriz Brasileira de Embolia Pulmonar para
12
investigação diagnóstica
Figura 6
Fluxograma dos 300 participantes do estudo
27
Figura 7
Comparativo dos resultados da hemoglobina entre os grupos
38
Figura 8
Comparativo dos resultados do hematócrito entre os grupos
38
Figura 9
Comparativo dos resultados da proteína C reativa ultrassensível entre os
39
grupos
Figura 10
Comparativo dos resultados da interleucina-6 entre os grupos
39
Figura 11
Comparativo dos resultados do dímero-D entre os grupos
40
Figura 12
dos resultados da P-selectina entre o grupos
40
Figura 13
Curva ROC para a definição de eventos tromboembólicos, de acordo com a
42
taxa de hemoglobina
Figura 14
Curva ROC para a definição de eventos tromboembólicos, de acordo com o
43
valor do hematócrito
Figura 15
Curva ROC para a definição de eventos tromboembólicos, de acordo com o
43
valor das plaquetas
Figura 16
Curva ROC para a definição de eventos tromboembólicos, de acordo com o
44
valor da creatinina
Figura 17
Curva ROC para a definição de eventos tromboembólicos, de acordo com a
44
dosagem do fibrinogênio
Figura 18
Curva ROC para a definição de eventos tromboembólicos, de acordo com a
45
dosagem do fator de necrose tumoral alfa
Figura 19
Curva ROC para a definição de eventos tromboembólicos, de acordo com a
45
dosagem do fator X ativado
Figura 20
Curva ROC para a definição de eventos tromboembólicos, de acordo com a
46
dosagem da proteína C reativa ultrassensível
Figura 21
Curva ROC para a definição de eventos tromboembólicos, de acordo com a
46
dosagem da interleucina-6
Figura 22
Curva ROC para a definição de eventos tromboembólicos, de acordo com a
47
dosagem do dímero-D
Figura 23
Curva ROC para a definição de eventos tromboembólicos, de acordo com a
dosagem do P-Selectina
47
LISTA DE TABELAS
Tabela 1
Características clínicas e as pontuações para a determinação da
8
probabilidade de apresentar trombose venosa profunda, proposto por
Wells et. al
Tabela 2
Modelo clínico da probabilidade de apresentar trombose venosa
8
profunda, proposto por Wells et. al
Tabela 3
Características clínicas e as pontuações para a determinação da
10
probabilidade de apresentar embolia pulmonar, proposto por Wells et. al
Tabela 4
Modelo clínico da probabilidade de apresentar embolia pulmonar,
10
proposto por Wells et. al
Tabela 5
Cálculo do tamanho amostral
19
Tabela 6
Descritiva das características sócio-demográficas dos participantes
23
Tabela 7
Descritiva das características clínicas dos participantes
24
Tabela 8
Características clínico-oncológicas dos participantes
25
Tabela 9
Características medicamentosas e dos fenômenos tromboembólicos
26
participantes
Tabela 10
Descrição geral das variáveis clínicas e tromboembólicas dos
27
participantes
Tabela 11
Descrição geral das variáveis laboratoriais dos participantes
Tabela 12
Relação
entre
tromboembólicos
as
características
demográficas
e
27
os
eventos
28
Tabela 13
Relação entre as características clínicas e os eventos tromboembólicos
28
Tabela 14
Relação
eventos
29
Relação entre as características tromboembólicas atuais e de eventos
30
entre
as
características
oncológicas
e
os
tromboembólicos
Tabela 15
prévios
Tabela 16
Relação entre as características sócio-demográficas e clínicas com os
31
eventos tromboembólicos
Tabela 17
Relação
entre
as
características
laboratoriais
e
os
eventos
32
Achados laboratoriais do estudo comparando com os valores da
35
tromboembólicos
Tabela 18
literatura
Tabela 19
Comparação ente os exames categorizados pela Curva ROC
48
Tabela 20
Comparação entre os grupos (positivo e negativo) por meio dos valores
49
de referência da literatura para os exames laboratoriais
Tabela 21
Regressão logística simples dos eventos tromboembólicos para cada
50
exames laboratorial individualmente, ajustados por contraceptivo oral,
metástase à distância e ECO (2, 3 e 4)
Tabela 22
Valor de sensibilidade, especificidade, valor preditivo positivo, valor
preditivo negativo e acurácia dos exames, com o melhor ponto de corte
obtido pela curva ROC
51
Tabela 23
Valor de sensibilidade, especificidade, valor preditivo positivo, valor
52
preditivo negativo e acurácia dos exames, com os valores de referência
da literatura
Tabela 24
Regressão logística dos eventos tromboembólicos com as variáveis
53
metástase a distância, ECOG (2, 3 e 4) e dímero-D
Tabela 25
Regressão logística dos eventos tromboembólicos com as variáveis
54
metástase a distância, ECOG (2, 3 e 4) e P-selectina
Tabela 26
Escore preditivo 1 de ETE baseado na regressão 1 (com dímero-D)
54
Tabela 27
Escore preditivo 2 de ETE baseado na regressão 2 (com P-selectina)
55
Tabela 28
Escore preditivo 3 com classificação de risco para ETE baseado (com
55
dímero-D)
Tabela 29
Escore preditivo 4 com classificação de risco para ETE baseado (com P-
56
selectina)
Tabela 30
Medidas de predição para os 4 modelos
56
LISTA DE ABREVIATURAS
AFXa
Atividade do fator X ativado
B
Coeficiente de regressão
CEP
Comitê de Ética em Pesquisa
CID
Código Internacional de Doenças
Cr
Creatinina
Dif
Diferença relevante
df
Grau de liberdade
DM
Diabetes melitus
DP
Desvio padrão
ECOG
Cooperative Eastern Oncology Group
EP
Embolia pulmonar
ETE
Evento tromboembólico
FAPESP
Fundação de Amparo à Pesquisa do Estado de São Paulo
FBN
Fibrinogênio
FXa
Fator X ativado
HAS
Hipertensão arterial sistêmica
Hb
Hemoglobina
HCB
Hospital de Câncer de Barretos
HT
Hematócrito
IC
Intervalo de confiança
IL-1
Interleucina-1
IL-6
Interleucina-6
IMC
Índice de Massa Corporal
INCOR
Instituto do Coração
Kg
Quilograma
M
Monócitos
L
Leucócitos
LI
Limite inferior
LS
Limite superior
M
Monócitos
MABIN
Material Biológico
mg/dl
Miligramas por decilitro
N
Neutrófilos
NAP
Núcleo de Apoio ao Pesquisador
ng/dl
Nanograma por decilitro
PC
Ponto de corte
PCR
Proteína C reativa
PCR-US
Proteína C ultrassensível
Plq
Plaquetas
QT
Quimioterapia
R$
Reais
RT
Radioterapia
TCLE
Termo de consentimento livre e esclarecido
TEP
Tromboembolismo pulmonar
TNF
Fator de necrose tumoral
TNF-alfa
Fator de necrose tumoral alfa
TVP
Trombose venosa profunda
USP
Universidade de São Paulo
VPN
Valor preditivo negativo
VPP
Valor preditivo positivo
RESUMO
Fernandes, L.F.B. Perfil bioquímico e características clínicas de pacientes com suspeita de
trombose venosa profunda e tromboembolismo pulmonar, tratados no Hospital de
Câncer.Dissertação. Barretos: Hospital de Câncer de Barretos, 2015.
JUSTIFICATIVA:
Os
dados
disponíveis
sobre
a
associação
entre
evento
tromboembólico (ETE) e câncer são escassos; ampliar esse conhecimento poderá minimizar
os impactos negativos da embolia pulmonar (EP) e trombose venosa profunda (TVP),
reduzindo o número de óbitos e sequelas graves, com uma apropriada estratégia de
tratamento e seguimento.
OBJETIVOS: Avaliar as características clínicas e laboratoriais dos pacientes
oncológicos em tratamento ou acompanhamento no Hospital de Câncer de Barretos com
suspeita de ETE, diferenciando-os em dois grupos: confirmado e não confirmados. Os
exames laboratoriais de interesse foram: hemograma, creatinina, fibrinogênio, fator de
necrose tumoral alfa (TNF-alfa), atividade do fator X ativado (AFXa), proteína C reativa
ultrassensível (PCR-US), interleucina-6 (IL-6), dímero–D e P-selectina. Verificar os fatores de
predição para ocorrência de ETE e Propor um escore de predição para a ocorrência de ETE.
MATERIAIS E MÉTODOS: Foram recrutados 300 participantes com suspeita de TVP ou
EP. A cada exames solicitado para o diagnóstico de ETE agudo o Núcleo de Apoio ao
Pesquisador foi acionado. Após assinar do termo de consentimento livre e esclarecido foi
aplicado um questionário e, se houvesse indicação, a coleta de sangue era realizada. O
hemograma e a creatinina foram processados imediatamente e o restante das amostras
foram armazenadas a -80˚C e encaminhadas ao INCOR de São Paulo. Após avaliação dos
exames de imagem, foram classificados como confirmados para ETE (positivos) e não
confirmados (negativos).
RESULTADOS: Dos 297 participantes avaliados, 268 foram suspeita de TVP com 167
casos negativos e 101 casos positivos e 29 casos de TEP com 23 negativos e 6 positivos.
Houve diferença estatística entre os grupos para: gênero (p=0,028), mobilização (p=0,020),
ECOG (p=0,002), neoplasia (0,029), tempo entre a primeira consulta e o evento (p=0,008),
índice de massa corporal (p<0,001), hemoglobina (p=0,007), hematócrito (p=0,007),
interleucina-6 (p=0,032), dímero-D (p<0,001) e P-selectina (p<0,001). Pela Curva ROC,
encontramos o melhor ponte de corte para discriminar os grupos por meio dos exames:
hemoglobina >10g/dL, hematócrito >32%, plaquetas >240k/mm3, creatinina >0,80mg/dL,
Fibrinogênio >393mg/dL, TNF-alfa >12,9pg/mL, AFXa >104%, PCR-US >20,6mg/L, IL-6
>11,3pg/mL, dímero-D >633ng/mL e P-selectina >21,6ng/mL. Com base nestes resultados,
foi construído 4 escores preditivos: dois utilizaram a somatória dos valores aproximados do
odds ratio de cada modelo, o primeiro com metástases, ECO (2, 3 e 4), gênero e dímero D,
ou segundo com P-selectina no lugar do dímero-D. O terceiro e quarto modelos foram
construídos baseados nos modelos 1 e 2, respectivamente, classificando-os em baixo,
moderado, alto e muito alto risco.
CONCLUSÕES: Os participantes apresentaram média de idade de 57 anos, IMC
normal, pouca ou nenhuma restrição à locomoção; as neoplasias mais frequentes foram de
mama e de colo de útero; na maioria das vezes apresentavam metástases à distância, em
quimioterapia paliativa; e 39,78% usavam anticoagulante. Os grupos estudados mostraram
diferenças laboratoriais para hemoglobina, hematócrito, fibrinogênio, TNF-alfa, PCR-US, IL-6,
dímero-D e P-selectina. Os fatores preditores independentes para ETE foram definidos em:
modelo 1 (metástase à distância, ECOG 2, 3 e 4, gênero e dímero-D) e modelo 2 (metástase à
distância, ECOG 2, 3 e 4, gênero e P-selectina). A partir das variáveis identificadas dos 2
modelos, estabeleceram-se escores preditores, classificados pelo grau de risco. Ambos
mostram boa capacidade de predição.
PALAVRAS-CHAVE: câncer; trombose venosa; embolia pulmonar; interleucina-6;
dímero-D e P-Selectina.
ABSTRACT
Fernandes, L.F.B. Biochemical profile and clinical characteristics of patients with suspected
deep vein thrombosis and pulmonary thromboembolism treated at the Barretos Cancer
Hospital. Dissertation. Barretos: Cancer Hospital of Barretos, 2015.
BACKGROUND: The available data regarding the association between
thromboembolic events (TEE) and cancer are scarce; the enhancement of knowledge in this
area may minimize the negative impact of pulmonary embolism (PE) and deep vein
thrombosis (DVT), reducing the number of deaths and serious sequelae, once an appropriate
treatment strategy and follow-up is provided.
GOALS: To evaluate clinical and laboratory characteristics of cancer patients with
suspected TEE who are undergoing treatment or follow-up at Barretos Cancer Hospital,
separating them into two groups: confirmed and non-confirmed. Laboratory tests of interest
were: complete blood count, creatinine, fibrinogen, tumor necrosis factor-alpha (TNF-alpha),
and activated factor X activity (FXAA), ultrasensitive C - reactive protein (hsCRP), interleukin6 (IL-6), D-dimer and P-selectin. To verify the predictive factors for the occurrence of TEE and
to propose a prediction score for the occurrence of TEE.
MATERIALS AND METHODS: We recruited 300 participants with suspected DVT or
PE. To each test requested for the diagnosis of acute TEE, the Center for Researcher Support
came into play. After signing the informed consent, participants answered a questionnaire
and, in the event of having a referral, the blood was also collected. The blood count and
creatinine were processed immediately and the rest of the samples were stored at -80˚C and
forwarded to INCOR, in São Paulo. Once the images were assessed, they were classified as
confirmed for TEE (positive) and non-confirmed (negative).
RESULTS: Of the 297 participants evaluated, 268 had suspected DVT; a total of 167
negative cases and 101 positive cases, and 29 cases of PE, with 23 negatives and 6 positives.
There were statistical differences between groups: gender (p=0.028), mobilization (p=0.020),
ECOG (p=0.002), neoplasia (0.029), time elapsed between the first consultation and the
event (p=0.008), body mass index (p<0.001) and hemoglobin (p=0.007), hematocrit
(p=0.007), interleukin-6 (p=0.032), D-dimer (p<0.001) and P-selectin (p<0.001). Using the
ROC curve, we find the best cut-off point for discriminating groups by means of tests:
hemoglobin >10g/dL, hematocrit >32%, platelets >240k/mm3, creatinine >0,80mg/dL,
fibrinogen >393mg/dL, TNF-alpha >12.9pg/ml FXAA >104%, hsCRP>20.6mg/L, IL-6
>11.3pg/mL D-dimer >633ng/mL and P-selectin >21.6ng/mL. Based on these results, 4
predictive scores were built: two of them used the sum of the approximate values of the
odds ratio for each model, the first one with metastases, ECO (2, 3 and 4), gender and Ddimer, and the second with P-selectin instead of D-dimer. The third and fourth models were
built based on models 1 and 2, respectively, classifying them as low, moderate, high and very
high risk.
CONCLUSIONS: Participants had a mean age of 57 years, normal body mass index,
little or no restriction on mobility; the most common cancers were breast and cervical
cancer; most often there were distant metastases in palliative chemotherapy; and 39.78%
used anticoagulants. Studied groups showed lab differences for hemoglobin, hematocrit,
fibrinogen, TNF-alpha, hsCRP, IL-6, D-dimer and P-selectin. Independent predictors factor for
TEE were defined in: Model 1 (distant metastasis, ECOG 2, 3 and 4, gender, and D-dimer) and
model 2 (distant metastasis, ECOG 2, 3 and 4, gender and P-selectin). From variables
identified in the two models, predictor scores were established, ranked by degree of risk.
Both models displayed good prediction capacity.
KEYWORDS: cancer; venous thrombosis; pulmonary embolism; interleukin-6; Ddimer and P-Selectin.
1
1 INTRODUÇÃO
Os eventos tromboembólicos (ETE) podem ocorrer tanto no sistema circulatório
venoso quanto no arterial. Os ETE do sistema venoso compreendem a trombose venosa
superficial, trombose venosa profunda (TVP) e o tromboembolismo pulmonar (TEP) que,
apesar de provocar obstrução nas artérias pulmonares é, em geral, uma complicação da TVP,
portanto, o processo se inicia no sistema venoso. O ETE do sistema arterial é representado
pela embolia arterial, que pode se apresentar de várias formas como, por exemplo, acidente
vascular cerebral isquêmico, isquemia mesentérica, embolia arterial em membros, entre
outros. Esses êmbolos no sistema arterial são oriundos das cavidades esquerdas do coração
(átrios e ventrículos) ou originários das próprias artérias sistêmicas. Raramente, um êmbolo
venoso atinge a circulação arterial sistêmica, pois ocorre somente em casos em que existe
anomalias no sistema circulatório como, por exemplo, na comunicação atrial ou
comunicação interventricular. O presente estudo se propôs a analisar os eventos ETE
venosos, tendo como focos principais a TVP e a TEP.
Rudolf Ludwig Carl Virchow (1821-1902), um brilhante médico alemão, trouxe
enormes contribuições para a medicina com seus estudos em patologia, câncer entre outros.
Uma das suas principais contribuições foi descrever os mecanismos básicos do surgimento
da trombose e sua relação com êmbolos e embolia pulmonar. Os mecanismos descritos por
Virchow para a formação da trombose são: hipercoagulabilidade, estase sanguínea e lesão
endotelial, conhecidos como a “Tríade de Virchow”1. Já se passou mais de um século e este
assunto ainda é atual e excitante para o meio científico, não apenas interessante como tema
de estudo, mas também pela importância na prática clínica, pois a trombose é a terceira
causa de internação cardiovascular mais comum 2.
O evento tromboembólico venoso possui vários fatores de riscos como cirurgia,
trauma, neoplasia, entre outros. A doença neoplásica, de alguma forma, possivelmente, lesa
os vasos sanguíneos ao enviar as metástases. Os dos componentes da cascata de coagulação
atuam de forma a preservar da saúde do paciente, mas podem também atuar como ignição
de distúrbios hemodinâmicos. Ao que parece, ambos os fatores concorrem para fragilizar
ainda mais a saúde desses pacientes que além de desenvolver uma neoplasia, ainda
precisam cuidar das consequências de um evento tromboembólico (ETE), evento este que,
muitas vezes, torna-se uma complicação importante, podendo até tornar-se mais grave do
2
que a própria neoplasia. Guias de conduta3 ajudam a manejar de forma mais segura os
pacientes com tal patologia, porém, muito ainda precisa ser estudado, pois muitas perguntas
ainda estão sem respostas. Apesar das tentativas de padronização do tratamento 4, os
resultados nos lançam a novos desafios para que a ciência descubra novas maneiras ainda
mais eficientes para o diagnóstico precoce a fim de minimizar os efeitos de tal afecção.
1.1 Conceitos
A presença de coágulo fixo na parede do vaso sanguíneo recebe a denominação de
trombo. Se este trombo estiver na circulação venosa profunda, receberá o nome de
trombose venosa profunda (TVP). Quando parte deste trombo se solta da parede do vaso e
circula livremente pelos vasos sanguíneos, recebe o nome de êmbolo. Portanto, o
tromboembolismo pulmonar (TEP), conhecido também como embolia pulmonar (EP), nada
mais é do que um trombo venoso que sofreu fragmentação, liberando um êmbolo, o qual se
moveu pela circulação venosa até o coração (átrio direito e ventrículo direito), ganhando a
circulação pulmonar que provoca oclusão das artérias ou arteríolas pulmonares5. Sendo
assim, TVP e TEP são apresentações diferentes de um mesmo problema, os eventos
tromboembólicos (ETE).
1.2 Epidemiologia
Os distúrbios trombóticos são causas importantes de morbidade e mortalidade em
todo o mundo. Depois de síndrome coronariana e acidente vascular, os eventos
tromboembólicos são a terceira causa de internação hospitalar6, independente do
mecanismo causador. A literatura nos mostra uma incidência de trombose venosa profunda
(TVP) nos Estados Unidos de aproximadamente de 117 casos por 100.000 pessoas/ano7, com
estudos que variam entre 43 a 145 casos por 100.000 pessoas/ano e de embolia pulmonar
entre 20 a 65 casos para cada 100.000 pessoas/ano7-12, com associação entre o aumento
progressivo da incidência de eventos e aumento da idade9.
3
Os eventos tromboembólicos venosos podem ser divididos em embolia pulmonar e
trombose venosa profunda. Porém, ambos estão tão relacionados que podemos estudá-los
conjuntamente. Em 1994, Moser et al. comprovaram que, dos 37 pacientes em tratamento
para TVP sem sintomas para TEP, 16 deles (43%) apresentaram alterações na cintilografia,
sugerindo alta probabilidade de embolia pulmonar13. Em uma revisão sistemática realizada
por Meigna et al., confirmaram esta relação com achados de 40% a 50% dos pacientes em
tratamento para TVP com sinais sugestivos de embolia pulmonar. Por outro lado, em
aproximadamente 70% dos pacientes com embolia pulmonar (EP),foram encontrados sinais
sugestivos de TVP, sem apresentar sintomas2, 14.
A TVP idiopática apresenta taxas de recorrência de aproximadamente 7,8% ao ano.
Entretanto, se o paciente apresentar neoplasia ativa, a taxa de recorrência será bem maior,
de aproximadamente de 14% ao ano, podendo chegar a 30,4% de recorrência em 8 anos15-17.
Como a recorrência é variável de acordo com a etiologia, o tempo de tratamento para um
evento tromboembólico continua a ser um desafio18, principalmente, em pacientes com
câncer19-21 e, especialmente, nos pacientes em cuidados paliativos22 em que, muitas vezes,
os riscos superam os benefícios. Quando a descoberta do ETE for incidental, como em casos
de exames de rotina, a dúvida terapêutica torna-se ainda maior23, pois não está bem
estabelecido, até o momento, quando e por quanto tempo deve promover a anticoagulação.
Na população em geral, os índices de mortalidade após os 28 dias do primeiro evento de
TVP está ao redor de 9,4% e de TEP 15,1%16. Nos pacientes com TVP idiopática, a
mortalidade encontrada em 28 dias após o primeiro ETE é de aproximadamente 5,2%
enquanto que nos pacientes com causa definida de condição predisponente é de
aproximadamente 7,3%, em especial, nos pacientes com câncer, estes valores podem chegar
a 25,4%. Estudos com avaliação de mortalidade após 6 meses do episódio de
tromboembolismo mostram valores semelhantes aos encontrados, nos 28 dias iniciais do
evento, de aproximadamente 10,5% para TVP e de 14,7% para TEP15, 24.
1.3 Fatores de risco para eventos tromboembólicos
São vários os fatores de risco para o desenvolvimento de ETE, dentre os mais
importantes estão: idade avançada, obesidade, evento prévio de tromboembolismo,
4
cirurgia, trauma, anticorpo antifosfolípede, trombofilia, síndrome nefrótica, insuficiência
cardíaca, imobilização, cateter venoso central e neoplasia ativa, principalmente, se estiver
em quimioterapia25-28, porém, aproximadamente 25% a 50% dos casos são considerados
idiopáticos, pois não apresentam uma causa bem definida de etiologia para explicar o
surgimento do evento tromboembólico17, 29.
1.4 Eventos tromboembólicos e câncer
Armand Trousseau, em 1865, foi o primeiro a descrever a associação de causa e
efeito entre evento tromboembólico e câncer. Teoria à qual ele pode comprovar
pessoalmente ao desenvolver um episódio de TVP nos seus últimos meses de vida, antes de
falecer por complicações decorrentes de câncer de pâncreas30. Em aproximadamente 15%
dos casos, o eventos tromboembólicos nada mais são do que a primeira manifestação de
uma neoplasia, sendo chamadas de síndrome paraneoplásica31, principalmente, se o ETE for
recorrente32. Entretanto, alguns estudos demonstraram que não se justifica uma busca
intensa ao câncer oculto31 em todos os pacientes com ETE primário de etiologia não
conhecida, mas apenas para os casos de ETE recorrente.
Pacientes oncológicos apresentam um risco quatro vezes maior de desenvolverem
TVP do que pacientes sem câncer. Se estiver em quimioterapia (QT), este risco aumenta para
até 6 vezes17 comparado a uma pessoa sem câncer. Os tumores que mais desenvolvem
eventos tromboembólicos são: pâncreas, pulmão, estômago e adenocarcinomas com sítio
primário desconhecido33.
O paciente que desenvolver qualquer evento tromboembólico tem uma perspectiva
de vida significativamente menor quando comparado a outro paciente com a mesma
doença, porém, sem o ETE. A diminuição da sobrevida global pode ser até 8 vezes menor15,
34
. Este fato se deve não somente pelo risco do evento trombótico, mas também pelo fato
de que, provavelmente, a evolução do tumor seja mais agressiva35.
1.5 Fisiopatologia
As alterações da coagulação vão muito além dos eventos tromboembólicos, pois
5
podemos notar a participação do sistema de coagulação no crescimento e invasão tumoral,
fase de latência, angiogênese, metástase e na resposta terapêutica 36. Apesar de ser
extremamente intrigante e relevante esse tema, em nosso estudo, abordaremos apenas a
relação do câncer com os distúrbios da coagulação e, para tanto, faremos algumas
considerações sobre o conhecimento atual dos principais fatores envolvidos no processo de
coagulação.
A cascata de coagulação é extremamente complexa e, apesar de ter sido muito
estudada, ainda apresenta algumas questões sem resposta. O modelo proposto em 1964 foi
amplamente utilizado por muitas décadas e até hoje é muito útil para entender os
mecanismos básicos do funcionamento da coagulação sanguínea. Esse modelo se baseava
no conceito de que a cascata de coagulação poderia ser dividida em duas vias: a via
intrínseca, composta pelos fatores XII, XI, IX e VIII; e a via extrínseca, composta pelo Fator VII
e fator tecidual (Fator III)37, 38.
Ambas as vias convergem na ativação do fator X que, quando ativado, estimula a
conversão de protrombina (Fator II) em trombina e esta, por sua vez, converte o fibrinogênio
em fibrina. Esta reação também é responsável pela ativação plaquetária assim como a
ativação do fator VIII, que estabilizam o coágulo de fibrina deixando-o com uma consistência
gelatinosa (Figura 1)39.
Figura 1 – Esquema da cascata de coagulação proposto por Macfarlane37, 38.
6
Apesar de todos os integrantes do sistema de coagulação estarem presentes na
circulação, os coágulos (trombos) formados nas artérias e veias são algo discretamente
diferente entre si, pois os trombos arteriais são mais ricos em plaquetas, enquanto os
trombos venosos são mais ricos em células vermelhas, com maior quantidade de fibrina e
poucas plaquetas. Outra forma de estudar o sistema de coagulação, consiste em classificar
didaticamente em hemostasia primária (formação do tampão plaquetário) e hemostasia
secundária (formação da rede de fibrina). Hoje, outros conhecimentos foram incorporados
sobre a coagulação, assim, a teoria da iniciação, amplificação e propagação
40, 41
é a mais
aceita (Figura 2).
Figura 2 – Cascata de coagulação baseada no conceito de iniciação, amplificação e
propagação41.
7
A fibrinólise é o processo inverso da formação do coágulo – é a dissolução do coágulo
formado pelo mecanismo de fibrinogênese. A fibrinólise é a degradação da fibrina mediada
pela plasmina, enzima esta que é produzida a partir de uma proenzima inativa chamada de
plasminogênio, conforme a representação esquemática da Figura 339,
42
. Um desses
fragmentos da degradação é conhecido como dímero-D.
Figura 3 – Representação esquemática do sistema fibrinolítico39, 42.
São vários os contribuintes para o equilíbrio do sistema de coagulação entre as forças
de fibrinogênese e fibrinólise, sendo que muitos deles encontram-se com suas dosagens e
funções modificadas nos pacientes com câncer, como ocorre com P-selectina, dímero-D e
fibrinogênio, inclusive, com algumas relações de pior prognóstico43-48.
1.6 Quadro clínico
1.6.1 Quadro clínico de trombose venosa profunda (TVP)
A grande maioria dos episódios de TVP é proveniente dos membros inferiores, pois
apenas 1% a 2 % origina-se dos membros superiores49. Dor, edema e aumento de
8
temperatura foram os sinais e sintomas com maior sensibilidade (86%, 97% e 72%,
respectivamente), porém, a especificidade desses sinais e sintomas é baixa50, 51. Outros sinais
e sintomas comumente encontrados em pacientes com TVP são: alteração da consistência
da panturrilha (“panturrilha empastada”), hiperemia e a dorsiflexão dos membros inferiores,
provocando dor na panturrilha (sinal de Homans).
Em 1997, Wells e colaboradores formularam um escore para classificar os pacientes
com suspeita de TVP em baixa, moderada ou alta probabilidade de realmente apresentarem
tal ETE, baseando-se estritamente em critérios clínicos, assim como suas pontuações, que
estão descritas na Tabela 152.
Tabela 1 – Características clínicas e as pontuações para a determinação da probabilidade de
apresentar trombose venosa profunda, proposto por Wells et. al 51, 52.
Características clínicas
Pontuação
Câncer em atividade
1
Paresia, paralisia ou imobilização com gesso dos membros inferiores
1
Repouso no leito, recentemente, por mais de 3 dias ou grande cirurgia com
anestesia até 3 meses
1
Aumento da sensibilidade ao longo das veias profundas
1
Edema em todo o membro
1
Edema da panturrilha com diferença da circunferência medida a 10cm
abaixo da tuberosidade da tíbia maior que 3 cm em relação à perna normal
1
Edema depressível (cacifo) maior na perna afetada (unilateral)
1
Veias colaterais superficiais (não varicosas)
1
Trombose venosa profunda documentada previamente
1
Diagnóstico diferencial mais provável (celulite, tromboflebite superficial,
alterações osteoarticulares, câimbras, ruptura muscular ou tendínea,
alterações linfáticas, cisto de Baker)
-2
9
Tabela 2 – Modelo clínico da probabilidade de apresentar trombose venosa profunda,
proposto por Wells et. al51, 52.
Probabilidade
Pontuação
Chance de ter TVP (%)
Baixa
zero ou menos
3
Moderada
1a2
17
Alta
3 ou mais
75
O diagnóstico de TVP, tanto para os membros inferiores, quanto para os membros
superiores, normalmente, é realizado por meio do doppler venoso. Métodos de diagnóstico
de sensibilidade de 93%, especificidade de 86%, baixo custo e não invasivo, valor preditivo
negativo de 78% e valor preditivo positivo de 95%53, 54. Outro exame complementar muito
importante para a investigação diagnóstica de TVP é o dímero-D, conforme demonstrado na
Figura 455.
Suspeita de TVP
Baixa probabilidade
Moderada/alta probabilidade
Dímero-D
negativo
Dímero-D
positivo
Dímero-D negativo
Dímero-D positivo
Ausência
de TVP
Doppler
Doppler
Iniciar tratamento
com HBPM
Doppler
negativo
Doppler
positivo
Doppler
negativo
Doppler
positivo
Ausência
de TVP
Diagnóstico
de TVP
Ausência
de TVP
Diagnóstico
de TVP
Doppler
Doppler
negativo
Doppler
positivo
Outro exame de imagem ou repetir
o doppler após 24 a 48 horas
Diagnóstico
de TVP
Figura 4 – Fluxograma de investigação diagnóstica para trombose venosa profunda 55.
10
1.6.1.1 Critérios para o diagnóstico de TVP pela ultrassonografia
Para definição de trombose venosa profunda, foi utilizado o doppler venoso, em sua
grande maioria, com acometimento dos membros inferiores. Para melhor avaliação do
sistema venoso profundo, os membros inferiores foram divididos em 4 regiões de interesse
para o exame: região inguinal, coxa, poplítea e perna56. Para a confirmação diagnóstica, é
necessário observar visualização direta do trombo, com alteração da ecogenicidade ao
doppler e ausência de compressibilidade total da veia devido ao trombo no seu interior57.
1.6.1.2 Complicações de trombose venosa profunda
Flegmasia alba dolens: edema e palidez do membro inferior provocado por trombose
venosa ileofemural, associado ao vasoespasmo arterial 58;
Flegmasia cerulea dolens: edema e cianose do membro inferior provocado pela
trombose venosa ileofemural 58;
Síndrome pós-trombótica com anormalidades residuais e incompetência valvar
venosas, ocasionando dor, edema crônico e até a formação de úlceras do membro
acometido;
Tromboembolismo pulmonar.
1.6.2 Quadro clínico de tromboembolismo pulmonar
O paciente com TEP pode ter sua apresentação clínica de formas variadas e
inespecíficas, pois os sinais e sintomas dependem da localização, do tamanho do trombo e
da condição clínica prévia do paciente. A dispneia e a dor torácica do tipo pleurítica são os
sintomas mais comuns em 75% e 66% das vezes, respectivamente59. Hipotensão arterial
sistêmica costuma estar presente em casos de embolia pulmonar maciça60. Assim como na
TVP, foi criado um escore para classificar os pacientes com suspeita de TEP em baixa,
moderada ou alta probabilidade de realmente apresentar tal evento61 (Tabela 3).
11
Tabela 3 – Características clínicas e as pontuações para a determinação da probabilidade de
apresentar embolia pulmonar, proposto por Wells et. al61.
Características clínicas
Pontuação
Sintomas de TVP
3
O diagnóstico de TEP é mais provável do que outro diagnóstico
3
Frequência cardíaca acima de 100 batimentos/minuto
1,5
Imobilização por mais de 3 dias (exceto, idas ao banheiro) ou cirurgias nas
1,5
últimas 4 semanas
Histórico prévio de TEP ou de TVP
1,5
Hemoptise
1
Histórico de neoplasia
1
Tabela 4 – Modelo clínico da probabilidade de apresentar embolia pulmonar, proposto por
Wells et. al61.
Probabilidade
Pontuação
Chance de ter TVP (%)
Baixa
0–2
3
Moderada
3–6
27
7 ou mais
78
Alta
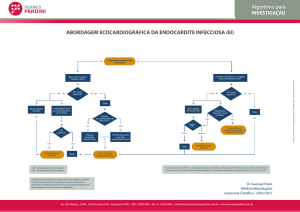
1.6.2.1 O papel dos exames complementares para a avaliação de TEP
Para o diagnóstico de TEP, além da avaliação clínica de probabilidade, são necessários
outros exames complementares, como dímero-D, gasometria arterial, creatinina,
eletrocardiograma, radiografia de tórax, eletrocardiograma, cintilografia pulmonar
ventilação/perfusão, angiotomografia tomografia e mais raramente a utilização da
angiorressonância e da arteriografia pulmonar. Dentre todos esses exames, recebem
12
destaque especial devido à relevância para o fluxograma de diagnóstico, os exames dímeroD, radiografia de tórax, angiotomografia e a cintilografia pulmonar, como pode ser
observado na Figura 5.
Apesar da radiografia de tórax ser útil no fluxograma de investigação de embolia
pulmonar, o diagnóstico é definido basicamente através de um dos dois exames:
angiotomografia de tórax e cintilografia pulmonar de ventilação/perfusão. A cintilografia de
ventilação/perfusão com alta probabilidade clínica apresenta sensibilidade de 41% e
especificidade de 97%; porém, necessitam de um padrão radiológico normal. A
angiotomografia, desde que a creatinina não seja maior que 1,5mg/dl, é uma excelente
ferramenta para a confirmação ou exclusão do diagnóstico, além do que fornece dados
anatômicos do tórax que podem auxiliar no diagnóstico, mesmo que não haja embolia
pulmonar. A angiotomografia de tórax apresenta sensibilidade entre 53% a 100%, já a
especificidade de 81% a 100%. A última Diretriz Brasileira de Embolia Pulmonar foi lançada
há 10 anos (30/07/2004) e ainda é a referência no assunto62.
Figura 5 – Fluxograma de orientação da Diretriz Brasileira de Embolia Pulmonar para investigação
diagnóstica62. AP: alta probabilidade; IP: probabilidade intermediária; BP: baixa probabilidade; ETE:
Ecocardiograma transesofágico; AGP: arteriografia pulmonar; Rx: radiografia de tórax; Cint:
cintilografia pulmonar; Cr: creatinina; DM: diabetes mellitus; RM: ressonância magnética; TC:
tomografia computadorizada.
13
1.6.2.2 Critérios para o diagnóstico de TEP pela tomografia
O tromboembolismo pulmonar agudo pode ser diagnosticado pela tomografia com
protocolo para TEP (angiotomografia de tórax) por meio da visualização direta do trombo ou
sinais indiretos de embolia. A visualização do trombo pela tomografia pode ser por oclusão
total ou parcial da artéria pulmonar ou seus ramos. O defeito perfusional total, geralmente,
encontra-se com formato côncavo, já a oclusão parcial, pode ser evidenciada por defeito
perfusional central ou excêntrico. Os sinais indiretos de embolia pulmonar pela tomografia
são: oligoemia no território suspeito, infarto pulmonar, sinais indiretos de hipertensão
pulmonar e diminuição do calibre do vaso63, 64.
1.6.2.3 Critérios para o diagnóstico de TEP pela cintilografia pulmonar
Para a avaliação de tromboembolismo pulmonar agudo pela cintilografia pulmonar,
foram utilizados os critérios do PIOPED modificado65-67. Foram considerados como casos
positivos para TEP, aqueles que apresentaram resultados com alta probabilidade e
probabilidade intermediária. Foram considerados casos negativos aqueles exames com
resultados normais ou com baixa probabilidade para TEP.
1.6.2.4 Complicações do tromboembolismo pulmonar
Insuficiência respiratória aguda, com possibilidade de óbito;
Hipertensão pulmonar, proveniente de obstrução residual das artérias e/ou
arteríolas pulmonares;
Arritmias cardíacas.
14
1.7 Exames laboratoriais
1.7.1 Hemograma
As plaquetas são as células anucleadas, de menor dimensão entre as células
sanguíneas circulantes e apresentam como principal função a manutenção da homeostase 68.
Normalmente, os valores de plaquetas são de 150k/mm3 até 350k/mm3. Pacientes
oncológicos com elevadas concentrações de plaquetas demonstram pior prognóstico69 e
maior relação com trombose70. As plaquetas apresentam um papel muito importante no
processo de metástase, que pode ser caracterizada por quatro ações: estabilização das
células metastáticas no vaso, estímulo à proliferação celular do tumor, promoção do
extravasamento de células tumorais e melhora na interação das células tumorais com a
matriz celular71. Estudos com inibição plaquetária em animais evidenciaram efeito
antimetastático72 e até efeito antineoplásico, como ocorreu com o ácido acetil salicílico 73.
1.7.2 Fibrinogênio
A hipercoagulabilidade está intimamente relacionada ao processo inflamatório, que é
influenciado pelo fibrinogênio (FBN)74. Também conhecido como fator I, o fibrinogênio é
produzido pelos hepatócitos e desempenha um papel fundamental na coagulação
sanguínea. Ao ser estimulado pela trombina ativada (fator IIa), ocorre a conversão do
fibrinogênio em fibrina formando o coágulo. Níveis elevados de fibrinogênio estão
associados aos eventos tromboembólicos, independente de outros fatores de risco. O valor
sérico do fibrinogênio parece estar relacionado a tumores mais avançados e com
características mais agressivas75, especialmente, nos pacientes com câncer de pâncreas76. O
fibrinogênio sérico também pode ser útil como preditor de mortalidade global em pacientes
pré-operatórios para câncer urotelial do trato superior77.
15
1.7.3 Fator de necrose tumoral alfa (TNF-alfa)
O TNF-alfa é uma citocina multifuncional pertencente à família do fator de necrose
tumoral (TNF), secretada principalmente pelos macrófagos com funções autócrina, parácrina
e endócrina78-80, e está envolvida em uma grande quantidade de processos biológicos,
incluindo resistência à insulina e metabolismo lipídico80,
81
, proliferação celular,
diferenciação, apoptose, coagulação, com atuação importante em doenças autoimunes, e
câncer. Durante um processo inflamatório da coagulação intravascular disseminada, o TNFalfa é a primeira enzima a se elevar, responsável pela ativação e elevação dos níveis de IL-6,
posteriormente82. A princípio, foi identificada pela capacidade de induzir à necrose
hemorrágica dos tumores 83.
1.7.4 Atividade do fator X ativado (AFXa)
Carcinogênese, angiogênese e hipercoagulabilidade são processos intimamente
envolvidos nas doenças neoplásicas84. O potencial metastático das células cancerígenas
depende, em parte, da ativação da cascata de coagulação, sendo que a mesma possui um
papel importante no processo de metástase e, consequentemente, na formação do
trombo85. O fator de coagulação depende da vitamina K86, o Fator X ativado (FXa) participa
ativamente da cascata de coagulação com a função de converter a protrombina em
trombina na presença do fator V ativado, cálcio efosfolípedes 41. Por apresentar um papel
central no processo de coagulação86, muitos esforços tem sido desprendidos com a
finalidade de entender e controlar o fator X, principalmente em pacientes que necessitam
diminuir a atuação do sistema de coagulação, ou para o tratamento de evento
tromboembólico que já ocorreu, ou ainda na prevenção deste. Por isso, muitos
medicamentos para anticoagulação foram desenvolvidos com a intenção de diminuir a
atuação do fator X ativado, como heparina de baixo peso molecular (HBPM)87,
88
,
rivaroxabana89, 90 e apixabana91, diminuem sua função e, consequentemente, diminuem a
conversão de protrombina em trombina e fibrinogênio em fibrina. Como alguns pacientes
oncológicos apresentam elevação dos valores basais da atividade do fator X ativado 92, é
possível encontrarmos uma relação entre este exame laboratorial e metástases.
16
1.7.5 Proteína C reativa (PCR-US)
A proteína C reativa (PCR) é uma proteína de fase aguda, descrita como biomarcador
não específico do fator de inflamação e de risco para doença cardiovascular 93. É sintetizada
pelo fígado após uma agressão tecidual como processo inflamatório, infeccioso ou, até
mesmo, após evento coronariano. A PCR também pode ser produzida nas lesões
ateroscleróticas por células musculares lisas e macrófagos, rins e outros tecidos94, 95. Nos
pacientes com câncer, os níveis basais de proteína C ultrassensível (PCR-US) podem estar
aumentando. Elevados níveis de PCR estão comprovadamente associados ao pior
prognóstico nos pacientes com câncer, mas não parece ser útil como preditor de eventos
tromboembólicos, entretanto, pode ser útil no diagnóstico desse evento48.
1.7.6 Interleucina-6 (IL-6)
A interleucina-6 é uma citocina pró-inflamatória que é normalmente encontrada em
níveis séricos baixos96, porém, em algumas situações especiais, como durante a infecção,
trauma ou outras formas de estresse, seus níveis podem estar elevados, apresentando um
papel importante no processo inflamatório tecidual97. Ela pode ser secretada por várias
células como linfócitos (T e B), macrófagos, monócitos, fibroblastos e algumas linhagens de
células neoplásicas. Apresenta um papel fundamental na indução de produção de proteínas
de fase aguda, como fibrinogênio e proteína C reativa98. Elevados níveis séricos de IL-6 estão
associados com elevados níveis séricos de PCR, provavelmente, pelo fato de que a IL-6
estimula a produção de PCR80. Pessoas saudáveis com levados níveis de IL-6 apresentam
maior risco de evento coronariano, podendo permanecer elevados até por 6 meses após o
evento, além de apresentarem pior prognóstico99, 100. A IL-6 atua de forma importante no
processo de coagulação101, tornando-se um dos exames de nosso interesse nesse estudo.
Nos pacientes com coagulação intravascular disseminada, são encontradas inicialmente
elevações do TNF-alfa, que por si só já estimula a produção de IL-6, sendo que esta provoca
aumento da produção de trombina (fator II)82, fator importantíssimo para a formação do
coágulo, pois, como já antecipado, catalisa a conversão de fibrinogênio em fibrina.
17
Alguns indícios levam a crer que a IL-6 apresenta relação com a caquexia
neoplásica102, 103, além de participar do processo de resistência ao tratamento de câncer de
mama por meio da diminuição dos receptores de estrogênio104.
1.7.7 Dímero-D
A fibrinólise é a degradação da fibrina mediada pela plasmina. O dímero-D é um
produto dessa degradação da fibrina que se apresenta como um dos principais exames na
investigação de TEP62. Possui sensibilidade próxima a 97%, especificidade de 42% quando
realizado pelo método de enzyme-linked immunosorbent assay(ELISA); no entanto, o
método mais realizado é o de látex, com sensibilidade de 70% e especificidade de 76%, com
alto valor preditivo negativo62, 105, que o coloca como importante ferramenta para afastar o
diagnóstico de TEP. Contudo, em algumas situações como cirurgia, infarto agudo do
miocárdio98 e septicemia, pode-se alterar o valor basal do exame, assim como em pacientes
com câncer106; sendo assim, é preciso conhecer essas interferências para não criar um malentendido do raciocínio clínico diante deste importante exame. Muitos pacientes com
câncer apresentam maior atividade do sistema fibrinogênese/fibrinólise, como pode ser
evidenciado pelos níveis elevados de dímero-D mesmo sem diagnóstico de evento
tromboembólico. Entretanto, o fato do dímero-D apresentar elevação sérica nos pacientes
com câncer não inutiliza o exame, necessariamente, pois talvez seja necessário redefinir o
valor de referência para pacientes com câncer e sem ETE. Sabe-se que pacientes com câncer
associados a elevados níveis séricos de dímero-D apresentam pior prognóstico46.
1.7.8 P-selectina
A P-selectina é uma glicoproteína presente no endotélio e nas plaquetas 107, 108, que
induzidas pelo fator de necrose tumoral (TNF) e pela interleucina-1 (IL-1) ligam-se aos
leucócitos, principalmente aos neutrófilos109 com a função de facilitar a interação (adesão)
18
dos leucócitos com o endotélio ou com as plaquetas110. A P-selectina também atua na
formação de trombos e de processos inflamatórios111.
Existe uma relação bem definida entre elevados níveis séricos de P-selectina e
trombose112. Elevados níveis de P-selectina auxiliam na identificação do paciente com risco
mais elevado de apresentar eventos tromboembólicos, mostrando uma razão de risco de 2,6
para pacientes com P-selectina sérica acima de 53,1 ng/dL, mesmo ajustado para idade,
sexo, cirurgia, quimioterapia e radioterapia; no entanto, análises de subgrupo demonstram
que pacientes oncológicos apresentam valores alterados mesmo sem apresentar ETE44-46. É
possível que o valor de cut-off para pacientes com câncer seja diferente da população geral,
além de participar ativamente do processo de metástase hematogênica113.
Sendo assim, algumas substâncias já foram testadas experimentalmente, e com
sucesso, em ratos na tentativa de diminuir a ação da P-selectina hipotetizando um provável
potencial terapêutico para inibir inflamação, tromboses e metástases111; os ratos que
apresentavam deficiência de P-selectina e que receberam células de câncer colorretal de
humanos, apresentaram menor crescimento tumoral, além de menor incidência de
metástases pulmonares114.
19
2 JUSTIFICATIVA
Os dados disponíveis sobre o perfil bioquímico e as características clínicas dos
pacientes com suspeita de trombose venosa profunda e tromboembolismo pulmonar, na
vigência de câncer, são poucos em todo o mundo, apesar da importância e relevância do
tema. No Brasil, não há estudos robustos e bem organizados que possam servir de referência
para o devido tratamento do assunto. Assim, esse trabalho buscou ampliar esse
conhecimento de forma sistemática para promover o diagnóstico precoce, e consequentemente
minimizar os impactos negativos da TEP e TVP no paciente oncológico, reduzindo o número
de óbitos e sequelas graves, com uma estratégia apropriada de prevenção, tratamento e
seguimento clínico.
20
3 OBJETVOS
3.1 Objetivo Geral (principal)
Caracterizar os pacientes oncológicos em tratamento ou em acompanhamento no
Hospital de Câncer de Barretos com suspeita de eventos tromboembólicos.
3.2 Objetivos específicos (secundário)
Caracterizar clinicamente os pacientes que desenvolveram ETE;
Comparar
as
diferenças
laboratoriais
(hemograma,
plaquetas,
creatinina,
fibrinogênio, TNF-alfa, dímero-D, PCR-US, P-selectina, atividade do fator X ativado, IL6) entre os pacientes com suspeita de ETE, separando-os em dois grupos –
“confirmados” e “não confirmados” para ETE;
Verificar os fatores de predição para ocorrência de ETE;
Propor um escore de predição para a ocorrência de ETE.
21
4 MATERIAIS E MÉTODOS
4.1 Desenho do estudo
Trata-se de um estudo transversal com coleta prospectiva.
4.2 População de estudo
Pacientes oncológicos em tratamento ou em acompanhamento no Hospital de
Câncer de Barretos (HCB) com suspeita de eventos tromboembólicos (ETE), durante o
período de 12/09/2013 até 16/10/2014.
4.3 Tamanho amostral
O tamanho amostral foi calculado levando-se em conta um estudo48 que avaliou 178
pessoas suspeitas de TVP, sendo que em 62 casos, houve confirmação do evento. Ao se
comparar os valores séricos de P-selectina dos grupos com e sem o evento, observou-se uma
diferença significativa entre eles. O grupo com TVP apresentou o valor médio da P-selectina
sérica de 87,3ng/dl com desvio padrão de 44ng/dl, já no grupo sem TVP, o valor foi de
53,4ng/dl com desvio padrão de 24ng/dl. Ao consideramos uma significância de 5% com
poder de teste de 90% e uma relevância clínica de 15 pontos entre os grupos, chegamos a
um valor de 98 casos (eventos de TVP), como apresentados na Tabela 1. Com base em
estimativas observacionais do Serviço de Emergência do Hospital de Câncer de Barretos,
durante o ano de 2012, para recrutar os 100 participantes com ETE confirmado, seria
necessário aproximadamente 6 meses, com uma proporção esperada de 3 participantes
suspeitos de evento tromboembólico para cada caso confirmado. Portanto, esperávamos
encontrar aproximadamente 300 suspeitos de TVP e TEP, com aproximadamente 100 casos
confirmados.
22
Tabela 5 – Cálculo do tamanho amostral.
Significância de 0,05 (alfa = 5%)
Dif = 5
Dif = 10
Dif = 15
Dif = 20
Dif = 25
Dif = 30
Dif = 35
Poder = 0,9
880
220
98
55
35
24
18
Poder = 0,8
662
165
74
41
26
18
14
Dif= diferença relevante.
4.4 Critérios de inclusão
Pacientes em tratamento ou seguimento no Hospital de Câncer de Barretos com
doença neoplásica confirmada;
Suspeita de TVP ou TEP no período de 11 de novembro de 2013 a 30 de junho de
2014;
Idade igual ou superior a 18 anos;
Pacientes que apresentaram indicação de exames de imagem para a confirmação ou
exclusão do diagnóstico.
4.5 Critérios de exclusão
ETE assintomático.
4.6 Considerações éticas
Este estudo foi autorizado pelo Comitê de Ética em Pesquisa do Hospital de Câncer
de Barretos sob o número 742/2013 (Anexo 1);
Todos os participantes, ou seus responsáveis legais, assinaram o termo de
responsabilidade (TCLE) (Anexo 2);
Este estudo, assim como seus realizadores, não apresentam conflito de interesse.
23
4.7 Métodos
Todos os casos incluídos no estudo diziam respeito a pacientes atendidos no Hospital
de Câncer de Barretos, durante os anos de 2013 e 2014.
4.7.1 Seleção dos participantes
Ao surgir a hipótese diagnóstica de TVP ou TEP levantada por um médico assistente
do Hospital de Câncer de Barretos, independente de qual setor (ambulatório, enfermaria ou
emergência), ao chegar o pedido na Medicina Nuclear ou na Radiologia, a enfermeira
responsável tinha a incumbência de acionar o Núcleo de Apoio ao Pesquisador (NAP), que
designava um coordenador de pesquisa para identificar o(a) paciente, para fazer o convite
de participação do estudo e aplicar o TCLE (Anexo 2). Após assinar o TCLE, era aplicado o
questionário. Todos os pacientes respondiam ao questionário (Anexo3), mas nem todos
tinham indicação de coleta de sangue.
4.7.2 Coleta e preservação de amostra sanguínea:
Os participantes com indicação, foram submetidos à coleta de sangue venoso
periférico. Porém, para os participantes que tiveram o diagnóstico de TVP ou TEP
previamente, há menos de 60 dias, ou para aqueles que fizeram uso de contraceptivo oral
há 7 dias, ou heparina não fracionada e heparina de baixo peso molecular há menos de 48h,
foram colhidos exames de sangue apenas para realização de hemograma e creatinina. O
hemograma e a creatinina foram encaminhados ao laboratório central do Hospital de Câncer
de Barretos para o processamento imediato, segundo o procedimento operacional padrão
em anexo. Os outros exames laboratoriais (fibrinogênio, TNF-alfa, atividade do fator X
ativado, PCR-US, IL-6, dímero-D, P-selectina) foram encaminhados ao Biobanco da Fundação
Pio XII para o armazenamento a -80°C, de acordo com o procedimento operacional descrito
no Anexo 4.
24
4.7.3 Processamento e análises: INCOR-SP
As amostras foram enviadas ao Laboratório de Análises Clínicas do Instituto do
Coração da Faculdade de Medicina da Universidade de São Paulo (INCOR-SP). O transporte
foi realizado através de caixa térmica contendo quantidades abundantes de gelo seco,
sempre com intervalo inferior a 24 horas entre a retirada do freezer do Biobanco e a entrega
no INCOR. As amostras foram processadas no laboratório do INCOR-SP sob a
responsabilidade de Dra. Célia Maria Cassaro Strunz.
4.7.4 Técnicas utilizadas pra os exames laboratoriais
O fibrinogênio plasmático foi determinado por dosagem pelo método de Clauss em
equipamento
automatizado
(TcoagDestinyMaxTM,
Ireland)
e
kit
específico
(TcoagTriniCLOT). Valores esperados: 175mg/dL até 400mg/dL115;
O Fator de Necrose Tumoral (TNF-alfa) foi determinado pela dosagem quantitativa em
ensaio imunométrico sequencial de fase sólida, quimioluminescente, em equipamento
automatizado IMMULITE 1000, marca Siemens Medical Solutions Diagnostics, Los
Angeles, USA. Valores esperados: até 8,1 pg/mL;
O
teste
AFXa
foi
realizado
por
método
cromogênico
em
equipamento
TcoagDestinyMaxTMTrinity Biotech, Ireland e kit específico (TcoagTriniCLOT). O TCLE e o
questionário foram aplicados pelos coordenadores de pesquisa designados pelo NAP;
Valor esperado < 100%.
A PCR-US foi quantificada por meio de anticorpos monoclonais, pelo método de
imunonefelometria em equipamento automatizado BN II Systems, utilizando o kit
CardioPhasehsCRP (Siemens Healthcare Diagnostics Products, Marburg, Alemanha). O
intervalo de referência é de < 1,0 mg/L para avaliação de risco de doença vascular e <
5,0mg/L para avaliação de processos inflamatório-infecciosos;
A Inteleucina-6 (IL-6) foi determinada pela dosagem quantitativa, em ensaio
imunométrico sequencial de fase sólida, quimioluminescente, em equipamento
automatizado IMMULITE 1000, marca Siemens Medical Solutions Diagnostics, Los
Angeles, USA. Valores esperados: até 5,9pg/mL;
25
O dímero-D é determinado por Imunoturbidimetria, por meio de um ensaio de
aglutinação de micropartículas de poliestireno com produtos da degradação da fibrina
contendo o dímero-D, determinados quantitativamente em plasma humano citratado. O
equipamento utilizado foi um Coagulômetro, marca TCoag, modelo Destiny Max. O valor
de referência Foi considerado o valor de 500ng/mL;
A P-Selectina foi determinada pela dosagem quantitativa, em imunoensaio enzimático
ELISA (enzyme-linked immunosorbent assay), utilizando o kit da marca IBL IMMUNOBIOLOGICAL LABORATORIES. Valores esperados: soro: de 67ng/mL a 233ng/mL; plasma
(EDTA): de 50ng/mL a 233ng/mL; plasma (citrato): de 92ng/mL a 212ng/mL; plasma
(heparina): de 60 a 188ng/mL. Como nosso protocolo foi realizado com plasma,
aceitamos como limite de normalidade o valor de 233ng/mL.
4.7.5 Equipamentos de imagem
O aparelho de ultrassonografia utilizado foi o Logiq/GE com transdutor S8/GE. As
tomografias computadorizadas foram adquiridas em dois tomógrafos, descritos a seguir:
LightSpeed VCT/GE com 64 canais e BrightSpeed/GE com 16 canais). O equipamento
utilizado na Medicina Nuclear foi gama câmara, de dois detectores, GE/USA.
4.8 Análise Estatística
As variáveis quantitativas foram analisadas em suas médias (desvio padrão), quando
houve a recomendação ou por meio de mediana (diferença interquartílica) como alternativa.
Já as variáveis qualitativas, por meio de suas frequências relativas, tanto nos casos de
estimação, quanto de comparação ou de associação. As médias foram comparadas por
“teste t” (dois grupos), se aplicáveis. As medianas foram comparadas pelo teste não
paramétrico de Mann-Whitney. Associações por meio de frequências foram estudadas por
“teste qui-quadrado de Pearson”, ou “exato de Fisher” quando houve recomendação para
essa alternativa. Posteriormente, as variáveis foram analisadas conjuntamente por meio da
Regressão Logística Múltipla. Para verificar a assertividade dos exames de P-Selectina e
dímero-D, primeiramente, foi utilizada a Curva ROC para identificar o melhor ponto de corte
26
relacionado ao evento. Assim, seria possível analisar a acurácia (sensibilidade,
especificidade, valor preditivo positivo e negativo) de cada escore e, posteriormente,
compará-los utilizando o teste de McNemar.
O nível de significância adotado para os testes de hipóteses é α = 0,05, enquanto o
intervalo de confiança foi de 0,95. As análises foram realizadas utilizando o Software SPSS
versão 21.
27
5 RESULTADOS
Foram recrutados 300 participantes, entretanto, 3(1%) destes, foram excluídos por se
tratarem de achados incidentais em exames de rotina. Portanto, foram analisados 297
participantes, sendo 268(90,24%) com suspeita de TVP e 29 participantes com suspeita de
TEP (9,76%). Dentre os 268 suspeitos de TVP, 167 (62,31%) foram negativos, ou seja, o
exame de imagem não conseguiu confirmar o diagnóstico, enquanto que em 101 (37,69%)
casos foram positivos, isto é, o exame de imagem confirmou a suspeita, neste caso,
confirmando a suspeita diagnóstica de TVP. Entre os 29 participantes com suspeita de TEP,
houve 23 (79,31%) casos negativos e 6 (20,69%) casos positivos (Figura 6).
300
Total
3
excluídos
29
268
(9,76%)
(90,24%)
Suspeita de TEP
Suspeita de TVP
167
101
(62,31%)
(37,69%)
TVP negativo
TVP positivo
23
6
(79,31%)
(20,69%)
TEP negativo
TEP positivo
Figura6 – Fluxograma dos 300 participantes do estudo.
Entre os 297 participantes analisados, 177 (59,6%) eram do sexo feminino, 169
(65,25%) possuíam, no máximo, ensino fundamental completo, 54 (20,85%) ensino médio
incompleto ou completo e apenas 36 (13,9%) apresentavam curso superior, completo ou
incompleto (Tabela 6).
28
Tabela6–Descritiva das características sócio-demográficas dos participantes.
Variável
Categoria
Frequência
%
Feminino
177
59,6
Masculino
120
40,4
Analfabeto / sabe ler e escrever /
Fundamental Incompleto e Completo
169
65,25
Ensino Médio Incompleto e Completo
54
20,85
Ensino Superior Incompleto e Completo
36
13,9
Gênero
Nível educacional
Apenas 117 (39,39%) participantes apresentaram hipertensão arterial sistêmica, 43
(4,53%) diabetes mellitus, 150 (50,51%) varizes, 150 (50,51%) nunca haviam feito uso de
tabaco,122 (41,08%) não tinham restrição à locomoção, desse modo se apresentava a
classificação de Eastern Cooperative Oncology Group116 (ECOG) 1118 (39,73%) e 129
(43,73%) dos participantes apresentavam o índice de massa corporal (IMC) dentro dos
padrões da normalidade (Tabela 7). Com relação ao IMC, o valor foi calculado levando em
consideração o peso, em quilogramas, dividido pelo quadrado da altura, em metros, de
acordo com a Diretriz Brasileira de Obesidade de 2011, no anexo Anexo 8117,
118
. Para
avaliação da capacidade de auto-cuidado do participante, foi utilizado a classificação da
ECOG que encontra-se no Anexo 7.
Tabela 7 – Descritiva das características clínicas dos participantes.
Variável
Hipertensão arterial
sistêmica
Categoria
Não
Sim
Frequência
180
117
%
60,61
39,39
Diabetes mellitus
Não
Sim
253
43
85,47
14,53
Varizes
Não
Sim
147
150
49,49
50,51
Tabagismo
Nunca fez uso
Há mais de 6 meses não fuma
Faz uso atualmente
150
50,51
110
37,04
37
12,46
(continua na próxima página...)
29
Tabela 7(continuação) – Descritiva das características clínicas dos participantes.
Variável
Mobilização
ECOG
Categoria
Frequência
%
Sem restrição à locomoção
122
41,08
Caminha sem ajuda, mas com dificuldade
Caminha apenas com ajuda de outras pessoas
Não consegue caminhar, mas senta fora da cama
Restrito à cama
93
43
17
22
31,31
14,48
5,72
7,41
0
1
2
3
4
46
118
50
47
36
15,49
39,73
16,84
15,82
12,12
23
129
76
41
17
9
7,80
43,73
25,76
13,90
5,76
3,05
Baixo peso
Normal
Sobrepeso
Índice de massa
corporal
Obesidade I
Obesidade II
Obesidade III
ECOG: Eastern Cooperative Oncology Group
Entre osparticipantes,49 (16,5%) tinham o diagnóstico de neoplasia de mama, 34
(11,45%) neoplasia de colo de útero, 20 (6,73%) neoplasia de pulmão, 17 (5,72%) neoplasia
de reto, 16 (5,39%) neoplasia de próstata e 161 (54,21%) participantes com o diagnóstico de
outras neoplasias; 294 (98,99%) apresentavam doença neoplásica em atividade, 156
(52,53%) metástase à distância, 133 (44,78%) estavam em tratamento com quimioterapia,
96 (32,32%) já haviam terminado a quimioterapia; 128 (64%) dos tratamentos
quimioterápicos foram de caráter paliativo e 53 (79,1%) dos que já haviam realizado a
quimioterapia, terminaram o procedimento após completar todo o tratamento proposto,
sem interrupção precoce, 186 (62,63%) ainda não haviam realizado tratamento
radioterápico; dos que realizaram, 66 (61,11%) tinham indicação de radioterapia paliativa,
81 (91,01%) dos que já haviam realizado a radioterapia, terminaram o procedimento após
completar todo o tratamento proposto e 198 (66,67%) entre todos os participantes já
haviam sido submetidos ao tratamento cirúrgico proposto para o tratamento da neoplasia
(Tabela 8). O Anexo 6 apresenta uma relação das doenças oncológicas (neoplasias) em
tratamento, baseado no código internacional de doenças (CID-10).
30
Tabela 8 – Características clínico-oncológicas dos participantes.
Variável
Categoria
Mama
Colo de útero
Pulmão
Reto
Próstata
Outros
Frequência
49
34
20
17
16
161
%
16,50
11,45
6,73
5,72
5,39
54,21
Doença em atividade
Não
Sim
3
294
Metástase à distância
Não
Sim
141
156
1,01
98,99
1,01
47,47
52,53
Não havia feito até o momento
Estava em andamento
Já havia encerrado
96
133
68
32,32
44,78
22,90
Intenção da quimioterapia
Paliativa
Terapêutica
128
72
64,00
36,00
Motivo da interrupção da
quimioterapia
Término da programação
Término precoce
53
14
79,10
20,90
Não havia feito até o momento
Estava em andamento
Já havia encerrado
186
19
92
62,63
6,40
30,98
Paliativa
Terapêutica
Término da programação
Término precoce
66
42
81
8
61,11
38,89
91,01
8,99
Não
Sim
99
198
33,33
66,67
Neoplasia
Quimioterapia
Radioterapia
Intenção da radioterapia
Motivo da interrupção da
radioterapia
Tratamento cirúrgico
Duzentos e sessenta e oito participantes (89,9%) apresentaram suspeita de trombose
venosa profunda, sendo que apenas 101 (37,67%) foram confirmados e 29 (10,1%)
apresentaram suspeita de tromboembolismo pulmonar e destes, apenas 6 (20,69%) foram
confirmados. O exame mais utilizado foi o doppler venoso em 267 (89,9%) das vezes; houve
internação hospitalar em apenas 51 (17,17%) dos participantes, 45 (15,31%) já tinham
episódios prévios de eventos tromboembólicos e, destes, 31 (77,5%) apenas um episódio
prévio. Somente 26 (8,81%) dos participantes estavam em tratamento para TVP e 12 (4,08%)
em tratamento para TEP, 25 (9,65%) em uso de contraceptivo oral, 66 (25,48%) em uso de
31
anticoagulante injetável, 22 (8,53%) em uso de antiagregante plaquetário e 19 (7,36%) em
uso de hormônio ou antagonistas hormonais para o tratamento oncológico (Tabela 9).
Tabela 9 – Características medicamentosas e dos fenômenos tromboembólicos dos
participantes.
Variável
Categoria
TVP
TEP
Frequência
267
29
%
89,9
10,1
Trombose venosa profunda
Negativo
Positivo
167
101
62,31
37,67
Tromboembolismo pulmonar
Negativo
Positivo
23
6
79,31
20,69
A suspeita foi confirmada por
Tomografia
Cintilografia
Doppler
Arteriografia
28
1
267
1
9,43
0,34
89,9
0,34
Houve internação devido ao evento
tromboembólico
Não
Sim
246
51
82,83
17,17
Já teve evento tromboembólico
anteriormente
Não
Sim
249
45
84,69
15,31
1
2
3
4
31
6
2
1
77,5
15
5
2,5
Estava em tratamento para trombose
venosa profunda
Não
Sim
268
26
91,19
8,81
Estava em tratamento para
tromboembolismo pulmonar
Não
Sim
282
12
95,92
4,08
Contraceptivo oral
Não
Sim
234
25
90,35
9,65
Anticoagulante injetável
Não
Sim
193
66
74,52
25,48
Antiagregante plaquetário
Não
Sim
236
22
91,47
8,53
Não
Sim
239
19
92,64
7,36
Hipótese diagnóstica
Se já teve ETE, quantas vezes
Hormônio ou antagonistas hormonais para
o tratamento oncológico
ETE: Evento Tromboembólico
32
No momento da suspeita do evento tromboembólico, a média da idade era de 56,58
anos; do momento entre a primeira consulta e o evento tromboembólico, foram 26,43
meses; entre a primeira quimioterapia e o ETE, foram 13,5 meses; sendo que a média do
IMC foi 26,02 (Tabela 10).
Tabela 10 – Descrição geral das variáveis clínicas e tromboembólicas dos participantes.
n
Média
Desvio
padrão
mínimo
Idade
297
56,58
14,67
19,39
1º
quartil
46,74
Tempo, em meses, entre
a 1ª consulta e o ETE
297
26,43
47,34
0,00
Tempo, em meses, entre
a quimioterapia e o ETE
200
13,37
23,61
Índice de Massa Corporal 295
ETE: Evento Tromboembólico
26,02
6,12
Variável
57,82
3º
quartil
67,38
2,83
7,80
26,23
364,34
0,00
2,70
6,38
13,21
239,97
13,74
21,72
24,91
29,40
47,75
mediana
máximo
86,08
A média da hemoglobina (Hb) foi de 10,79g/dl, do hematócrito (Ht) 32,78%, das
plaquetas (Plq) 245,62k/mm3, da creatinina (Cr) 1,08mg/dL, do fibrinogênio (FBN)
427,14mg/dL, do fator de necrose tumoral alfa (TNF-alfa) 16,76pg/mL, da atividade do fator
X ativado (AFXa) 105,43%, da proteína C reativa ultrassensível (PCR-US) foi de 52,62mg/L, da
Interleucina-6 (IL-6) foi de 22,86pg/mL, do dímero-D de 2.181,22ng/mL e da P-selectina foi
de 25,37ng/mL, conforme a Tabela 11.
Tabela 11 – Descrição geral das variáveis laboratoriais dos participantes.
N
média
Hemoglobina (g/dL)
170
10,79
Desvio
padrão
2,04
4,00
1º
quartil
9,00
11,00
3º
quartil
12,00
Hematócrito (%)
170
32,78
5,68
11,00
28,75
34,00
47,00
44,00
Plaquetas (k/mm3)
170
245,62
252,00
1,00
153,00
228,00
280,75
3026,00
Creatinina (mg/dL)
159
1,08
1,22
0,20
0,70
0,80
1,02
10,00
FBN (mg/dL)
146
427,14
145,48
45,00
331,00
413,00
514,75
830,00
TNF-alfa (pg/mL)
136
16,76
16,23
4,00
9,43
11,90
17,00
109,00
AFXa (%)
146
105,43
28,76
18,00
85,50
103,00
128,00
179,00
PCR-US (mg/L)
138
52,62
66,86
0,29
6,36
20,20
82,43
334,00
IL-6 (pg/mL)
120
22,86
41,75
2,00
4,28
8,85
23,45
298,00
Dimero D (ng/mL)
136
2.181,22
4429,92
46,00
166,25
576,50
1.693,75
2.3796,00
mínimo
mediana
máximo
16,00
P-selectina (ng/mL)
117
25,37
16,52
3,00
16,50
20,80
27,90
120,70
FBN: Fibrinogênio, TNF-alfa: Fator de Necrose Tumoral alfa; AFXa: Atividade do Fator X Ativado; PRC-US:
proteína C Reativa; IL-6: Interleucina 6.
33
Entre os casos considerados positivos para evento tromboembólico, 56 (51,37%) dos
participantes eram do sexo feminino versus 121 do grupo negativo (p=0,028); 63 (67,74%)
possuíam, no máximo, o ensino fundamental completo versus 106 (63,86%); ensino médio
completo ou incompleto 21 versus 33 e apenas 9 (9,67%) versus 27 (16,27%) tinham curso
superior, completo ou incompleto(p=0,332)(Tabela 12).
Tabela 12 – Relação entre as características demográficas com os eventos tromboembólicos.
Variável
Gênero
Categórica
Negativo
n
%
n
%
Feminino
56
51,37
121
64,36
Masculino
53
48,62
67
35,64
63
67,74
106
63,86
Ensino Médio Incompleto e Completo
21
22,58
33
19,88
Ensino Superior Incompleto e Completo
9
9,67
27
16,27
Analfabeto / sabe ler e escrever /
Nível educacional
Positivo
Fundamental Incompleto e Completo
p
0,028
0,332
Na avaliação das características cínicas, comparando os grupos dentre os 107 casos
considerados positivos para o evento tromboembólico e os 190 casos considerados
negativos, tinham: hipertensão arterial 41 (37,61%) versus 76 (40,43%) (p=0,633); diabetes
15 (13,89%) vs 28 (14,89%) (p=0,813); nunca fizeram uso de tabaco, 59 (54,13%) vs 91
(48,4%) (p=0,234); faziam uso atualmente 9 (8,26%) vs 28 (14,89%); não tinha restrição à
locomoção ou caminhava com dificuldade, mas sem ajuda, 71 (65,14%) vs 147 (76,59%);
caminhava apenas com a ajuda de outras pessoas, não caminhava ou era restrita à cama 38
(34,68%) vs 44 (23,41%) (p=0,020); apresentavam ECOG 138 (34,86%) vs 80 (42,55%)
(p=0,002); e, por fim, IMC normal 56 (52,34%) vs 73 (38,83%) (p=0,045) respectivamente
(Tabela 13).
34
Tabela 13 – Relação entre as características clínicas com os eventos tromboembólicos.
62,39
37,61
Negativo
n
%
112
59,57
76
40,43
93
15
86,11
13,89
160
28
85,11
14,89
0,813
Tabagismo
Nunca fez uso
Há mais de 6 meses
Faz uso atualmente
59
41
9
54,13
37,61
8,26
91
69
28
48,40
36,70
14,89
0,234
36
33,03
86
45,74
35
32,11
58
30,85
Mobilização
Não tem restrição à locomoção
Caminha sem ajuda, mas com
dificuldade
Caminha apenas com ajuda de outras
pessoas
Não consegue caminhar, mas senta
fora da cama
Restrito à cama
15
13,76
28
14,89
9
8,26
8
4,26
14
12,84
8
4,26
0
1
2
3
4
10
38
23
16
22
9,17
34,86
21,10
14,68
20,18
36
80
27
31
14
19,15
42,55
14,36
16,49
7,45
0,002
Baixo peso
11
10,28
Normal
56
52,34
Sobrepeso
25
23,36
IMC
Obesidade I
11
10,28
Obesidade II
2
1,87
Obesidade III
2
1,87
ECOG: Eastern Cooperative Oncology Group; IMC: Índice de Massa Corporal
12
73
51
30
15
7
6,38
38,83
27,13
15,96
7,98
3,72
0,045
Variável
Categórica
Hipertensão arterial
Não
Sim
n
68
41
Diabetes
Não
Sim
ECOG
Positivo
%
p
0,633
0,020
Estavam em tratamento de câncer de mama 9,17% dos participantes positivos versus
20,74% dos casos negativos; colo de útero 8,26% vs 13,30%; pulmão 5,5% vs 7,45%; reto
6,42% vs 5,32%; próstata 8,26% vs 3,72%; e outros 62,39% vs 49,47% (p=0,029); doença em
atividade 100% vs 98,40%; metástase à distância 55,05% vs 51,06; estava em tratamento
quimioterápico 43,12% vs 45,74%; por quimioterapia paliativa, 68,57% vs 61,54%; não
realizaram radioterapia 65,14% vs 31,17%; e, quando o fizeram, era por indicação paliativa,
62,16% vs 60,56%; e, por fim, foram submetidos ao tratamento cirúrgico para o tratamento
oncológico em 66,06% vs 67,02%, respectivamente (Tabela 14).
35
Tabela 14 – Relação entre as características oncológicas e os eventos tromboembólicos.
Variável
Categórica
Positivo
Negativo
p
n
%
n
%
Mama
Colo de útero
Pulmão
Reto
Próstata
Outros
10
9
6
7
9
68
9,17
8,26
5,50
6,42
8,26
62,39
39
25
14
10
7
93
20,74
13,30
7,45
5,32
3,72
49,47
0,029
Doença em atividade
Não
Sim
0
109
0,00
100,00
3
185
1,60
98,40
0,301
Metástase à distância
Não
Sim
49
60
44,95
55,05
92
96
48,94
51,06
0,508
Quimioterapia
Não havia feito até o momento
Estava em andamento
Já havia encerrado
39
47
23
35,78
43,12
21,10
57
86
45
30,32
45,74
23,94
0,611
Intenção da QT
Paliativa
Terapêutica
48
22
68,57
31,43
80
50
61,54
38,46
0,323
Não havia feito até o momento
Estava em andamento
Já havia encerrado
71
6
32
65,14
5,50
29,36
115
13
60
61,17
6,91
31,91
0,766
Paliativa
Terapêutica
23
14
62,16
37,84
43
28
60,56
39,44
0,872
Não
Sim
37
72
33,94
66,06
62
126
32,98
67,02
0,865
Neoplasia
Radioterapia
Intenção da RT
Tratamento cirúrgico
QT: Quimioterapia; RT: Radioterapia.
Foram suspeitos de TVP, 101 (94,39%) dos casos positivos vs 167 (87,90%) dos casos
negativos; suspeitos de TEP,6 (5,61%) vs 23 (12,10) (p=0,414); necessitou de internação,41
(37,61%) vs 10 (5,32%) (p<0,001); tinha apresentado ETE previamente, 15 (16,48%) vs 23
13,94% (p=0,584); estava em tratamento para TVP; 13 (12,03%) vs 14 (7,49%) (p=0,192);
estava em tratamento para TEP,6 (5,56%) vs 6 (3,23%) (p=0,330); em uso de contraceptivo
oral,12 (12,9%) vs 13 7,83% (p=0,185); em uso de anticoagulante injetável,25 (26,88%) vs 41
24,7% (p=0,699); em uso de antiagregante plaquetário,7 (7,61%) vs 15 (9,04%) (p=0,694); em
uso de hormônio ou antagonistas hormonais para o tratamento oncológico,6 (6,45%) vs 13
(7,88%) (p=0,673), respectivamente (Tabela 15).
36
Tabela 15 – Relação entre as características tromboembólicas atuais e de eventos prévios.
Suspeita clínica: TVP ou TEP
TVP
TEP
Positivo
n
%
101
94,39
6
5,61
ETE previamente
Não
Sim
76
15
83,52
16,48
142
23
86,06
13,94
0,584
Estava em tratamento para TVP
Não
Sim
95
13
87,96
12,04
173
14
92,51
7,49
0,192
Estava em tratamento para TEP
Não
Sim
102
6
94,44
5,56
180
6
96,77
3,23
0,330
Em uso de contraceptivo oral
Não
Sim
81
12
87,10
12,90
153
13
92,17
7,83
0,185
Em uso de anticoagulante injetável
Não
Sim
68
25
73,12
26,88
125
41
75,30
24,70
0,699
Em uso de antiagregante plaquetário
Não
Sim
85
7
92,39
7,61
151
15
90,96
9,04
0,694
Não
87
Em uso de hormônio ou antagonistas
hormonais para o tratamento oncológico
Sim
6
TVP: Trombose Venosa Profunda; TE: Tromboembolismo Pulmonar.
93,55
6,45
152
13
92,12
7,88
0,673
Variável
Categórica
Negativo
n
%
167
87,90
23
12,10
p
0,414
A média da renda familiar era de R$ 2.441,17no grupo positivo para ETE vs R$
1.999,10 para o grupo negativo (p=0240); a média do peso era de 67,27Kg vs 70,94Kg
(p=0,082); altura de 1,66m vs 1,62m (p=0,002); anos de exposição ao tabaco, era de 26,18
anos vs 25,72 anos (p=0,955); idade ao diagnóstico de suspeita de evento tromboembólico
era de 57,1 anos vs 56,28 anos (p=0,641); tempo entre a primeira consulta no hospital de
câncer e o diagnóstico de suspeita de ETE de 20,05 meses vs 30,12 meses (p=0,008); tempo
entre a quimioterapia e a suspeita do evento tromboembólico era de 12,23 meses vs 13,98
meses (p=0,109); por fim, o índice de massa corporal médio foi de 24,44 vs 26,92 (p<0,001),
conforme a Tabela 16.
37
Tabela 16 – Relação entre as características sócio-demográficas e clínicas com os eventos
tromboembólicos.
Positivo
Variável
Negativo
p
n
Média
DP
n
Média
DP
Renda familiar (R$)
102
2441,07
4.037,17
183
1.999,10
1821,61
0,240
Peso em quilos
109
67,27
16,53
188
70,94
18,04
0,082
Altura em metros
107
1,66
0,10
188
1,62
0,09
0,002
Anos de exposição ao tabaco
50
26,18
15,20
94
25,72
15,41
0,955
Idade ao diagnóstico
109
57,10
15,02
Tempo (meses) - 1ª consulta e ETE
109
20,06
34,78
Tempo (meses) QT/ETE
70
12,23
19,78
Índice de massa corporal
107
24,44
5,45
DP: desvio padrão; ETE: evento tromboembólico; QT: quimioterapia.
188
188
130
188
56,28
30,12
13,98
26,92
14,50
53,02
25,49
6,30
0,641
0,008
0,109
<0,001
O valor médio encontrado de hemoglobina (Hb) foi de 10,29g/dL no grupo positivo
para ETE versus 11,05g/dL no grupo negativo (p=0,007; Figura 7); a média do hematócrito
(Ht) foi de 31,38% vs 33,51% (p=0,007; Figura 8); das plaquetas (Plq) foram 220,14K/mm3 vs
258,83K/mm3; da creatinina (Cr) foi de 1,19mg/dL vs 1,01mg/dL; fibrinogênio 411,46mg/dL
vs 435,81mg/dL; fator de necrose tumoral alfa (TNF-alfa) foi de 14,76pg/mg vs 17,85pg/mg;
atividade do fator X ativado (AFXa) 102,94% vs 106,81%; proteína C reativa ultrassensível
(PCR-US) foi de 68,42mg/L vs 43,92mg/L (p=0,056; Figura 9); da interleucina-6 foi
24,83pg/mL vs 21,72pg/mL; com desvio padrão de 27,02 vs 48,4 (p=0,032; Figura 10). A
média do dímero-D foi 4.615,38ng/mL vs 977,52ng/mL, com desvio padrão de 6.460,54
versus 2.145,50 (p<0,001; Figura 11), já a P-selectina apresentou média de 33,60ng/mL vs
20,40ng/mL, com desvio padrão de 23,35 vs 6,92 (p<0,001; Figura 12), conforme a Tabela
17.
Tabela 17 – Relação entre as características laboratoriais e os eventos tromboembólicos.
Variável
Hemoglobina (g/dL)
Hematócrito (%)
Plaquetas (k/mm3)
Creatinina (mg/dL)
Fibrinogênio (mg/dL)
Fator de necrose tumoral alfa (pg/mL)
Atividade do fator X ativado (%)
Proteína C reativa ultrassensível (mg/L)
Interleucina-6 (pg/mL)
Dimero-D (ng/mL)
P-selectina (ng/mL)
DP: desvio padrão.
n
58
58
58
59
52
48
52
49
44
45
44
Positivo
Média
10,29
31,38
220,14
1,19
411,46
14,76
102,94
68,42
24,83
4.615,38
33,60
DP
n
1,92
5,22
97,61
1,40
149,96
6,48
25,72
73,39
27,02
6.460,54
23,35
112
112
112
100
94
88
94
89
76
91
73
Negativo
Média
11,05
33,51
258,83
1,01
435,81
17,85
106,81
43,92
21,72
977,52
20,40
DP
2,07
5,80
302,99
1,12
143,01
19,57
30,35
61,70
48,40
2.145,50
6,92
p
0,007
0,007
0,645
0,136
0,240
0,215
0,439
0,056
0,032
<0,001
<0,001
38
Figura 7 – Comparativo dos resultados da hemoglobina entre os grupos.
Figura 8 – Comparativo dos resultados do hematócrito entre os grupos.
39
Figura 9 – Comparativo dos resultados da proteína C reativa ultrassensível entre os grupos.
Figura 10 – Comparativo dos resultados da interleucina-6 entre os grupos.
40
Figura 11 – Comparativo dos resultados do dímero-D entre os grupos.
Figura 12 – Comparativo dos resultados da P-selectina entre o grupos.
41
Foi construída a Curva ROC para cada um dos exames laboratoriais. Por meio dos
dados da Curva ROC, foi calculado o melhor ponto de corte para discriminar a ocorrência ou
não dos eventos tromboembólicos, demonstrados na Tabela 18. Foi calculada a área em
relação à curva de hemoglobina 0,63 (p=0,003; Figura 13), hematócrito 0,63 (p=0,05; Figura
14), plaquetas 0,52 (p=639; Figura 15) e creatinina 0,8 (p=0130; Figura16). Para os outros
exames, foi calculada a área em relação à curva, considerando dois pontos de corte, um
deles foi o melhor ponto de corte obtido nos exames laboratoriais deste estudo que, em
seguida, foi comparado com os valores conhecidos na literatura (Tabela 18).
Tabela 18 – Achados laboratoriais do estudo comparado com os valores da literatura.
Variável
PC
Hemoglobina*
10mg/dL
Hematócrito*
32%
3
Área
DP
0,63
IC 95%
p
0,05
LI
0,55
LS
0,70
0,003
0,63
0,05
0,55
0,70
0,005
Plaquetas*
243k/mm
0,52
0,05
0,44
0,59
0,639
Creatinina*
>0,8
0,57
0,05
0,49
0,65
0,130
Fibrinogênio
393mg/dL
400mg/dL
0,55
0,43
0,05
0,04
0,47
0,33
0,64
0,53
0,243
0,184
Fator de necrose tumoral alfa
12,9pg/dL
8,1pg/dL
0,56
0,56
0,05
0,05
0,48
0,46
0,65
0,65
0,200
0,242
Atividade do fator X ativado
104%
100%:
0,55
0,46
0,05
0,50
0,46
0,37
0,63
0,56
0,345
0,513
Proteína C reativa ultrassensível
20,6mg/L
5,0mg/dL
0,60
0,54
0,05
0,0,5
0,51
0,45
0,68
0,64
0,006
0,350
Interleucina-6
11,3pg/mL
5,9pg/mL
0,62
0,57
0,06
0,05
0,53
0,47
0,71
0,67
0,025
0,149
Dímero-D
633ng/mL
500ng/mL
0,75
0,68
0,05
0,04
0,67
0,59
0,20
0,77
<0,001
<0,001
P-Selectina
21,6ng/mL
0,72
0,05
0,63
0,80
< 0,001
233ng/dL
0,50
0,50
0,402
0,598
1
PC: ponto de corte; DP: desvio padrão; OR: odds ratio; IC: intervalo de confiança; LI: limite inferior; LS: limite
superior. *Não há valores de referência da literatura que relacione estes exames aos eventos
tromboembólicos.
Foram encontrados os seguintes valores: fibrinogênio 0,55 (p=0,243; Figura 17) pelo
melhor ponto de corte deste estudo versus 0,434 (p=0,184) pela literatura; fator de necrose
tumoral alfa 0,56 (p=0,200; Figura 18) vs 0,56 (p=242); atividade do fator X ativado 0,55
(p=345; Figura 19); proteína C reativa ultrassensível 0,6 (p=0,006; Figura 20) vs 0,54
42
(p=0,350); interleucina-6 0,62 (p=0,025; Figura 21) vs 0,57 (p=149); dímero-D 0,75 (p<0,001;
Figura 22) vs 0,68 (p<0,001), respectivamente. A área em relação à curva da P-selectina foi
de 0,72 (p<0,001; Figura 11), porém, todos os resultados encontrados foram inferiores ao
resultado considerado ponto de corte para a literatura (Tabela 18).
Ht (%)
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 13 – Curva ROC para a definição de eventos tromboembólicos, de acordo com a taxa
de hemoglobina.
43
Creatinina mg/dL
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 14 – Curva ROC para a definição de eventos tromboembólicos, de acordo com o valor
do hematócrito.
Plq k/mm3
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 15 – Curva ROC para a definição de eventos tromboembólicos, de acordo com o valor
das plaquetas.
44
Creatinina mg/dL
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 16 – Curva ROC para a definição de eventos tromboembólicos, de acordo com o valor
da creatinina.
Fibrinog
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 17 – Curva ROC para a definição de eventos tromboembólicos, de acordo com a
dosagem do fibrinogênio.
45
TNF-alfa pg/mL
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 18 – Curva ROC para a definição de eventos tromboembólicos, de acordo com a
dosagem do fator de necrose tumoral alfa.
AFXa
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 19 – Curva ROC para a definição de eventos tromboembólicos, de acordo com a
dosagem do fator X ativado.
46
PCR-US mg/L
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 20 – Curva ROC para a definição de eventos tromboembólicos, de acordo com a
dosagem da proteína C reativa ultrassensível.
IL-6
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 21 – Curva ROC para a definição de eventos tromboembólicos, de acordo com a
dosagem da interleucina-6.
47
Dimero-D
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 22 – Curva ROC para a definição de eventos tromboembólicos, de acordo com a
dosagem do dímero-D.
P - Selectina
100
Sensibilidade
80
60
40
20
0
0
20
40
60
80
100
100-Especificidade
Figura 23 – Curva ROC para a definição de eventos tromboembólicos, de acordo com a
dosagem do P-Selectina.
48
Por meio da curva ROC, foi encontrado o melhor ponto de corte para cada exame,
em seguida, foi realizada a comparação entre os dois grupos: positivos e negativos para ETE.
O melhor ponto de corte encontrado para a hemoglobina foi 10g/dL, estando acima deste
valor 23 participantes (39,66%) dos positivos e 71 (63,39%) dos negativos (p=0,003);
hematócrito >32%, com 20 (34,48%) versus 74 (66,07%) (p<0,001); plaquetas >240k/mm3, 20
(34,48%) vs 38 (65,52%) (p=0,166); creatinina >0,8mg/dL, 32 (54,24%) vs 40 (39,60%)
(p=0,081); fibrinogênio >393mg/dL, 23 (44,23%) vs 58 (61,7%) (p=0,042); fator de necrose
tumoral alfa >12,9pg/mL, 25 (51,02%) vs 29 (32,58%) (p=0,034); atividade do fator X ativado
>104%, 20 (38,46%) vs 51 (54,26%) (p=0,067); proteína C reativa ultrassensível >20,6mg/L,
31 (60,78%) vs 36 (40,00%) (p=0,018); interleucina-6 >11,3pg/mL, 28 (58,33%) vs 25 (28,09%)
(p=0,001); dímero-D >633ng/mL, 39 (76,47%) vs 33 (35,11%) (p<0,001); por fim, P-selectina
>21,6ng/mL, 28 participantes (63,6%) vs 23 (31,51%) (p< 0,001) (Tabela 19).
Tabela 19 – Comparação entre os exames categorizados pela curva ROC.
Ponto de corte
Positivo
Negativo
p
n
%
n
%
<10g/dL
35
60,34
41
36,61
Hemoglobina
0,003
>10g/dL
23
39,66
71
63,39
<32%
38
65,52
38
33,93
Hematócrito
<0,001
>32%
20
34,48
74
66,07
3
<240k/mm
38
65,52
61
54,46
Plaquetas
0,166
3
>240k/mm
20
34,48
51
45,54
<0,80mg/dL
27
45,76
60
60,40
Creatinina
0,081
>0,80mg/dL
32
54,24
40
39,60
<393mg/dL
29
55,77
36
38,30
Fibrinogênio
0,042
>393mg/dL
23
44,23
58
61,70
<12,9pg/mL
24
48,98
60
67,42
TNF-alfa
0,034
>12,9pg/mL
25
51,02
29
32,58
<104%
32
61,54
43
45,74
AFXa
0,067
>104%
20
38,46
51
54,26
<20,6mg/L
20
39,22
54
60,00
PCR-US
0,018
>20,6mg/L
31
60,78
36
40,00
<11,3pg/mL
20
41,67
64
71,91
Interleucina-6
0,001
>11,3pg/mL
28
58,33
25
28,09
<633ng/mL
12
23,53
61
64,89
Dímero-D
<0,001
>633ng/mL
39
76,47
33
35,11
<21,6ng/mL
16
36,36
50
68,49
P-selectina
0,001
>21,6ng/mL
28
63,63
23
31,51
TNF-alfa: fator de necrose tumoral alfa; AFXa: atividade do fator X ativado; PCR-US: proteína C reativa.
49
Em seguida, foi realizada nova comparação entre os grupos, positivo e negativo para
ETE, porém, houve como o ponto de corte, os valores de referência encontrados na
literatura: fibrinogênio >400mg/dL, 24 (45,3%) vs 55 (58,5%) (p=0,122); fator de necrose
tumoral alfa >8,1pg/mL, 45 (91,8%) vs 71 (79,8%) (p=0,604); atividade do fator X ativado
>100%, 27 (50,9%) vs 54 (57,4%) (p=0,447); proteína C reativa ultrassensível >5,0mg/L, 42
(84,0%) vs 67 (74,4%) (p=0,192); interleucina-6 >5,9pg/mL, 42 (80,8%) vs 41 (43,6%)
(p=0,091); dímero-D >500ng/mL, 32 (66,7%) vs 46 (51,7%) (p<0,001); por fim, P-selectina
>212ng/mL, não houve participante com valor igual ou superior ao da literatura (Tabela 20).
Tabela 20 – Comparação entre grupos (positivo e negativo) por meio dos valores de
referência da literatura para os exames laboratoriais.
Fibrinogênio
<400mg/dL
>400mg/dL
Positivo
n
%
29
54,7%
24
45,3%
Fator de necrose tumoral alfa
<8,1pg/mL
>8,1pg/mL
4
45
8,2%
91,8%
18
71
20,2%
79,8%
0,604
<100%
>100%
26
27
49,1%
50,9%
40
54
42,6%
57,4%
0,447
Proteína C reativa ultrassensível
<5,0mg/L
>5,0mg/L
8
42
16,0%
84,0%
23
67
25,6%
74,4%
0,192
Interleucina-6
<5,9pg/mL
>5,9pg/mL
10
42
19,2%
80,8%
53
41
56,4%
43,6%
0,091
Dímero-D
<500ng/mL
>500ng/mL
16
32
33,3%
66,7%
43
46
48,3%
51,7%
<0,001
P-selectina
<212ng/mL
>212ng/mL
52
0
100,0%
0,0%
93
0
100,0%
0,0%
1
Ponto de corte
Atividade do fator X ativado
Negativo
n
%
39
41,5%
55
58,5%
p
0,122
Foi realizada a regressão logística para determinar o odds ratio de cada exame
laboratorial separadamente, ajustados pelas variáveis uso de contraceptivo oral, ECOG e
metástase a distância; tendo como referência os valores encontrados como melhor ponto de
corte via Curva ROC. O odds ratio da hemoglobina foi 0,480 (p=0,152), hematócrito 0,368
(p=0,55), plaquetas 0,347 (p=0,061), creatinina 1,108 (p=0,852), fibrinogênio 0,579
50
(p=0,313), fator de necrose tumoral alfa 0,889 (p=0,834), atividade do fator X ativado 1,129
(p=0,828), proteína C reativa ultrassensível 1,200 (p=0,742), Interleucina-6 2,478 (p=0,105),
dímero-D 4,346 (p=0,017) e P-selectina 3,813 (p=0,029) (Tabela 21).
Tabela 21 – Regressão logística dos eventos tromboembólicos para cada exames
laboratoriais individualmente, ajustado por contraceptivo oral, ECOG e metástase à
distância.
0,480
IC 95%
LI
LS
0,176
1,310
0,152
1
0,368
0,133
1,020
0,055
3,506
1
0,347
0,115
1,051
0,061
0,548
0,035
1
1,108
0,379
3,242
0,852
-0,546
0,542
1,017
1
0,579
0,200
1,675
0,313
TNF-alfa >12,9pg/mL
-,118
0,562
0,044
1
0,889
0,295
2,675
0,834
AFXa >100%
0,121
0,557
0,047
1
1,129
0,379
3,363
0,828
PCR-US
0,182
0,554
0,108
1
1,200
0,405
3,550
0,742
IL-6>11,3pg/mL
0,907
0,559
2,631
1
2,478
0,828
7,417
0,105
Dímero-D>633ng/mL
1,469
0,615
5,705
1
4,346
1,302
14,514
0,017
P-selectina >21,6mg/dL
1,338
0,612
4,779
1
3,813
1,148
12,659
0,029
B
DP
Wald
df
OR
-0,734
0,512
2,051
1
-1,000
0,520
3,694
Plaquetas >240k/mm
-1,058
0,565
Creatinina >0,80mg/dL
0,102
FBN >393mg/dL
Hb >10g/dL
Ht >32%
3
p
B: coeficiente de regressão; DP: desvio padrão; df: grau de liberdade; OR: odds ratio; IC: intervalo de confiança;
LI: limite inferior; LS: limite superior; Hb: hemoglobina; Ht: hematócrito; FBN: fibrinogênio; TNF-alfa: fator de
necrose tumoral alfa; AFXa: atividade do fator X ativado; PCR-US: proteína C reativa ultrassensível;IL6:interleucina-6.
A Tabela 22 apresenta os valores de sensibilidade, especificidade, valor preditivo
positivo, valor preditivo negativo e acurácia para todos os exames laboratoriais, tendo com a
referência o melhor ponto de corte obtido pela Curva ROC.
Foi calculado, também, sensibilidade, especificidade, valor preditivo positivo, valor
preditivo negativo e acurácia para todos os exames laboratoriais, tendo com a referência os
valores encontrados na literatura; todavia, não foi possível calcular essas informações para
P-selectina, pois todos os resultados laboratoriais da amostra estavam abaixo dos dados de
literatura (Tabela 23).
51
Tabela 22 – Valor de sensibilidade, especificidade, valor preditivo positivo, valor preditivo negativo e acurácia dos exames, com o melhor ponto
de corte obtido pela curva ROC.
Exame
Sensibilidade (%)
Especificidade (%)
VPP (%)
VPN (%)
Acurácia (%)
Valor
IC 95%
Valor
IC de 95%
valor
IC de 95%
valor
IC 95%
Valor
IC de 95%
Hb (10g/dL)
60.34
46.64 a 72.95
63.39
53.76 a 72.29
46.05
34.55 a 57.87
75.53
65.58 a 83.81
62,35
54,87 a 69,29
Ht (32%)
65.52
51.88 a 77.50
66.07
56.52 a 74.75
50.00
38.30 a 61.70
78.72
69.07 a 86.49
65,88
58,47 a 72,59
Plaquetas (240 k/mm3)
65,52
51.88 a 77,50
45.45
36,10 a 55,22
38.38
28, 78 a 48,70
71,83
59,90 a 81,86
47,65
40,27 a 55,12
Fibrinogênio (393mg/dL)
55.77
41.33 a 69.53
61.70
51.10 a 71.54
44.62
32.27 a 57.47
71.60
60.50 a 81.07
59,59
51,48 a 67,20
TNF-alfa (12,9pg/mL)
51.02
36.34 a 65.57
67.42
56.66 a 76.97
46.30
32.63 a 60.39
71.43
60.53 a 80.76
61,59
53,27 a 69,29
AFXa (104%)
61.54
47.02 a 74.69
54.26
43.66 a 64.58
42.67
31.31 a 54.62
71.83
59.90 a 81.86
56,85
48,74 a 64,61
PCR-US (20,6mg/L)
60.78
46.11 a 74.15
60.00
49.13 a 70.19
46.27
34.00 a 58.88
72.97
61.39 a 82.64
60,28
52,04 a 67,98
IL-6 (11,3pg/mL)
58.33
43.21 a 72.38
71.91
61.38 a 80.92
52.83
38.64 a 66.69
76.19
65.65 a 84.81
67,15
58,91 a 74,46
Dímero-D (633ng/mL)
76.47
62.50 a 87.20
64.89
54.36 a 74.46
54.17
42.01 a 65.97
83.56
73.04 a 91.20
68,97
61,03 a 75,92
P-selectina (21,6ng/mL)
63.64
47.77 a 77.58
68.49
56.56 a 78.87
54.90
40.34 a 68.87
75.76
63.64 a 85.46
66,67
57,72 a 74,56
IC: intervalo de confiança; VPP: valor preditivo positivo; VPN: valor preditivo negativo; Hb: hemoglobina; Ht: hematócrito; TNF-alfa: fator de necrose tumoral alfa; AFXa:
atividade do fator X ativado; PCR-US: proteína C reativa ultrassensível; IL-6: interleucina-6.
52
Tabela 23 – Valor de sensibilidade, especificidade, valor preditivo positivo, valor preditivo negativo e acurácia dos exames, com os valores de
referência de literatura.
Sensibilidade (%)
valor
IC 95%
Especificidade (%)
Valor
IC de 95%
valor
Fibrinogênio (400mg/dL)
54.72
40.45 a 68.43
58.51
47.88 a 68.58
42.65
30.73 a 55.23
69.62
58.25 a 79.47
57,14
49,06
64,86
TNF-alfa (8,1pg/mL)
91.84
80.38 a 97.68
20.22
12.45 a 30.07
38.79
29.89 a 48.29
81.82
59.70 a 94.70
45,65
37,57
53,97
AFXa (100%)
49.06
35.07 a 63.16
57.45
46.82 a 67.59
39.39
27.58 a 52.19
66.67
55.32 a 76.75
54,42
46,36
62,26
PCR-US (5,0mg/L)
84.00
70.88 a 92.81
25.56
16.94 a 35.84
38.53
29.37 a 48.34
74.19
55.38 a 88.11
46,43
38,37
54,67
IL-6 (5,9pg/mL)
66.67
51.59 a 79.59
48.31
37.59 a 59.16
41.03
30.01 a 52.75
72.88
59.73 a 83.63
54,74
46,39
62,33
Dímero-D (500ng/mL)
80.77
67.46 a 90.36
56.38
45.76 a 66.59
50.60
39.40 a 61.76
84.13
72.73 a 92.10
65,07
57,04
72,33
Exame
VPP (%)
IC de 95%
Valor
VPN (%)
IC de 95%
Valor
Acurácia (%)
IC de 95%
IC: intervalo de confiança; VPP: valor preditivo positivo; VPN: valor preditivo negativo; TNF-alfa: fator de necrose tumoral alfa; AFXa: atividade do fator X ativado; PCR-US:
proteína C reativa ultrassensível; IL-6: interleucina-6.
53
A fim de identificar a relação conjunta entre as variáveis que poderiam estar
influenciando a ocorrência de ETE, foi utilizada a regressão logística múltipla ajustada por
metástase à distância e ECOG (2,3 e 4). Para isso, selecionamos todas as variáveis com valor
de p menor do que 0,2: mobilização, necessidade de internação, altura, tempo entre a
primeira consulta e o evento, IMC, hematócrito, hemoglobina, fibrinogênio, TNF-alfa, PRCUS, interleucina-6, dímero-D, P-selectina. As últimas variáveis a permanecerem foram:
gênero, dímero-D e P-selectina. No entanto, os dois últimos, não apresentavam significância
estatística quando colocados no mesmo modelo. Sendo assim, duas outras regressões
logísticas múltiplas foram construídas. A primeira (regressão 1), teve como variáveis:
metástase à distância, ECOG (2,3 e 4), gênero e dímero-D. Para este modelo de regressão,
foram obtidos os seguintes resultados de odds ratio: metástase à distância de 1,338
(p=0,479), ECOG (2,3 e 4) 3,039 (p=0,009), gênero 2,557(p=0,023) e dímero-D 5,072
(p<0,001) (Tabela 24).
Tabela 24 – Regressão logística dos eventos tromboembólicos com as variáveis: metástase à
distância, ECOG (2,3 e 4), gênero e dímero-D (regressão 1).
B
DP
Wald
df
p
OR
Metástase à distância
0,291
0,411
0,501
1
0,479
ECOG (2,3 e 4)
1,112
0,424
6,882
1
Gênero
0,939
0,412
5,198
Dimero-D
1,624
0,426
Constante
-2,438
0,460
IC 95%
LI
LS
1,338
0,597
2,996
0,009
3,039
1,325
6,973
1
0,023
2,557
1,141
5,730
14,519
1
<0,001
5,072
2,200
11,694
28,115
1
<0,001
0,087
B: coeficiente de regressão; DP: desvio padrão; df: grau de liberdade; OR: odds ratio; IC: intervalo de confiança;
LI: limite inferior; LS: limite superior; ECOG: Eastern Cooperative Oncology Group.
A segunda regressão logística (regressão 2) teve como variáveis: metástase à
distância, ECOG (2,3 e 4), gênero e P-selectina. Esta, apresentou odds ratio para metástase à
distância de 2,488 (p=0,040), ECOG (2,3 e 4) 4,150 (p=0,003), gênero 2,709 (p=0,029) e Pselectina 3,385 (p=0,007) (Tabela 25; p<0,001).
54
Tabela 25 – Regressão logística dos eventos tromboembólicos com as variáveis: metástase à
distância, ECOG (2,3 e 4), gênero e P-selectina (regressão 2).
B
DP
Wald
df
p
OR
Metástases à distância
0,911
0,444
4,207
1
0,040
ECOG (2,3 e 4)
1,423
0,479
8,825
1
Gênero
0,997
0,457
4,758
P-selectina
1,219
0,452
Constante
-2,440
0,514
IC 95%
LI
LS
2,488
1,041
5,943
0,003
4,150
1,623
10,613
1
0,029
2,709
1,106
6,635
7,280
1
0,007
3,385
1,396
8,208
22,573
1
0,000
0,087
B: coeficiente de regressão; DP: desvio padrão; df: grau de liberdade; OR: odds ratio; LI: limite inferior; LS:
limite superior; ECOG: Eastern Cooperative Oncology Group.
A partir dos dados acima, foram elaborados 4 modelos de escore de predição,
variando de 0 a 1, dos quais 1 indica presença de ETE e 0 ausência de evento.
O escore preditor 1 foi construído a partir da regressão 1 (com dímero-D), baseado
na soma dos valores aproximados do odds ratio obtidos na regressão em questão. Para este
modelo, o somatório pode variar de 0 até 11 pontos. No grupo com 0 (zero) ponto, a
probabilidade de apresentar ETE é de 5,7%; 3 pontos 23,5%; 5 pontos 39,3%; 6 pontos
50,0%; 8 pontos 56,7% e 11 pontos 78,6% (Tabela 26; p<0,001).
Tabela 26 – Escore preditivo de ETE baseado na regressão1 (com dímero-D).
Negativo
Positivo
Total
0
33 (94,3%)
2 (5,7%)
35
3
26 (76,5%)
8 (23,5%)
34
5
17 (60,7%)
11 (39,3%)
28
6
2 (50,0%)
2 (50,0%)
4
8
13 (43,3%)
17 (56,7%)
30
11
3 (21,4%)
11 (78,6%)
14
*P<0,001
O escore preditor 2 foi construído utilizando a soma dos odds ratio aproximados da
regressão 2 (com P-selectina). Este escore tem variação de 0 até 12 pontos, em que 0 ponto
apresenta probabilidade de 13,6% de apresentar ETE; 2 pontos 25,0%, 3 pontos 11,8%: 4
55
pontos 0,00%; 5 pontos 38,5%; 6 pontos 40,0%; 7 pontos 55,6%; 8 pontos 60,0%; 9 pontos
88,9%; 10 pontos 100,0% e 12 pontos 83,3% (Tabela 27; p<0,001).
Tabela 27 – Escore preditivo de ETE baseado na regressão 2 (com P-selectina).
Negativo
Positivo
Total
0
19 (86,4%)
3 (13,6%)
22
2
6 (75,0%)
2 (25,0%)
8
3
15 (88,2%)
2 (11,8%)
17
4
3 (100,0%)
0 (0,0%)
3
5
16 (61,5%)
10 (38,5%)
26
6
6 (60,0%)
4 (40,0%)
10
7
4 (44,4%)
5 (55,6%)
9
8
2 (40,0%)
3 (60,0%)
5
9
1 (11,1%)
8 (88,9%)
9
10
0 (0,0%)
2 (100,0%)
2
12
1 (16,7%)
5 (83,3%)
6
*P<0,001
Com a finalidade de facilitar a compreensão clínica dos achados, o escore preditor 1
(com ECOG 1,2 e 3, gênero e dímero D) foi classificado em faixas, como: baixo risco (0 à 3
pontos), moderado risco (5 à 6 pontos), alto risco (8 pontos) e muito alto risco (9 pontos),
com as seguintes probabilidades de ETE: 14,5%; 40,6%; 56,7% e 78,6% respectivamente
(Tabela 28; p<0,001).
Tabela 28 – Escore preditivo 3 com classificação de risco de ETE (com dímero-D).
Pontos
Classificação de risco
Negativo
Positivo
Total
0à3
Baixo risco
59 (85,5%)
10 (14,5%)
69
5à6
Moderado risco
19 (59,4%)
13 (40,6%)
32
8
Alto risco
13 (43,3%)
17 (56,7%)
30
9
Muito alto risco
3 (21,4%)
11 (78,6%)
14
*P<0,001
56
Assim como no modelo anterior, o escore preditivo 4, também foi elaborado com a
intensão de classificar em faixas de probabilidade de apresentar o ETE, tendo como
referência o escore preditivo 2, com P-selectina. As faixas foram assim divididas: de 0 à 4
pontos, classificado como baixo risco (14,0%); 5 à 6 pontos como moderado risco (38,9%); 7
à 8 pontos como alto risco (57,1%) e 9 ou mais pontos como 88,2% (Tabela 29; p<0,001).
Tabela 29 – Escore preditivo 4,com classificação de risco de ETE (com P-selectina).
Pontos
Classificação de risco
Negativo
Positivo
Total
0à4
Baixo risco
43 (86,0%)
7 (14,0%)
50
5à6
Moderado risco
22 (61,1%)
14 (38,9%)
36
7à8
Alto risco
6 (42,9%)
8 (57,1%)
14
9 ou mais
Muito alto risco
2 (11,8%)
15 (88,2%)
17
*P<0,001
Por fim, na tabela 30 estão os valores de área sobre a Curva ROC, desvio padrão,
valor de p, limite inferior e superior do intervalo de confiança, respectivamente, para os 4
modelos de escores preditivo: 1 (0,783; 0,039; <0,001; 0,706 e 0,859), escore preditor 2
(0,784; 0,045; <0,001; 0,695; 0,873), escore preditor 3 (0,759; 0,043; <0,001; 0,675; 0,843) e
escore preditor 4 (0,788; 0,045; <0,001; 0,700; 0,876).
Tabela 30 – Área da Curva ROC para os 4 modelos.
AC
DP
p
Escore preditor 1 (com dímero-D)
0,783
0,039
Escore preditor 2 (com P-selectina)
0,784
Escore preditor 3 (com dímero-D) em faixas
Escore preditor 4 (com P-selectina) em faixas
IC 95%
LI
LS
<0,001
0,706
0,859
0,045
<0,001
0,695
0,873
0,759
0,043
<0,001
0,675
0,843
0,788
0,045
<0,001
0,700
0,876
AC: área sobre a Curva ROC; DP: desvio padrão; IC: intervalo de confiança; LI: limite superior; LS: limite inferior.
6 DISCUSSÃO
Esse estudo corroborou, em parte, com dados previamente relatados, de que o
evento tromboembólico é um fenômeno importante a ser considerado para pacientes
oncológicos, submetidos ou não a tratamento, com um total de 36,03% de eventos
tromboembólicos confirmados. Esses eventos são particularmente significativos se
considerarmos que dentre 297 pacientes recrutados em um período de 231 dias, em 107
deles foram confirmados a ocorrência de tromboembolismo, com uma média de um evento
tromboembólico confirmado a cada 2,15 dias. Esses números ratificam a importância do
tema e a urgência em se aprimorar as estratégias de prevenção e diagnóstico precoce. Com
base em estimativa observacional, era esperada a proporção de 1:3 (um caso confirmado
para cada três casos suspeitos), portanto, esperava-se 33% de casos positivos.
A média de idade da amostra foi de 56,58 anos; assim, sem diferença relevante entre
os grupos. Houve diferença estatisticamente significativa entre os sexos. No grupo positivo
os homens representaram 48,62%, enquanto que no grupos negativo apenas 34,64%.
Porém, este dado pode questionado, pois ao analisar o percentual de participantes que
tiveram confirmação diagnóstica, 51,37% eram mulheres e 48,62% eram homens (p=0,028),
valores semelhantes aos encontrados em grande parte dos dados da literatura9, 10, 16, 17. A
maioria dos participantes (62,25%) possuía, no máximo, ensino fundamental completo, fato
que reflete o baixo grau de escolaridade da população atendida no Hospital de Barretos.
Não houve diferença entre os grupos quanto à hipertensão arterial sistêmica (HAS),
diabetes melitus e tabagismo. No grupo positivo para ETE, o percentual encontrado de
hipertensos foi de 40,43%, compatível com os valores encontrados na população em geral,
de 22,3% a 43,9%, com média de 32,5%; porém, na população entre 60 a 69 anos, estes
valores podem aumentar para 50%; e acima dos 70 anos pode chegar a 75%119-121. O
percentual de diabetes encontrado foi 14,89%, maior que a média encontrada na população
brasileira (5%). No entanto, ao analisar faixas etárias mais elevadas, por exemplo, entre 70 e
79 anos, o percentual pode subir até 17,5%122. Esse é um dado relevante na população
estudada, posto que é notoriamente conhecida a relação entre diabetes e eventos
vasculares anormais. O tabagismo ativo apresentou 12,46%, discretamente abaixo da média
brasileira, que é de 16,1%123. Sabidamente, o tabagismo é um fator de risco independente
para evento tromboembólico26, 124; porém, a diferença encontrada (8,26%, no grupo positivo
58
e 14,98%, no grupo negativo) pode ser explicada ao acaso, pois o valor p não foi significativo
(p=0,234).
A literatura apresenta dados robustos que comprovam a relação entre a diminuição
da capacidade de mobilização e de auto-cuidados com a ocorrência de ETE7, 27, 52. Grande
parte da amostra avaliada, apresentou ECOG 0 ou 1 (55,22%). Houve maior percentual de
participantes com restrição (ECOG 2, 3 e 4) de 55,96% no grupo positivo e menor no grupo
negativo 38,3%. Raciocínio semelhante pode ser aplicado para mobilização, pois a maioria
não tinha restrição à locomoção, ou caminhava com dificuldade, mas sem precisar de ajuda
em 72,39% (35,14% no grupo positivo e 76,59% no grupo negativo), ratificando-se mais uma
vez a comprovação entre a restrição à movimentação e ECOG com a ocorrência de ETE, em
nosso estudo.
Apesar de obesidade ser um fator de risco para ETE28, nos participantes avaliados,
22,71% apresentaram obesidade de grau I, II ou III, sendo 14,02% para o grupo positivo e
27,26% para o grupo negativo. Portanto, o índice de obesidade foi menor no grupo positivo
para ETE. É possível que essa relação tenha sofrido interferência de outros fatores, pois
pacientes com metástases, claramente debilitados, ou em estágio avançado da doença
oncológica, apresentam risco mais elevado para ETE; porém, apresentam baixo peso devido
ao estado de consumo do paciente.
O índice de recorrência de eventos tromboembólicos na população oncológica pode
chegar à 25%, aproximadamente. Na população estudada, 18 (16,82%) dos 107 participantes
confirmados para ETE estavam em uso de anticoagulante para tratamento de ETE prévio.
O estudo foi projetado para captar 300 pacientes e contava com perda de coleta de
sangue de aproximadamente 5%, esperado para aqueles participantes em uso de
antiagregante plaquetário ou anticoagulante, oral ou injetável. Entretanto, a perda de coleta
de sangue foi muito maior: 126 (42,42%) dos 297 participantes. Sendo assim, foi coletado
sangue para 171 participantes. Boa parte dessa perda foi ocasionada pelo uso de
anticoagulante, quer seja para tratamento de ETE, ou para profilaxia de ETE. Pacientes em
uso de antiagregante plaquetário também não tiveram sangue coletado. Os demais
pacientes se recusaram a colher sangue.
Os eventos tromboembólicos em pacientes oncológicos estão altamente relacionados à
doença neoplásica avançada. Na população estudada não foi diferente, pois 68,75% das
quimioterapias e 62,16% fizeram uso deste tratamento com caráter paliativo. Esta relação
59
entre doença avançada e ETE continua a ser intrigante e desafiadora aos olhos da medicina,
necessitando de muitos outros estudos para esclarecer tal desafio.
Ao
relacionar os exames laboratoriais
individualmente
com
os eventos
tromboembólicos, foi evidenciado, surpreendentemente, a associação entre hemoglobina e
hematócrito com os eventos tromboembólicos. É possível que a explicação esteja na relação
da queda da hemoglobina com casos de doença mais avançada e, consequentemente, maior
risco de evoluir para ETE. A interleucina-6, dímero-D e P-selectina foram, estatisticamente,
diferentes entre os grupos positivos e negativos, acenando para uma possibilidade de
utilização destes exames no auxílio diagnóstico.
A casuística estudada apresentou algumas características laboratoriais bem
interessantes e diferentes dos resultados encontrados na literatura. Dentre eles, o mais
intrigante foi o valor encontrado da P-selectina. Apesar de manter a capacidade de
diferenciar os grupos com e sem ETE, os valores médios estiveram muito abaixo do
esperado, ao ponto de nenhuma das dosagens dos participantes apresentar valor superior
ao estabelecido como limite pela literatura, nem mesmo entre aqueles confirmados para
ETE.
Ao calcular o valor da Curva ROC do dímero-D e comparar a área sobre a curva do
ponto de corte e compará-lo com os da literatura, encontramos o ponto de corte calculado
pelo estudo mais fidedigno do que o ponto de corte estabelecido pela literatura. Como já
suspeitado pelos autores de estudo, o cut off do dímero-D para diferenciar os grupos, foi
mais elevado do que o da literatura (633ng/mL versus 500ng/mL respectivamente).
Uma das explicações para as diferenças laboratoriais entre a amostra e os resultados
da literatura, pode ser pelo fato de que é uma característica do povo brasileiro a grande
miscigenação, fato esse que poderia influenciar nos achados aqui estabelecidos, diferentes
de populações mais homogêneas como as dos estudos reportados em literatura. Ainda,
pode-se atribuir ao, simples fato de que pacientes com câncer apresentam diferenças
inerentes ao desenvolvimento anárquico característicos das neoplasias malignas
necessitando-se de maior investigação sobre as grandes variações decorrentes da
carcinogênese.
60
Apesar de estar relacionado com tumores mais avançados e com características mais
agressivas75, a elevação sérica do fibrinogênio, este estudo não encontrou relação com o
ETE, mesmo sabendo que doenças mais avançadas apresenta mais ETE. Mesmo que alguns
dados indiquem que pacientes oncológicos apresentam elevação dos valores da atividade do
fator X ativado92, possivelmente por interferir na cascata de coagulação, principalmente nos
pacientes metastáticos, mas para diferenciar os grupos, com e sem ETE, este exame não se
mostrou eficaz. Os níveis de proteína C reativa, foram bem mais altos do que os valores de
referência, o que já era de se esperar48, entretanto também não apresentou ser para o
diagnóstico de ETE.
Os quatro modelos de escore preditor de eventos se mostram úteis, tanto com dímeroD, quanto com P-selectina, com a diferença que para o dois modelos baseados no dímero-D,
não necessitam da variável metástase. O fato é que tanto o Dímero-D, quanto P-selectina,
apresentam úteis no diagnóstico de ETE, desde que não estejam no mesmo modelo. Seja de
forma independente ou dentro de um escore preditor.
61
7. CONCLUSÕES
1. Os participantes apresentaram média de idade de 57 anos, IMC normal, pouca
ou nenhuma restrição à locomoção. As neoplasias mais frequentes foram os
carcinomas de mama e de colo de útero; na maioria das vezes apresentavam
metástases à distância e em quimioterapia paliativa; e 39,78% estavam em uso
de anticoagulante;
2. Os grupos estudados mostraram diferenças laboratoriais para hemoglobina,
hematócrito, fibrinogênio, TNF-alfa, PCR-US, IL-6, dímero-D e P-selectina;
3. A partir das variáveis identificadas dos modelos, estabeleceram-se escores
preditores de ETE, classificados pelo grau de risco, baseado no dímero-D e o com
a P-selectina. Ambos mostram boa capacidade de predição.
62
8
REFERÊNCIAS BIBLIOGRÁFICAS
1.
Huth EJ, Murray TJ. Medicine in quotations: views of health and disease through the ages:
ACP Press; 2006.
2.
Hirsh J, Hoak J. Management of deep vein thrombosis and pulmonary embolism a statement
for healthcare professionals from the Council on Thrombosis (in Consultation with the Council on
Cardiovascular Radiology), American Heart Association. Circulation. 1996;93(12):2212-45.
3.
Carrier M, Khorana A, Zwicker J, Noble S, Lee A. Management of challenging cases of patients
with cancer‐associated thrombosis including recurrent thrombosis and bleeding: guidance from the
SSC of the ISTH. Journal of Thrombosis and Haemostasis. 2013;11(9):1760-5.
4.
Farge D, Debourdeau P, Beckers M, Baglin C, Bauersachs R, Brenner B, et al. International
clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients
with cancer. Journal of Thrombosis and Haemostasis. 2013;11(1):56-70.
5.
Guyton AC, Hall JE, Guyton AC. Tratado de fisiologia médica: Elsevier Brasil; 2006.
6.
Giuntini C, Di Ricco G, Marini C, Melillo E, Palla A. Pulmonary embolism: epidemiology. Chest.
1995;107(1 Suppl):3S-9S.
7.
Silverstein MD, Heit JA, Mohr DN, Petterson TM, O'Fallon WM, Melton LJ. Trends in the
incidence of deep vein thrombosis and pulmonary embolism: a 25-year population-based study.
Archives of internal medicine. 1998;158(6):585-93.
8.
Gillum RF. Pulmonary embolism and thrombophlebitis in the United States, 1970–1985.
American heart journal. 1987;114(5):1262-4.
9.
Anderson FA, Wheeler HB, Goldberg RJ, Hosmer DW, Patwardhan NA, Jovanovic B, et al. A
population-based perspective of the hospital incidence and case-fatality rates of deep vein thrombosis
and pulmonary embolism: the Worcester DVT Study. Archives of internal medicine. 1991;151(5):9338.
10.
Nordström M, Lindblad B, Bergqvist D, Kjellström T. A prospective study of the incidence of
deep ‐ vein thrombosis within a defined urban population. Journal of internal medicine.
1992;232(2):155-60.
11.
Kierkegaard A. Incidence of acute deep vein thrombosis in two districts. A phlebographic
study. Acta chirurgica Scandinavica. 1979;146(4):267-9.
63
12.
COON WW, WILLIS PW, KELLER JB. Venous thromboembolism and other venous disease in the
Tecumseh community health study. Circulation. 1973;48(4):839-46.
13.
Moser KM, Fedullo PF, LitteJohn JK, Crawford R. Frequent asymptomatic pulmonary
embolism in patients with deep venous thrombosis. Jama. 1994;271(3):223-5 %@ 0098-7484.
14.
Meignan M, Rosso J, Gauthier H, Brunengo F, Claudel S, Sagnard L, et al. Systematic lung
scans reveal a high frequency of silent pulmonary embolism in patients with proximal deep venous
thrombosis. Archives of internal medicine. 2000;160(2):159-64 %@ 0003-9926.
15.
Prandoni P, Lensing AW, Cogo A, Cuppini S, Villalta S, Carta M, et al. The long-term clinical
course of acute deep venous thrombosis. Annals of internal medicine. 1996;125(1):1-7.
16.
Cushman M, Tsai A, Heckbert S, White R, Rosamund W, Enright P. Incidence rates, case
fatality, and recurrence rates of deep vein thrombosis and pulmonary embolus: the Longitudinal
Investigation of Thromboembolism Etiology (LITE). Thromb Haemost. 2001;86(1).
17.
White RH. The epidemiology of venous thromboembolism. Circulation. 2003;107(23 suppl
1):I-4-I-8.
18.
Kearon C, Kahn S, Agnelli G, Goldhaber S, Raskob G. 38. Comerota AJ; American College of
Chest Physicians. Antithrombotic therapy for venous thromboembolic disease: American College of
Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2008.
19.
Schulman S, Granqvist S, Holmström M, Carlsson A, Lindmarker P, Nicol P, et al. The duration
of oral anticoagulant therapy after a second episode of venous thromboembolism. New England
Journal of Medicine. 1997;336(6):393-8.
20.
Lyman GH, Khorana AA, Falanga A, Clarke-Pearson D, Flowers C, Jahanzeb M, et al. American
Society of Clinical Oncology guideline: recommendations for venous thromboembolism prophylaxis
and treatment in patients with cancer. Journal of Clinical Oncology. 2007;25(34):5490-505.
21.
Lyman GH, Khorana AA, Kuderer NM, Lee AY, Arcelus JI, Balaban EP, et al. Venous
thromboembolism prophylaxis and treatment in patients with cancer: American Society of Clinical
Oncology clinical practice guideline update. Journal of Clinical Oncology. 2013;31(17):2189-204.
22.
Hill RR, Martinez KD, Delate T, Witt DM. A descriptive evaluation of warfarin use in patients
receiving hospice or palliative care services. Journal of thrombosis and thrombolysis.
2009;27(3):334-9.
64
23.
Lee AY, Peterson EA. Treatment of cancer-associated thrombosis. Blood. 2013;122(14):2310-
7.
24.
Murin S, Romano PS, White RH. Comparison of outcomes after hospitalization for deep
venous thrombosis or pulmonary embolism. Thrombosis and haemostasis. 2002;88(3):407-14.
25.
Kyrle PA, Eichinger S. Deep vein thrombosis. The Lancet. 2005;365(9465):1163-74.
26.
Goldhaber SZ, Grodstein F, Stampfer MJ, Manson JE, Colditz GA, Speizer FE, et al. A
prospective study of risk factors for pulmonary embolism in women. Jama. 1997;277(8):642-5.
27.
Salzman E, Hirsh J. The epidemiology, pathogenesis, and natural history of venous
thrombosis. Hemostasis and thrombosis, basic principles and clinical practice 3rd ed Philadelphia,
PA: Lippincott. 1994:1275-96.
28.
Darvall K, Sam R, Silverman S, Bradbury A, Adam D. Obesity and thrombosis. European
journal of vascular and endovascular surgery. 2007;33(2):223-33.
29.
Cushman M, Tsai AW, White RH, Heckbert SR, Rosamond WD, Enright P, et al. Deep vein
thrombosis and pulmonary embolism in two cohorts: the longitudinal investigation of
thromboembolism etiology. The American journal of medicine. 2004;117(1):19-25.
30.
Trousseau A. Phlegmasia alba dolens. In: 2nd, editor. Clinique Medicale de l’Hotel-Dieu de
Paris. 2nd ed. Paris: JB Bailliere; 1865. p. 654–712.
31.
Sorensen HT, Mellemkjaer L, Steffensen FH, Olsen JH, Nielsen GL. The risk of a diagnosis of
cancer after primary deep venous thrombosis or pulmonary embolism. N Engl J Med.
1998;338(17):1169-73.
32.
Prandoni P, Lensing AW, Büller HR, Cogo A, Prins MH, Cattelan AM, et al. Deep-vein
thrombosis and the incidence of subsequent symptomatic cancer. New England Journal of Medicine.
1992;327(16):1128-33.
33.
Lee AY, Levine MN. Venous thromboembolism and cancer: risks and outcomes. Circulation.
2003;107(23 Suppl 1):I17-21.
34.
Carson JL, Kelley MA, Duff A, Weg JG, Fulkerson WJ, Palevsky HI, et al. The clinical course of
pulmonary embolism. New England Journal of Medicine. 1992;326(19):1240-5.
35.
Nastri CO, Martins WdP, Reis FJCd, Ferriani RA. Câncer de mama e disfunção endotelial.
Revista da Associação Médica Brasileira. 2008;54(5):467-70.
65
36.
D'Asti E, Magnus N, Meehan B, Garnier D, Rak J. Genetic basis of thrombosis in cancer. In:
2014. Thieme Medical Publishers. 40:284-95 %@ 0094-6176.
37.
Macfarlane R. An enzyme cascade in the blood clotting mechanism, and its function as a
biochemical amplifier. 1964.
38.
Davie EW, Ratnoff OD. Waterfall sequence for intrinsic blood clotting. Science.
1964;145(3638):1310-2.
39.
Franco RF. Fisiologia da coagulação, anticoagulação e fibrinólise. Medicina (Ribeirao Preto
Online). 2001;34(3/4):229-37.
40.
Hoffman M, Monroe DM. Coagulation 2006: a modern view
Hematology/oncology clinics of North America. 2007;21(1):1-11.
41.
of hemostasis.
Vine AK. Recent advances in haemostasis and thrombosis. Retina. 2009;29(1):1-7.
42.
Jenny N, Mann K. Coagulation cascade: an overview. Thrombosis and Hemorrhage
Baltimore: Williams and Wilkins. 1998:3-27.
43.
Gale AJ, Gordon SG. Update on tumor cell procoagulant factors. Acta haematologica.
2001;106(1-2):25-32.
44.
Hanna DL, White RH, Wun T. Biomolecular markers of cancer-associated thromboembolism.
Critical reviews in oncology/hematology. 2013;88(1):19-29.
45.
Ay C, Simanek R, Vormittag R, Dunkler D, Alguel G, Koder S, et al. High plasma levels of
soluble P-selectin are predictive of venous thromboembolism in cancer patients: results from the
Vienna Cancer and Thrombosis Study (CATS). Blood. 2008;112(7):2703-8.
46.
Ay C, Dunkler D, Marosi C, Chiriac A-L, Vormittag R, Simanek R, et al. Prediction of venous
thromboembolism in cancer patients. Blood. 2010;116(24):5377-82.
47.
Ay C, Dunkler D, Pirker R, Thaler J, Quehenberger P, Wagner O, et al. High D-dimer levels are
associated with poor prognosis in cancer patients. Haematologica. 2012;97(8):1158-64.
48.
Ramacciotti E, Blackburn S, Hawley AE, Vandy F, Ballard-Lipka N, Stabler C, et al. Evaluation of
soluble P-selectin as a marker for the diagnosis of deep venous thrombosis. Clinical and Applied
Thrombosis/Hemostasis. 2011;17(4):425-31.
66
49.
Barker N, Nygaard K, Walters W, Priestley J. A statistical study of postoperative venous
thrombosis and pulmonary embolism. IV. Location of thrombosis: relation of thrombosis and
embolism. In: Mayo Clin Proc; 1941. 16(Jan 15):33-7.
50.
Rollo HA, Maffei FHdA, Lastória S, Yoshida WB, Castiglia V. Uso rotineiro da flebografia no
diagnóstico da trombose venosa profunda dos membros inferiores. Cir vasc angiol. 1986;2(1):7-12.
51.
Rollo HA, Fortes VB, Junior ATF, Yoshida WB, Lastória S, Maffei FHdA. Abordagem diagnóstica
dos pacientes com suspeita de trombose venosa profunda dos membros inferiores. J Vasc Bras.
2005;4(1):79-92.
52.
Wells PS, Anderson DR, Bormanis J, Guy F, Mitchell M, Gray L, et al. Value of assessment of
pretest probability of deep-vein thrombosis in clinical management. The Lancet.
1997;350(9094):1795-8.
53.
Chance JF, Abbitt PL, Tegtmeyer CJ, Powers RD. Real-time ultrasound for the detection of
deep venous thrombosis. Annals of emergency medicine. 1991;20(5):494-6.
54.
Sumner DS, Lambeth A. Reliability of Doppler ultrasound in the diagnosis of acute venous
thrombosis both above and below the knee. The American Journal of Surgery. 1979;138(2):205-10.
55.
Barros MVL, Pereira VSR, Pinto DM. Controvérsias no diagnóstico e tratamento da trombose
venosa profunda pela ecografia vascular. Jornal Vascular Brasileiro. 2012;11(2):137-43.
56.
Hamper UM, DeJong MR, Scoutt LM. Ultrasound evaluation of the lower extremity veins.
Radiologic Clinics of North America. 2007;45(3):525-47.
57.
Lensing AW, Prandoni P, Brandjes D, Huisman PM, Vigo M, Tomasella G, et al. Detection of
deep-vein thrombosis by real-time B-mode ultrasonography. New England Journal of Medicine.
1989;320(6):342-5.
58.
do Amaral Baruzzi AC, Nussbacher A, Lagudis S, Souza JAM. Trombose venosa profunda.
Profilaxia. Arq Bras Cardiol. 1996;67(3).
59.
Investigators P. Value of the ventilation/perfusion scan in acute pulmonary embolism. Results
of the prospective investigation of pulmonary embolism diagnosis (PIOPED). JAMA: the journal of the
American Medical Association. 1990;263(20):2753.
60.
Niederman MS, Mandell LA, Anzueto A, Bass JB, Broughton WA, Campbell GD, et al.
Guidelines for the management of adults with community-acquired pneumonia: diagnosis,
assessment of severity, antimicrobial therapy, and prevention. American journal of respiratory and
critical care medicine. 2001;163(7):1730-54.
67
61.
Wells PS, Ginsberg JS, Anderson DR, Kearon C, Gent M, Turpie AG, et al. Use of a clinical
model for safe management of patients with suspected pulmonary embolism. Annals of internal
medicine. 1998;129(12):997-1005.
62.
Caramelli B, Gottschall CAM, Blacher C, Casagrande EL, Lucio EdA, Manente ERF, et al. Diretriz
de embolia pulmonar. Arquivos Brasileiros de Cardiologia. 2004;83:1-8.
63.
Wittram C, Kalra MK, Maher MM, Greenfield A, McLoud TC, Shepard J-AO. Acute and chronic
pulmonary emboli: angiography–CT correlation. American Journal of Roentgenology.
2006;186(6_supplement_2):S421-S9.
64.
Wittram C, Maher MM, Yoo AJ, Kalra MK, Shepard J-AO, McLoud TC. CT Angiography of
Pulmonary Embolism: Diagnostic Criteria and Causes of Misdiagnosis 1. Radiographics.
2004;24(5):1219-38.
65.
Stein PD, Woodard PK, Weg JG, Wakefield TW, Tapson VF, Sostman HD, et al. Diagnostic
Pathways in Acute Pulmonary Embolism: Recommendations of the PIOPED II Investigators 1.
Radiology. 2007;242(1):15-21.
66.
Sostman HD, Coleman RE, DeLong DM, Newman GE, Paine S. Evaluation of revised criteria for
ventilation-perfusion scintigraphy in patients with suspected pulmonary embolism. Radiology.
1994;193(1):103-7.
67.
Stein PD, Fowler SE, Goodman LR, Gottschalk A, Hales CA, Hull RD, et al. Multidetector
computed tomography for acute pulmonary embolism. New England Journal of Medicine.
2006;354(22):2317-27.
68.
Riedl J, Pabinger I, Ay C. Platelets in cancer and thrombosis. Hamostaseologie. 2014;34(1):54-
62.
69.
Buergy D, Wenz F, Groden C, Brockmann MA. Tumor–platelet interaction in solid tumors.
International Journal of Cancer. 2012;130(12):2747-60.
70.
Simanek R, Vormittag R, Ay C, Alguel G, Dunkler D, Schwarzinger I, et al. High platelet count
associated with venous thromboembolism in cancer patients: results from the Vienna Cancer and
Thrombosis Study (CATS). Journal of Thrombosis and Haemostasis. 2010;8(1):114-20.
71.
Honn KV, Tang DG, Crissman JD. Platelets and cancer metastasis: a causal
relationship?Cancer and Metastasis Reviews. 1992;11(3-4):325-51.
68
72.
Gay LJ, Felding-Habermann B. Contribution of platelets to tumour metastasis. Nature
Reviews Cancer. 2011;11(2):123-34.
73.
Rothwell PM, Price JF, Fowkes FGR, Zanchetti A, Roncaglioni MC, Tognoni G, et al. Short-term
effects of daily aspirin on cancer incidence, mortality, and non-vascular death: analysis of the time
course of risks and benefits in 51 randomised controlled trials. The Lancet. 2012;379(9826):1602-12.
74.
Kell DB, Pretorius E. The simultaneous occurrence of both hypercoagulability and
hypofibrinolysis in blood and serum during systemic inflammation, and the roles of iron and fibrin
(ogen). Integr Biol %@ 1757-9708. 2014.
75.
de Moerloose P, Boehlen F, Neerman-Arbez M. Fibrinogen and the risk of thrombosis. Semin
Thromb Hemost. 2010;36(1):7-17.
76.
Bloomston M, Zhou JX, Rosemurgy AS, Frankel W, Muro-Cacho CA, Yeatman TJ. Fibrinogen γ
overexpression in pancreatic cancer identified by large-scale proteomic analysis of serum samples.
Cancer research. 2006;66(5):2592-9.
77.
Pichler M, Dalpiaz O, Ehrlich GC, Stojakovic T, Martín Hernández JM, Mannweiler S, et al.
Validation of the Preoperative Plasma Fibrinogen Level as a Prognostic Factor in a European Cohort of
Patients with Localized Upper Tract Urothelial Carcinoma. The Journal of urology. 2014;191(4):920-5
%@ 0022-5347.
78.
Montague CT, Prins JB, Sanders L, Zhang J, Sewter CP, Digby J, et al. Depot-related gene
expression in human subcutaneous and omental adipocytes. Diabetes. 1998;47(9):1384-91.
79.
Ruan H, Lodish HF. Insulin resistance in adipose tissue: direct and indirect effects of tumor
necrosis factor-α. Cytokine & growth factor reviews. 2003;14(5):447-55.
80.
Volp ACP, Alfenas RdCG, Costa NMB, Minim VPR, Stringueta PC, Bressan J. Capacidade dos
biomarcadores inflamatórios em predizer a síndrome metabólica: Inflammation biomarkers capacity
in predicting the metabolic syndrome. Arquivos Brasileiros de Endocrinologia & Metabologia.
2008;52(3):537-49.
81.
Yudkin JS, Stehouwer C, Emeis J, Coppack S. C-reactive protein in healthy subjects:
associations with obesity, insulin resistance, and endothelial dysfunction a potential role for cytokines
originating from adipose tissue?Arteriosclerosis, thrombosis, and vascular biology. 1999;19(4):9728.
82.
Pintão MCT, Franco RF. Coagulação intravascular disseminada. Medicina (Ribeirao Preto
Online). 2001;34(3/4):282-91.
69
83.
Balkwill F. Tumour necrosis factor and cancer. Nature Reviews Cancer. 2009;9(5):361-71.
84.
Duarte M, Longatto Filho A, Schmitt FC. Angiogenesis, haemostasis and cancer: new
paradigms and old concerns. Jornal Brasileiro de Patologia e Medicina Laboratorial. 2007;43(6):4419.
85.
Borensztajn K, Bijlsma MF, Reitsma PH, Peppelenbosch MP, Spek CA. Coagulation factor Xa
inhibits cancer cell migration via protease-activated receptor-1 activation. Thromb Res.
2009;124(2):219-25.
86.
Davie EW, Fujikawa K, Kisiel W. The coagulation cascade: initiation, maintenance, and
regulation. Biochemistry. 1991;30(43):10363-70.
87.
Prandoni P, Carta M, Cogo A, Ruol A, Vigo M, Casara D, et al. Comparison of subcutaneous
low-molecular-weight heparin with intravenous standard heparin in proximal deep-vein thrombosis.
The Lancet. 1992;339(8791):441-5.
88.
Hull RD, Raskob GE, Pineo GF, Green D, Trowbridge AA, Elliott CG, et al. Subcutaneous lowmolecular-weight heparin compared with continuous intravenous heparin in the treatment of
proximal-vein thrombosis. New England Journal of Medicine. 1992;326(15):975-82.
89.
Agnelli G, Berkowitz S, Bounameaux H, Büller H, Cohen A, Gallus A, et al. Oral rivaroxaban for
symptomatic venous thromboembolism. N Engl J Med. 2010;363(26):2499-510.
90.
Büller HR, Prins MH, Lensing AW, Decousus H, Jacobson BF, Minar E, et al. Oral rivaroxaban
for the treatment of symptomatic pulmonary embolism. New England Journal of Medicine.
2012;366(14):1287-97.
91.
Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M, et al. Oral apixaban for the
treatment of acute venous thromboembolism. New England Journal of Medicine. 2013;369(9):799808.
92.
Rennie J, Ogston D. Fibrinolytic activity in malignant disease. Journal of clinical pathology.
1975;28(11):872-4.
93.
Bisoendial RJ, Boekholdt SM, Vergeer M, Stroes ES, Kastelein JJ. C-reactive protein is a
mediator of cardiovascular disease. Eur Heart J. 2010;31(17):2087-91.
94.
Ridker PM. C-reactive protein, inflammation, and cardiovascular disease: clinical update. Tex
Heart Inst J. 2005;32(3):384-6.
70
95.
Epstein FH, Gabay C, Kushner I. Acute-phase proteins and other systemic responses to
inflammation. New England journal of medicine. 1999;340(6):448-54 %@ 0028-4793.
96.
Ershler WB, Keller ET. Age-associated increased interleukin-6 gene expression, late-life
diseases, and frailty. Annu Rev Med. 2000;51:245-70.
97.
Heinrich P, Behrmann I, Haan S, Hermanns H, Muller-Newen G, Schaper F. Principles of
interleukin (IL)-6-type cytokine signalling and its regulation. Biochem J. 2003;374:1-20.
98.
Lowe GD, Rumley A, McMahon AD, Ford I, O’Reilly DSJ, Packard CJ. Interleukin-6, fibrin Ddimer, and coagulation factors VII and XIIa in prediction of coronary heart disease. Arteriosclerosis,
thrombosis, and vascular biology. 2004;24(8):1529-34.
99.
Ridker PM, Rifai N, Stampfer MJ, Hennekens CH. Plasma concentration of interleukin-6 and
the risk of future myocardial infarction among apparently healthy men. Circulation.
2000;101(15):1767-72.
100.
Biasucci LM, Vitelli A, Liuzzo G, Altamura S, Caligiuri G, Monaco C, et al. Elevated levels of
interleukin-6 in unstable angina. Circulation. 1996;94(5):874-7.
101.
Stouthard J, Levi M, Hack C, Veenhof C, Romijn H, Sauerwein H, et al. Interleukin-6 stimulates
coagulation, not fibrinolysis, in humans. Thrombosis and haemostasis. 1996;76(5):738-42.
102.
Strassmann G, Fong M, Kenney J, Jacob C. Evidence for the involvement of interleukin 6 in
experimental cancer cachexia. Journal of Clinical Investigation. 1992;89(5):1681.
103.
Trends CET. Análise de marcadores de estabilização da placa aterosclerótica após evento
coronariano agudo. Arquivos Brasileiros de Cardiologia. 2006;87(1).
104.
Sun X, Mao Y, Wang J, Zu L, Hao M, Cheng G, et al. IL-6 secreted by cancer-associated
fibroblasts induces tamoxifen resistance in luminal breast cancer. Oncogene. 2014.
105.
Ginsberg JS, Wells PS, Kearon C, Anderson D, Crowther M, Weitz JI, et al. Sensitivity and
specificity of a rapid whole-blood assay for D-dimer in the diagnosis of pulmonary embolism. Annals
of internal medicine. 1998;129(12):1006-11.
106.
Zipes DP, Libby P, Bonow RO. Braunwald: tratado de doenças cardiovasculares: Elsevier;
2006.
107.
Venturinelli ML, Hovnan A, de Matos Soeiro A, Nicolau JC, Ramires JA, D’Amico ÉA, et al.
Ativação plaquetária em formas clínicas distintas da doença arterial coronariana (papel da Pselectina e de outros marcadores nas anginas estável e instável). Arq Bras Cardiol. 2006;87:446-50.
71
108.
Geng J-G, Chen M, Chou K-C. P-selectin cell adhesion molecule in inflammation, thrombosis,
cancer growth and metastasis. Current medicinal chemistry. 2004;11(16):2153-60.
109.
Francischetti I, Moreno JB, Scholz M, Yoshida WB. Os leucócitos ea resposta inflamatória na
lesão de isquemia-reperfusão. Rev Bras Cir Cardiovasc. 2010;25(4):575-84.
110.
Kansas GS. Selectins and their ligands: current concepts and controversies. Blood.
1996;88(9):3259-87.
111.
Kozlowski E, Pavao M, Borsig L. Ascidian dermatan sulfates attenuate metastasis,
inflammation and thrombosis by inhibition of P‐selectin. Journal of Thrombosis and Haemostasis.
2011;9(9):1807-15.
112.
Myers DD, Hawley AE, Farris DM, Wrobleski SK, Thanaporn P, Schaub RG, et al. P-selectin and
leukocyte microparticles are associated with venous thrombogenesis. Journal of vascular surgery.
2003;38(5):1075-89.
113.
Agarwal V, Phung OJ, Tongbram V, Bhardwaj A, Coleman CI. Statin use and the prevention of
venous thromboembolism: a meta-analysis. Int J Clin Pract. 2010;64(10):1375-83.
114.
Kim YJ, Borsig L, Varki NM, Varki A. P-selectin deficiency attenuates tumor growth and
metastasis. Proceedings of the National Academy of Sciences. 1998;95(16):9325-30.
115.
Hathaway WE, Goodnight SH. Disorders of hemostasis and thrombosis: a clinical guide:
McGraw-Hill, Health Professions Division; 1993.
116.
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, et al. Toxicity and
response criteria of the Eastern Cooperative Oncology Group. American journal of clinical oncology.
1982;5(6):649-56.
117.
Anjos LA. Índice de massa corporal (massa corporal. estatura-2) como indicador do estado
nutricional de adultos: revisão da literatura. Revista de Saúde Pública. 1992;26(6):431-6.
118.
Godoy-Matos A, Oliveira J, Guedes E, Carraro L, Lopes A, Mancini M, et al. Diretrizes
brasileiras de obesidade 2009/2010. Associação Brasileira para o Estudo da Obesidade e da
Síndrome Metabólica (ABESO). 2009.
119.
Sposito AC, Caramelli B, Fonseca FA, Bertolami MC, Afiune Neto A, Souza AD, et al. IV Diretriz
brasileira sobre dislipidemias e prevenção da aterosclerose: Departamento de Aterosclerose da
Sociedade Brasileira de Cardiologia. Arquivos Brasileiros de Cardiologia. 2007;88:2-19.
72
120.
Cesarino CB, Cipullo JP, Martin JFV, Ciorlia LA, Godoy MRPd, Cordeiro JA, et al. Prevalência e
fatores sociodemográficos em hipertensos de São José do Rio Preto-SP. Arq Bras Cardiol.
2008;91(1):31-5.
121.
Rosário TMd, Scala LCN, França GVAd, Pereira MRG, Jardim PCBV. Prevalência, controle e
tratamento da hipertensão arterial sistêmica em Nobres-MT. Arq bras cardiol. 2009;93(6):672-8.
122.
Freitas LRSd, Garcia LP. Evolução da prevalência do diabetes e deste associado à hipertensão
arterial no Brasil: análise da Pesquisa Nacional por Amostra de Domicílios, 1998, 2003 e 2008.
Epidemiologia e Serviços de Saúde. 2012;21(1):07-19.
123.
Malta DC, Moura EC, Silva SA, Oliveira PPVd, Silva VLdC. Prevalência do tabagismo em
adultos residentes nas capitais dos estados e no Distrito Federal, Brasil, 2008. J Bras Pneumol.
2010;36(1):75-83.
124.
Hansson P-O, Eriksson H, Welin L, Svärdsudd K, Wilhelmsen L. Smoking and abdominal
obesity: risk factors for venous thromboembolism among middle-aged men: the study of men born in
1913. Archives of internal medicine. 1999;159(16):1886-90.
73
Anexo 1
74
75
76
77
Anexo2
78
79
80
81
Anexo 3
1
2
3
4
5
6
Identificação
1
Nome
2
Registro hospitalar
3
Data da primeira consulta do HCB
DD-MM-AAAA
Data de Nascimento
DD-MM-AAAA
Gênero
1- Feminino; 2- Masculino
4
5
6
Nível educacional
1- Analfabeto; 2- Sabe ler e escrever;
3- Ensino fundamental incompleto; 4- Ensino fundamental completo;
5- Ensino médio incompleto; 6- Ensino médio completo;
7- Ensino superior incompleto; 8- Ensino superior completo
7
8
Renda familiar
R$
7
8
DADOS CLÍNICOS
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
Peso
KILOS
Altura
METROS
Hipertensão arterial
0- Não; 1- Sim; 99- Ignorado
Diabetes
0- Não; 1- Sim; 99- Ignorado
Varizes
0- Não; 1- Sim; 99- Ignorado
Tabagismo
0- Nunca fez uso; 1- Já fez, no passado (há mais de 6 meses); 2- Faz uso atualmente
Tempo de exposição ao tabaco
ANOS
Mobilização
0- Não tem restrição à locomoção; 1- Caminha sem ajuda, mas com dificuldade;
2- Caminha apenas com ajuda de outras pessoas;
3- Não consegue caminhar, mas senta fora da cama; 4- Restrito à cama
ECOG (Escala de Performance)
0- Completamente ativo; capaz de realizar todas as suas atividades sem restrição;
1- Restrição a atividades físicas rigorosas; é capaz de trabalhos leves e de natureza sedentária
2- Capaz de realizar todos os auto-cuidados, mas incapaz de realizar qualquer atividade de trabalho; em
pé aproximadamente 50% das horas em que o paciente está acordado; 3- Capaz de realizar somente
auto-cuidados limitados, confinado ao leito ou cadeira mais de 50% das horas em que o paciente está
acordado; 4- Completamente incapaz de realizar qualquer auto-cuidado básico. Totalmente confinada á
cama ou cadeira
DOENÇA ONCOLÓGICA
CID da doença oncológica em tratamento (principal se houver mais de uma)
ESPECIFICAR
CID da doença oncológica em tratamento (se houver mais de uma)
ESPECIFICAR
CID da doença oncológica em tratamento (se houver mais de duas)
ESPECIFICAR
Data do diagnostico da doença em atividade
DD-MM-AAAA
Doença em atividade?
0- Não; 1- Sim; 99- Ignorado
Recidiva loco-regional
0- Não; 1- Sim; 99- Ignorado
Metástase à distância
0- Não; 1- Sim; 99- Ignorado
Quimioterapia
0- Não havia feito até o momento; 1- Estava em andamento; 2- Já havia encerrado
Data do início da Quimioterapia
DD-MM-AAAA
Data do término da Quimioterapia
DD-MM-AAAA
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
26
27
82
28
29
30
31
32
33
34
35
36
37
38
Intenção da Quimioterapia
1- Paliativa; 2- Terapêutica
Motivo da interrupção da Quimioterapia
1- Término da programação; 2- Término precoce
Radioterapia
0- Não havia feito até o momento; 1- Estava em andamento; 2- Já havia encerrado
Data do inicio da Radioterapia
DD-MM-AAAA
Data do término da Radioterapia
DD-MM-AAAA
Intenção da Radioterapia
1- Paliativa; 2-Terapêutica
Motivo da interrupção da radioterapia
1-Término da programação; 2-Término precoce
Tratamento cirúrgico
0- Não; 1- Sim
Qual cirurgia? (última se houver mais de uma)
28
29
30
31
32
33
34
35
36
Data da cirurgia (última se houver mais de uma)
DD-MM-AAAA
Trauma (físico) nos últimos 3 meses?
0- Não; 1- Sim
37
38
EVENTO TROMBOEMBÓLICO
39
40
Suspeita clínica
1-TVP; 2-TEP
Dia do diagnóstico do evento tromboembólico
DD-MM-AAAA
39
40
A suspeita clínica foi confirmada por:
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
1- Tomografia; 2- Ressonância Nuclear Magnética;
3- Cintilografia; 4- Doppler; 5- Arteriografia
Em caso de confirmação de TPV (hipótese diagnóstico inicial) houve posteriormente o diagnóstico de
TEP?
0- Não; 1- Sim; 99- Ignorado
Em caso de confirmação de TEP (hipótese diagnóstico inicial) houve posteriormente o diagnóstico de
TVP?
0- Não; 1- Sim; 99- Ignorado
Necessitou de internação devido ao evento tromboembólico?
0- Não; 1- Sim; 99- Ignorado
Se houve internação, por quantos dias?
Nº DE DIAS
Já teve evento tromboembólico anteriormente?
0- Não; 1- Sim, TPV; 2- Sim TEP; 3- Sim TPV e TEP; 99- Ignorado
Estava em tratamento para TVP?
0- Não; 1- Sim; 99- Ignorado
Estava em tratamento para TEP?
0- Não; 1- Sim; 99- Ignorado
Se já teve evento tromboembólico, quando (última vez se houve mais de um)?
DD-MM-AAAA
Se já teve evento tromboembólico, quantas vezes
Está em uso de anticoagulante oral (marevan, marcoumar, varfarina, rivaroxabana ou dabigatrana)
0- Não; 1- Sim, uso irregular; 2- Sim, uso regular; 99- Ignorado
Está em uso de anticoagulante injetável (Heparina, Enoxaparina ou Fondaparinux)
0- Não; 1- Sim, uso irregular; 2- Sim, uso regular; 99- Ignorado
Está em uso de antiagregante plaquetário (AAS, Somalgim, Bufferinm, Aspirina, Clopidogrel, Prasugrel,
Ticagrelor, Ticlopidina)
0- Não; 1- Sim, uso irregular; 2- Sim, uso regular; 99- Ignorado
Está em uso de anticoncepcional
0- Não; 1- Sim, uso irregular; 2- Sim, uso regular; 99- Ignorado
Está em uso de hormônios ou antagonistas hormonais para o tratamento oncológico (tamofixeno,
anastrozol, leuprorrelina, bicalutamida,...)
0- Não; 1- Sim, uso irregular; 2- Sim, uso regular; 99- Ignorado
Está em uso de estatina (Sinvastatina, Atorvastatina, Pravastatina, Rosuvastatina)?
0- Não; 1- Sim, uso irregular; 2- Sim, uso regular há menos de 60 dias;
3- Sim, uso regular há mais de 60 dias; 99- Ignorado
Está em uso de Ginko biloba (Ginsen)?
0- Não; 1- Sim
41
42
43
44
45
46
47
48
49
50
51
52
53
54
55
56
57
83
Anexo 4
Perfil bioquímico e características clínicas dos pacientes com
suspeita de trombose venosa profunda e tromboembolismo
pulmonar tratados no Hospital de Câncer
P.I. Lúcio Flávio B. Fernandes
Coleta dos exames a serem encaminhado para USP-São Paulo
Será coletado:
- 03 tubos de Citrato de sódio (para PALASMA - tampa azul) e
- 02 tubos com gel separador (para SORO - tampa amarela)
03 Tubo de citrato (dímero-D, atividade do fator Xativado e Fibrinogênio):Colher
4,5ml se sangue total em tubo de citrato de sódio Vacutainer®Buff. Na Citrate (9NC).
Centrifugar a 4°C, 3.500rpm por 10 minutos. Separar no mínimo 1,5mlde plasma
sobrenadante em outro tubo (criotubo). Centrifugar o plasma sobrenadante do criotubo nas
mesmas condições. Retirar no mínimo 1ml do sobrenadante e congelar à - 80°C.
Importante: o material depositado no fundo do tubo de citrato após a centrifugação deve ser
desprezado! Ao final deste processo, para cada tubo de citrato, deverá ser extraído no
mínimo 1,0ml de plasma pobre em plaquetas para o congelamento em tubos individuais.
02 Tubos com gel separador (P-Selectina, Interleucina-6, Fator de Necrose
Tumoral-Alfa e Proteína C Reativa Ultrassensível):Colher5,0ml de sangue total em
tubo BD Vacutainer® SST™ II Advance Ref 367955, aguardar 30 minutos para a formação
do coágulo. Centrifugar a 4°C, 3.500rpm por 10 minutos. Cada tubo coletado deverá
proporcionar 2ml de alíquota de soro que serão colocadas em 2 amostras de 2ml cada e
congeladas à -80°C.
Importante:
Os tubos de Citrato devem ser centrifugados 2 vezes!
Conferir o RH do paciente com as alíquotas de amostras;
Mapa das amostras: preencher com o RH, tipo da amostra (soro ou plasma);
Armazenar todas as amostras em freezer -80°C de acordo com a localização preenchida no
mapa impresso;
No máximo em 3 meses, as amostras deverão ser encaminhadas para o laboratório central
da USP-São Paulo aos cuidados da Dra. Célia.
O transporte será realizado pelo pesquisador principal, estando as amostras acondicionadas
em caixa com gelo seco.
84
Anexo 5
85
Anexo 6
Frequência de pacientes classificados pelo código internacional de doenças (CID)
CID
C50
C53
C34
C20
C61
C16
C25
C71
C54
C49
C18
C43
C48
C64
C82
C19
C81
C67
C80
C90
C21
C38
C41
C56
C60
C91
C92
C15
C17
C23
C00
C10
C11
C12
C18
C22
C24
C51
C62
C66
C69
C72
C73
C77
D04
Neoplasia maligna de mama
Neoplasia maligna de colo de útero
Neoplasia maligna dos brônquios e pulmões
Neoplasia maligna de reto
Neoplasia maligna de próstata
Neoplasia maligna do estômago
Neoplasia maligna de pâncreas
Neoplasia maligna de encéfalo
Neoplasia maligna do corpo do útero
Sarcoma
Neoplasia maligna de cólon
Neoplasia maligna de pele – melanoma
Neoplasia maligna de retroperitônio e peritônio
Neoplasia maligna de rim, exceto pelve renal
Linfoma não-Hodgkin
Neoplasia maligna de retossigmóide
Doença de Hodgkin
Neoplasia maligna de bexiga
Neoplasia maligna sem especificação de localização
Mieloma múltiplo
Neoplasia maligna do canal do ânus
Neoplasia de pleura
Osteossarcoma
Neoplasia maligna de ovário
Neoplasia maligna de pênis
Leucemia linfocítica
Leucemia mieloide
Neoplasia maligna de esôfago
Neoplasia maligna de intestino delgado
Neoplasia maligna de vesícula biliar
Neoplasia maligna de lábio
Neoplasia maligna de orofaringe
Neoplasia maligna de nasofaringe
Neoplasia maligna de sio piriforme
Neoplasia maligna de seio piriforme
Neoplasia maligna de fígado
Neoplasia maligna das vias biliares
Neoplasia maligna da vulva
Neoplasia maligna de testículo
Neoplasia maligna de ureter
Neoplasia maligna de olho
Neoplasia maligna de medula espinhal, dos nervos cranianos e de
outras partes do sistema nervoso central
Neoplasia maligna de tireoide
Neoplasia maligna de maligna secundária e não especificada dos
gânglios linfáticos
Carcinoma in situ de pele
Total
Frequência
49
34
20
17
16
13
13
13
12
10
8
7
2
7
10
6
6
4
4
4
3
3
3
3
3
3
3
2
2
2
1
1
1
1
1
1
1
1
1
1
1
%
16,5
11,4
6,7
5,7
5,4
4,4
4,4
4,4
4,0
3,4
2,7
2,4
0,7
2,4
3,4
2,0
2,0
1,3
1,3
1,3
1,0
1,0
1,0
1,0
1,0
1,0
1,0
0,7
0,7
0,7
0,3
0,3
0,3
0,3
0,3
0,3
0,3
0,3
0,3
0,3
0,3
1
0,3
1
0,3
1
0,3
1
297
0,3
100,0
86
Anexo 7
Classificação da Eastern Cooperative Oncology Group (ECOG)
Grau
0
1
2
3
4
5
Definição
Completamente ativo
Restrição à atividade física rigorosas
Capaz de realizar o auto-cuidado, mas incapaz de realizar
qualquer atividade de trabalho
Capaz de realizar somente auto-cuidado limitado
Completamente incapaz de realizar qualquer auto-cuidado
básico
Óbito
87
Anexo 8
Classificação do Índice de Massa Corporal (IMC)117, 118
Classificação
Baixo Peso
IMC
<18,5
Normal
>18,5 <25
Sobrepeso
>25 e <30
Obesidade Grau I
>30 e <35
Obesidade Grau II
>35 <40
Obesidade mórbida
>40
88
Anexo 9
89
ANEXO 10