Os "Nols" em: oxidação de álcoois
Experimento cadastrado por Daniela Buccini em 26/05/2012
Classificação
•••••
(baseado em 4 avaliações)
Total de exibições: 993 (até 18/04/2013)
Palavras-chave: química orgânica, álcoois, reações de
oxidação, dicromato de potássio
Onde encontrar o material?
em laboratórios e lojas especializadas
Quanto custa o material?
acima de 25 reais
Tempo de apresentação
até 10 minutos
Dificuldade
intermediário
Segurança
requer cuidados básicos
Introdução
Você sabia que álcoois diferentes reagem de formas diferentes? Neste experimento vamos observar as diferenças de
reatividade de diferentes álcoois.
Materiais utilizados
Materiais necessários
3 tubos de ensaio
3 conta-gotas
Butan-1-ol
Iso-propanol
Terc-butanol
1,4 g de dicromato de potássio
6,5 g de ácido sulfúrico concentrado
14 mL de água destilada
Passo 1
Mãos à obra
Adicione 1,4 g de dicromato de potássio em 14 mL de água destilada. Agite. Adicione aos poucos 7 mL de ácido sulfúrico
concentrado.
CUIDADO: adicione o ácido aos poucos sobre a água, agitando sempre. NUNCA adicione a água sobre o ácido sulfúrico. A
dissolução é muito exotérmica e deve ser realizada com cuidado.
Observações de segurança: O dicromato de potássio é um produto fortemente oxidante e corrosivo e suspeito de causar
© 2013 pontociência / www.pontociencia.org.br
1
Os "Nols" em: oxidação de álcoois
câncer. O ácido sulfúrico é corrosivo e pode causar queimaduras graves. Evite o contato com a pele. Ao realizar o experimento
utilize luvas e óculos de segurança.
Adicionando dicromato de potássio
Adicionando água
Adicionando ácido sulfúrico
Passo 2
Mãos á obra
Separe 3 tubos de ensaio e adicione 2 mL da solução de dicromato preparada em cada tubo. Numere de 1 a 3. Siga os
seguintes passos:
Tubo 1 – Adicione 10 gotas de butan-1-ol
Tubo 2 – Adicione 10 gotas de iso-propanol
Tubo 3 – Adicione 10 gotas de terc-butanol
Observe o que ocorre em cada um dos casos.
Atenção: os álcoois são inflamáveis. Certifique-se de que não existem chamas na proximidade da área de trabalho.
Reação do butan-1-ol
Reação do iso-propanol
Reação do terc-butanol
Passo 3
O que acontece
Você pode observar que ao adicionarmos a solução de dicromato de potássio (K2Cr2O7) em meio ácido aos diferentes álcoois
© 2013 pontociência / www.pontociencia.org.br
2
Os "Nols" em: oxidação de álcoois
obtemos diferentes resultados. Quando adicionamos ao butan-1-ol e ao iso-propanol (ou propan-2-ol), a solução de dicromato,
que antes era alaranjada, passou a ter uma coloração verde escura. Já com o terc-butanol (ou 2-metil-propan-2-ol) não
observamos mudança aparente. Observamos também que a reação com o butan-1-ol ocorreu bem mais rapidamente que a
com iso-propanol.
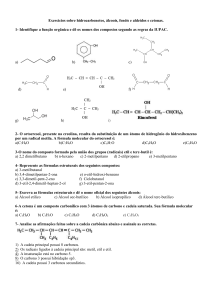
Para entender essas diferenças no comportamento dos álcoois precisamos entender a diferença estrutural que existe entre
eles. Observe a figura 1 e compare as estruturas dos álcoois. Perceba que no butan-1-ol, o grupo hidroxila (OH) está ligado a
um carbono primário, isto é, um carbono que está ligado a somente um outro carbono. Já no iso-propanol há um carbono
secundário, isto é, um carbono que está ligado a outros dois carbonos. E no terc-butanol o grupo OH está ligado a um carbono
terciário, que é como chamamos um carbono que está ligado a outros três carbonos.
Estas diferenças mostradas acima fazem com que estes álcoois tenham reatividades diferentes frente à solução de dicromato
de potássio em meio ácido, que é um poderoso oxidante.
Observe a figura 2, nela está representada a reação do butan-1-ol. Neste processo é formado um aldeído que, se for
novamente oxidado, forma um ácido carboxílico.
Já na figura 3, temos representada a reação do iso-propanol. A oxidação de um álcool secundário forma uma cetona.
No caso de um ácool terciário, como o terc-butanol, não ocorre reação. Observe isso na figura 4. Não é possível formar uma
ligação dupla com o oxigênio nesse caso pois para isso o carbono teria de formar 5 ligações: duas com o oxigênio além das
três que já fazia com os outros átomos de carbono.
Nas reações com o butan-1-ol e com iso-butanol ocorre a redução do átomo de cromo no seu estado de oxidação +6 (Cr6+)
para o seu estado de oxidação +3 (Cr3+), o que justifica a mudança de cor de alaranjado (característica do íon dicromato,
Cr2O72-, no qual o cromo se encontra como Cr6+) para verde (característica do íon Cr3+). Esta reação não ocorre com o
terc-butanol.
Figura 3 - Oxidação do iso-propanol
Figura 2 - Oxidação do butan-1-ol
Figura 1 - Comparação entre álcoois
Figura 4 - Oxidação do terc-butanol
Comparação das reações
Clique para assistir ao vídeo
http://www.youtube.com/watch?v=LGRfSlRKpNk
© 2013 pontociência / www.pontociencia.org.br
Powered by TCPDF (www.tcpdf.org)
3