Colégio Ressurreição Nossa Senhora
3º ano do Ensino Médio
Química Orgânica – 2º Bimestre
Profº. Enio S. Santos
Nome: ___________________________________ nº: ______
PROPRIEDADES DOS COMPOSTOS ORGÂNICOS
As propriedades físicas dos compostos orgânicos estão relacionadas (e são determinadas) por suas estruturas. O tipo de cadeia
carbônica, as ramificações, a natureza das ligações, o número de ligações, enfim, a disposição dos átomos na molécula determinam as
interações moleculares que influenciarão no ponto de fusão, no ponto de ebulição, na solubilidade e na densidade dos compostos
orgânicos.
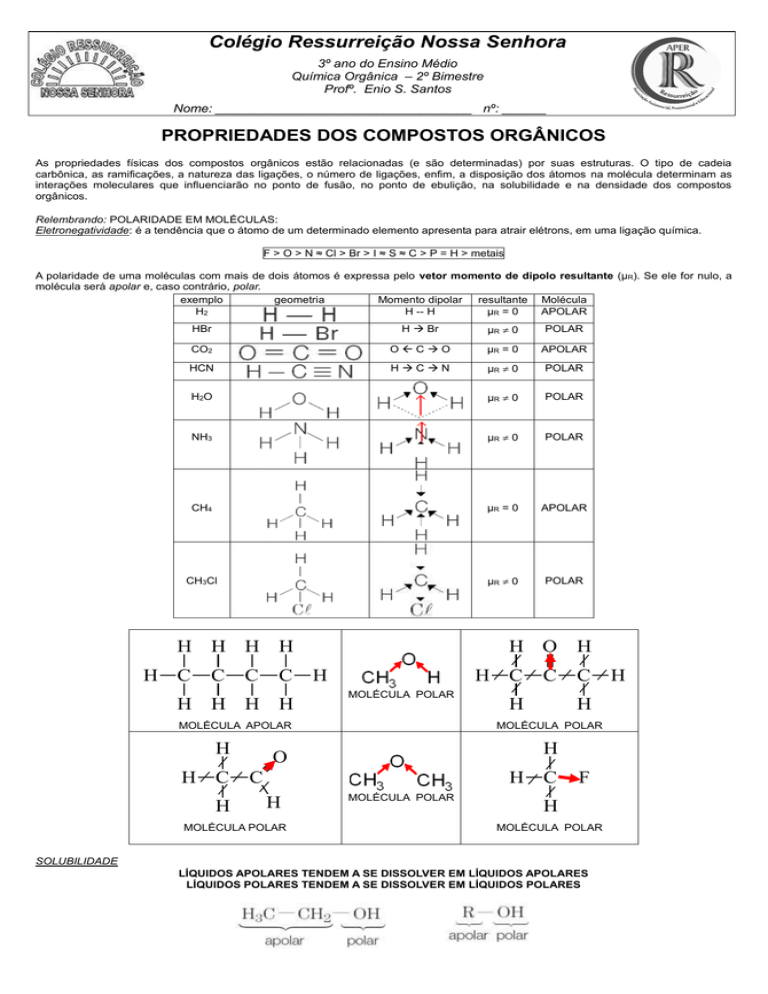
Relembrando: POLARIDADE EM MOLÉCULAS:
Eletronegatividade: é a tendência que o átomo de um determinado elemento apresenta para atrair elétrons, em uma ligação química.
F > O > N ≈ Cl > Br > I ≈ S ≈ C > P = H > metais
A polaridade de uma moléculas com mais de dois átomos é expressa pelo vetor momento de dipolo resultante (μR). Se ele for nulo, a
molécula será apolar e, caso contrário, polar.
exemplo
geometria
Momento dipolar resultante Molécula
H2
H -- H
μR = 0
APOLAR
HBr
H Br
μR 0
POLAR
CO2
OCO
μR = 0
APOLAR
HCN
HCN
μR 0
POLAR
H2O
μR 0
POLAR
NH3
μR 0
POLAR
CH4
μR = 0
APOLAR
CH3Cl
μR 0
POLAR
H H H H
H O H
H C C C C H
H H H H
MOLÉCULA POLAR
MOLÉCULA APOLAR
H
H C
H
H C
C C
H
H
MOLÉCULA POLAR
H
O
C
H C
H
MOLÉCULA POLAR
MOLÉCULA POLAR
F
H
MOLÉCULA POLAR
SOLUBILIDADE
LÍQUIDOS APOLARES TENDEM A SE DISSOLVER EM LÍQUIDOS APOLARES
LÍQUIDOS POLARES TENDEM A SE DISSOLVER EM LÍQUIDOS POLARES
H
INTERAÇÕES INTERMOLECULARES:
GÁS
Propriedades
Volume variável
macroscópicas
Forma variável
Modelo microscópico
das moléculas
Atração que mantém
as moléculas unidas
Espaço
entre
as
moléculas
Organização
das
moléculas
LÍQUIDO
Volume fixo
Forma variável
SÓLIDO
Volume fixo
Forma fixo
Muitíssimo fraca
forte
Mais forte que no líquido
Muito grande
pequeno
Em geral, menor do que no líquido
Total desordem, com
movimento caótico entre
as moléculas
Cada molécula está livre para se
movimentar, mas sempre sob a
influência das moléculas vizinhas
As moléculas estão relativamente “presas”
em suas posições, formando um retículo
cristalino molecular.
1) Interação dipolo permanente-dipolo permanente (dipolo-dipolo)
Ocorre entre moléculas polares, onde a extremidade negativa atrai de uma molécula a extremidade positiva de outra molécula.
2) Ligações Hidrogênio (pontes de hidrogênio)
São interações que ocorrem tipicamente entre moléculas que apresentam átomo de H ligado a F, O e N. Trata-se de uma interação mais
forte que a dipolo-dipolo.
CH3 O
H
H
O CH3
3) Interação Dipolo instantâneo-dipolo induzido (dipolo induzido-dipolo induzido)
Ocorre entre moléculas apolares onde a aproximação de duas moléculas cria uma região positiva em uma das moléculas e um pólo
negativa em outra molécula. Esta atração ocorre em frações de segundos e por isso é extremamente fraca.
QUANTO MAIOR FOR O TAMANHO DA MOLÉCULA,
MENOR SERÁ A SUA SOLUBILIDADE EM ÁGUA.
ÁLCOOL
CH3OH
CH3CH2OH
CH3CH2CH2OH
CH3CH2CH2CH2OH
CH3CH2CH2CH2CH2OH
CH3CH2CH2CH2CH2CH2OH
Solubilidade em água (g/100g de H2O)
ilimitada
ilimitada
ilimitada
8,0
2,2
0,6
QUANTO MAIOR FOR O TAMANHO DA MOLÉCULA,
MAIOR SERÁ A SUA TEMPERATURA DE EBULIÇÃO.
TE (ºC)
METANO
-188
ETANO
-88,4
PROPANO
-42,5
METANAL
-19
ETANAL
20
PROPANAL
48,8
METANOL
64,5
QUANTO MAIOR FOR A CADEIA PRINCIPAL DA MOLÉCULA,
ETANOL
78,3
PROPAN-1-OL
97,2
MAIOR SERÁ A SUA TEMPERATURA DE EBULIÇÃO.
Ex:
substância
Dimetil-propano
Metil-butano
pentano
massa molecular (u)
72
72
72
PE (ºC)
9
28
36
CH3
CH3
C CH3
CH3
CH3
CH2 CH2 CH2 CH3
CH3
CH2 CH2 CH2 CH3
CH3
CH3
C CH3
CH3
Quando uma substância molecular passa do estado líquido para o estado gasoso (ou sólido) ocorre o rompimento de ligações
intermoleculares. Por isso, QUANTO MAIOR A FORÇA DE ATRAÇÃO, MAIOR SERÁ O PONTO DE EBULIÇÃO.
Ex:
substância massa molecular (u)
interação
PE (ºC)
propano
44
dipolo induzido-dipolo induzido
-42
etoxi-etano
46
dipolo-dipolo
-25
etanol
46
ligação hidrogênio
78
butano
58
dipolo induzido-dipolo induzido
-1
trimetilamina
59
dipolo-dipolo
3
propilamina
59
ligação hidrogênio
47
Compostos orgânicos de massas molares aproximadas geralmente apresentam a seguinte seqüência decrescente de ponto de ebulição:
AMIDA > ÁCIDO CARBOXÍLICO > CETONA > ALDEÍDO > AMINA > HALETO > ÉTER > HIDROCARBONETO.
Propriedades específicas das funções:
HIDROCARBONETOS: As propriedades físicas de alcanos, alcenos, alcinos, alcadienos e cicloalcanos são essencialmente as mesmas.
Os quatro primeiros compostos de cada subfunção são gases incolores, enquanto os representantes de massas molares mais elevadas
são líquidos (5 a 17 carbonos) e sólidos (mais de 17 carbonos) – as temperaturas de ebulição aumentam com o aumento do número de
carbonos.. São compostos apolares, sendo insolúveis em água e bastante solúveis em solventes apolares. São menos densos que a
água.
Os hidrocarbonetos aromáticos também são compostos apolares, insolúveis em água e as temperaturas de ebulição aumentam com o
aumento do número de carbonos.
ALCOÓIS: apresentam temperaturas de ebulição maiores que os alcanos de massas moleculares correspondentes por causa das
ligações hidrogênio, que é mais forte que as interações dipolo induzido-dipolo induzido dos alcanos. Também por isso, são solúveis em
água, sendo os alcoóis pequenos totalmente solúveis e à medida que a cadeia carbônica aumenta (aumentando também a parte apolar da
molécula) diminui a solubilidade.
Alcoóis com duas ou mais hidroxilas (glicóis) são mais polares do que os monoalcoóis, por aumentar o número de ligações hidrogênio na
molécula. Por isso tem maior ponto de fusão, maior ponto de ebulição e maior densidade.
FENÓIS: São sólidos de baixo ponto de fusão ou líquidos de alto ponto de ebulição (por causa das ligações hidrogênio). O fenol é pouco
solúvel em água e, normalmente os outros fenóis são insolúveis neste solvente (longas cadeias carbônicas).
ÉTERES: as TE dos éteres são mais baixas que as dos alcanos correspondentes e mais baixas que as dos alcoóis de massas
moleculares correspondentes. Suas interações intermoleculares são do tipo dipolo-dipolo, que são mais fortes do que as dipolo induzidodipolo induzido, e mais fracas que as ligações hidrogênio. São ligeiramente solúveis em água e isso se deve à formação de ligações
hidrogênio entre o oxigênio do éter e o hidrogênio da água.
ALDEÍDOS E CETONAS: são compostos polares com PE maiores que os hidrocarbonetos e menores que os alcoóis de massas
moleculares correspondentes. Suas interações intermoleculares são tipo dipolo-dipolo. Compostos com menos de cinco átomos de
carbono são solúveis em água, por causa das ligações hidrogênio entre o oxigênio do aldeído (ou da cetona) e o hidrogênio da água. A
medida que aumenta a cadeia carbônica, diminui a solubilidade.
ÁCIDOS CARBOXÍLICOS (e seus derivados): as ligações hidrogênio entre as moléculas dos ácidos (devido ao grupo carboxila COOH),
determinam grande solubilidade em água para os quatro menores ácidos e temperaturas de ebulição relativamente altas quando
comparadas com outros compostos de massas moleculares correspondentes.
Os derivados dos ácidos são compostos polares por causa da carbonila. Ésteres, cloretos de acila e anidridos possuem PE quase que
iguais aos aldeídos e cetonas de massas molares correspondentes. Já as amidas, por apresentarem ligações hidrogênio, tem
temperaturas de ebulição maiores, mas menores quando comparadas aos ácidos carboxílicos correspondentes.
AMINAS: as aminas primárias e secundárias apresentam, entre suas moléculas, ligações hidrogênio, porém mais fracas do que as
verificadas no alcoóis de massas moleculares correspondentes. Isto se explica pela menor eletronegatividade do nitrogênio em relação ao
oxigênio. Por exemplo, a metilamina (MM = 31g/mol) tem PE = -6ºC, enquanto o metanol (MM = 32g/mol) possui PE = 65ºC. Aminas de
baixa massa molecular são gases e têm odores semelhantes ao da amônia. São muito solúveis em água.
Já as aminas terciárias, por não ter hidrogênio ligado diretamente ao nitrogênio, têm características semelhantes aos éteres.
HALETOS ORGÂNICOS: os PE dos haletos são geralmente maiores que hidrocarbonetos que lhes deram origem, aumentando com o
aumento da massa molar do halogênio para haletos correspondentes. São compostos ligeiramente polares, porém insolúveis em água
(por não formarem ligações hidrogênio), mas solúveis em solventes orgânicos.
ACIDEZ E BASICIDADE DOS COMPOSTOS ORGÂNICOS
1) Caráter ácido
A força de um ácido é expressa em função da sua constante de acidez (Ka): quanto maior Ka, mais forte será o ácido. De um modo
geral, podemos dizer que a ordem decrescente de acidez dos compostos orgânicos é a seguinte:
ácidos carboxílicos
fenóis
água
alcoóis
alcinos verdadeiros
Ka 10-5
Ka 10-10
Ka 10-14
Ka 10-18
Ka 10-25
Quando a cadeia carbônica apresenta grupos elétron-atraente (Cl, F, Br, I, NO2, CN, COOH, COCH3) ( halogênios e radicais com
insaturações: duplas, triplas ou dativas), ocorre um efeito indutivo negativo (I-) que facilita a ionização do hidrogênio. Ex:
H
H C
C
C
Ka =
H C
OH
H
1,8.10-5
Cl
O
H C
OH
H
Ka =
Cl
O
O
C
OH
Cl
1,4.10-3
Ka = 2,2.10-1
Mas se o grupo for elétron-repelente (CH3, CH3CH2, NH2, OH, OCH3) ( ramificações sem insaturações: apenas ligações simples),
responsáveis pelo efeito indutivo positivo (I+), o ácido se torna mais fraco. Ex:
H
O
H C
H C
OH
Ka =
C
H
17,5.10-5
Ka =
H H
O
O
H C C C
OH
OH
H H
1,8.10-5
Ka =
1,3.10-5
Outra análise pode ser feita pela proximidade do grupo elétron-atraente ou elétron-repelente do grupo carboxila. Quanto mais próximo da
carboxila, maior o efeito indutivo, seja ele positivo ou negativo. Ex:
H H H
O
H C C C C
OH
H H Cl
>
H H H
O
H C C C C
H Cl H
OH
>
H H H
NO2
Cl H H
OH
NH2
COOH
COOH
COOH
O
H C C C C
>
COOH
>
COOH
HOOC
>
COOH
>
HOOC
COOH
2) Caráter básico:
Observação: De acordo com o conceito ácido-base dado por Brönsted-Lowry: ácido – substância que liberta íon H+; base – substância que
recebe íon H+.
As bases orgânicas mais importantes são as aminas, tendo as aminas não-aromáticas um caráter básico mais acentuado do que a
amônia.
Os grupos elétron-repelentes (CH3, CH3CH2, NH2, OH, OCH3), aumentam a força da amina e os grupos elétron-atraentes (halogênios e
radicais com duplas, triplas e ligações dativas) diminuem o seu caráter básico. Ex:
composto NH3 CH3NH2 CH3CH2NH2 CH3NHCH3
pKb
4,7
3,4
3,3
3,2
Quanto menor o pKb, maior o Kb, maior a basicidade do composto.
Os éteres também apresentam um certo caráter básico, mas menos intenso do que as aminas.
======================================================================================================
Questões:
1) (FUVEST) Os pontos de ebulição, sob pressão de 1 atm, da propanona, butanona, pentan-3-ona e hexan-3-ona são, respectivamente,
56, 80, 101 e 124ºC.
a) escreva as fórmulas estruturais destas substâncias
b) estabeleça uma relação entre as estruturas e os pontos de ebulição.
2) (Unicamp) Na produção industrial de panetones, junta-se à massa o aditivo químico U.I. Esse aditivo é a
glicerina, que age como umectante, ou seja, retém a umidade para que a massa não se resseque demais. A
fórmula estrutural da glicerina (propanotril) é:
a) represente as ligações entre as moléculas de água e de glicerina
b) por que, ao esquentar uma fatia de panetone ressecado, ela amolece, ficando mais macia?
H H H
H C C C H
O O O
H H H
3) (PUC-RS) Relacionando-se a coluna da esquerda, que apresenta nomes de álcoois, com a coluna da direita, que apresenta pontos de
ebulição
1. etanol
a. 65ºC
2. butan-1-ol
b. 78ºC
3. propan-1-ol
c. 97ºC
4. metanol
d. 118ºC
Obtém-se como associação correta a alternativa:
a) a, 2.b, 3.c, 4.d
b) 1.b, 2.a, 3.c, 4.d
c) 1.d, 2.c, 3.b, 4.a
d) 1.b, 2.d, 3.c, 4.a
e) 1.a, 2,d, 3.c, 4.b
4) (UFU) Nas condições ambientes, a substância líquida volátil, combustível, que dissolve bem parafina, imiscível com a água, deve ser:
a) etano
b) heptano
c) etanol
d) C60H122
e) metanol
5) (FUVEST) Em um laboratório, três frascos com líquidos incolores estão sem os devidos rótulos. Ao lado deles, estão os três rótulos com
as seguintes identificações: ácido etanóico, pentano e butan-1-ol. Para poder rotular corretamente os frascos, determinou-se, para esses
líquidos, o ponto de ebulição, sob 1 atm e a solubilidade em água, a 25ºC.
líquido PE (ºC) Solubilidade (g/100g H2O)
X
36
0,035
Y
117
7,3
Z
118
infinita
Com base nessas propriedades, conclui-se que os líquidos X, Y e Z são, respectivamente:
a) pentano, butan-1-ol, ácido etanóico
b) pentano, ácido etanóico, butan-1-ol
c) ácido etanóico, pentano, butan-1-ol
d) butan-1-ol, ácido etanóico, pentano
e) butan-1-ol, pentano, ácido etanóico
6) (FUVEST) Em uma tabela de propriedades físicas de compostos orgânicos, foram encontrados os dados abaixo para compostos de
cadeia linear I, II, III e IV. Esses compostos são etanol, heptano, hexano e propan-1-ol, não necessariamente nesse ordem.
composto PE (ºC) Solubilidade em água
I
69,0
insolúvel
II
78,5
infinita
III
97,4
infinita
IV
98,4
insolúvel
Os compostos I, II, III e IV são, respectivamente:
a) etanol, heptano, hexano, propan-1-ol
b) heptano, etanol, propan-1-ol, hexano
c) propan-1-ol, etanol, heptano, hexano
d) hexano, etanol, propan-1-ol, heptano
e) hexano, propan-1-ol, etanol, heptano
7) (UFC-CE) A atividade bactericida de determinados compostos fenólicos deve-se em parte, à atuação desses compostos como
detergentes, que solubilizam e destroem a membrana celular fosfolipídica das bactérias. Quanto menor for a solubilidade dos compostos
fenólicos em água, maior será a ação anti-séptica.
Com relação às solubilidades dos compostos fenólicos I, II e III, em água, identifique a opção correta, quanto a ordem de solubilidade.
OH
OH
OH
CH3
CH
CH3
I
a) I > II > III
b)
I < II < III
II
c) II < I < III
8) (UFMG) A figura que melhor representa a evaporação do metanol é:
CH3
CH3
III
d)
II > I > III
e)
I = II = III
9) (PUC-PR) À temperatura ambiente, o éter etílico evapora mais rapidamente que o álcool etílico. Sendo assim, pode-se concluir que, em
relação ao álcool, o éter apresenta:
a) maior ponto de ebulição
d) ligações intermoleculares mais fracas
b) menor pressão de vapor
e) maior número de ligações hidrogênio
c) menor peso molecular
10) (UFMG) A alternativa que apresenta a substância com maior ponto de ebulição é:
a) butan-1-ol
b) pentan-2-ona
c) metóxi-propano
d) pentano
e) butanal
11) (PAIES-1999) Na figura abaixo encontram-se representantes de várias funções químicas.
Assinale com (V) a(s) alternativa(s) verdadeira(s) e com (F) a(s) falsa(s).
1( )
Os nomes dos compostos 1, 2, 3, 4 e 5 são metano, metanol, formaldeído, ácido fórmico e ácido difórmico, respectivamente.
2( )
O constituinte principal do gás natural é o metano.
3( )
Dos compostos considerados, o que forma mais ponte de hidrogênio é o metano.
4( )
O ponto de ebulição do metanol é maior que o do formaldeído.
5( )
Os compostos 2, 4 e 5 liberam H+ em solução aquosa.
12) (PAIES-1999) Ácidos carboxílicos e ésteres são duas funções orgânicas muito importantes por sua forte presença nos reinos vegetal e
animal.
Comparando-se ésteres com ácidos carboxílicos, assinale com (V) a(s) alternativa(s) verdadeira(s) e com (F) a(s) falsa(s).
1( ) Ésteres podem ser obtidos a partir de reações de ácidos carboxílicos e álcoois.
2( ) Se as massas moleculares forem semelhantes, pode-se afirmar que o éster tem ponto de ebulição menor do que o do ácido
carboxílico.
3( ) Ésteres são menos solúveis em água do que ácidos carboxílicos.
4( ) Ácidos carboxílicos, assim como ésteres, são responsáveis pelo aroma de muitas frutas.
5( ) As gorduras e os óleos são ésteres formados a partir de ácidos graxos e glicerol (1,2,3-propanotriol).
13) (UFU-2000) O inseticida Baygon® apresenta a seguinte fórmula estrutural:
Com referência a esse composto pode-se afirmar que
A) todos os átomos de carbono apresentam geometria trigonal-plana.
B) possui um grupo isopropila em sua estrutura.
C) não forma interações intermoleculares do tipo "ponte de hidrogênio".
D) possui um grupo n-propila em sua estrutura.
14) (UFU-2000) Dados os seguintes compostos orgânicos derivados da amônia. A metilamina e a dimetilamina são gases provenientes da
decomposição de certas proteínas e são responsáveis pelo desagradável cheiro de peixe podre. A fenilamina ou anilina é uma am ina
aromática largamente empregada na síntese de corantes e medicamentos.
Pede-se:
A) Explique porque esses compostos são denominados bases orgânicas.
B) Dê a ordem de basicidade dos compostos acima.
15) (PAIES-2000) Os compostos representados abaixo são
exemplos de anestésicos locais. Quando aplicados, eles
insensibilizam uma região, eliminando a sensação dolorosa.
Assinale para cada afirmação abaixo (V) verdadeira ou (F) falsa.
1(
2(
3(
4(
5(
)
)
)
)
)
A fórmula molecular do eugenol é C10H9O2.
Os três compostos acima são exemplos de cadeia mista.
Somente a xilocaína apresenta um heteroátomo em sua cadeia carbônica.
Na benzocaína encontra-se a função orgânica cetona.
As moléculas de benzocaína não apresentam ligações de hidrogênio.
16) (PAIES-2001) A hidrocortisona é um corticóide que possui rápida ação antiinflamatória, sendo
bastante indicada no tratamento das afecções de uso tópico.
Em relação à hidrocortisona e sua respectiva estrutura, assinale com (V) a(s) alternativa(s)
verdadeira(s) e com (F) a(s) falsa(s).
1( ) A fórmula molecular da hidrocortisona é C19H5O5.
2( ) As funções orgânicas álcool e cetona estão presentes na estrutura da hidrocortisona.
3( ) A hidrocortisona possui um grupo aromático em sua estrutura.
4( ) A hidrocortisona pode formar pontes de hidrogênio com a água.
5( ) Todos os grupos OH presentes na estrutura da hidrocortisona correspondem a álcoois
secundários.
17) (UFU-2001) Analise os compostos abaixo e assinale a alternativa que os dispõe em ordem decrescente de pontos de
ebulição.
I- CH3CH2CHO
II- CH3COOH
III- CH3CH2CH2OH
IV- CH3CH2CH2CH3
A) II, III, I, IV.
B) IV, II, III, I.
C) I, II, IV, III.
D) II, IV, III, I.
18) (UFU/2002) O metóxi-benzeno é um isômero funcional do 1−hidroxi−4−metil−benzeno. Com relação a estes dois compostos,
responda: Qual apresentará o menor ponto de ebulição? Explique a sua resposta, mostrando a fórmula estrutural do composto escolhido.
19) (UFU/2002) As aminas caracterizam-se por sua basicidade e natureza nucleofílica. Em relação às aminas, responda:
A) Qual é a origem da basicidade das aminas?
B) Quais são as fórmulas estruturais da trimetilamina e do ácido etanóico?
C) Qual é a equação química balanceada representativa da reação da trimetilamina com ácido etanóico?
20) (UFU/2002) A penicilina V, um antibiótico potente, possui a seguinte fórmula
estrutural plana.
Com referência a esse composto, apresentado acima, o hidrogênio mais ácido
assinalado na estrutura é
A) IV
B) II
C) III
D) I
21) (UFU/2004) Muitas propriedades físicas das substâncias, entre elas a solubilidade, podem ser explicadas a partir da polaridade de
suas moléculas. Sabendo-se que “semelhante dissolve semelhante”, considere as substâncias amônia, água e metano e responda:
a) qual a polaridade dessas moléculas? Justifique sua resposta com base na geometria molecular.
b) Qual substância será mais solúvel em água com base nos dipolos criados? Justifique sua resposta.
22) (UFU/2004) Solvente é um líquido capaz de dissolver um grande número de substâncias. Muitas indústrias que empregam o benzeno
como solvente têm substituído esta substância pelo cicloexano, um hidrocarboneto bem menos agressivo. Considerando as características
gerais de solventes, explique por que os líquidos H2O e C6H12 são imiscíveis entre si.
23) (UFU/2005) O metanol, embora seja muito utilizado industrialmente e como combustível, é o mais tóxico dos álcoois. A principal
interação intermolecular presente neste líquido é a ligação de hidrogênio. Qual figura abaixo representa essa interação? Assinale-a.
a)
c)
b)
d)
24) (UFU/2006) O gingerol, cuja estrutura está representada abaixo, é uma substância encontrada no gengibre, responsável pela
sensação ardente quando este é ingerido. Essa substância apresenta propriedades cardiotônicas e antieméticas. É correto afirmar que o
gingerol
A) apresenta fórmula molecular C17H26O4 e caráter ácido pronunciado pela presença do fenol.
B) apresenta fórmula molecular C17H23O4 e é um composto saturado e de cadeia heterogênia.
C) apresenta função mista: cetona, álcool e éster e caráter básico evidente pela presença do anel.
D) é um composto apolar de cadeia aromática, homogênia e mista.
25) (UFU/2006) O ácido vanilmandélico é um produto do metabolismo da adrenalina e outras catecolaminas. A
constatação do excesso deste ácido no organismo pode ser verificada no exame de urina. Este é um diagnóstico
chamado de feocromocitoma (tumor produtor de catecolaminas).
Em relação a este ácido, assinale a alternativa correta.
A) É um composto de cadeia mista, aromática, insaturada e homogênea.
B) A oxidação da OH (do álcool) produz uma carbonila.
C) A ordem de acidez dos grupos ácidos é: −OH (do fenol) <−COOH <−OH (do álcool).
D) É insolúvel em H2O.
26) (PAIES/2006 - discursiva) A adrenalina é liberada pelas glândulas supra-renais em situação de intenso medo ou excitação. A partir da
estrutura da adrenalina mostrada abaixo, pede-se:
A) a fórmula molecular da adrenalina.
B) a hibridização dos átomos de carbono do anel.
C) o número de pontes de hidrogênio na estrutura da adrenalina.
D) a indicação dos hidrogênios mais ácidos, na estrutura da adrenalina, e a justificativa de sua resposta.
27) (UFU-2007) Considere os compostos de I a IV e seus respectivos pKa em
água.
Com relação a esses compostos, é INCORRETO afirmar que
A) II é mais ácido que I.
B) I é menos ácido do que a água.
C) II e III são os compostos de maior acidez.
D) IV é o composto menos ácido entre os demais.
28) (UFU/2008) Observe os compostos orgânicos a seguir.
I -1-butanol
II -2-butanol
III -2-metil-1-propanol
IV -2-metil-2-propanol
A ordem crescente do ponto de ebulição dos respectivos compostos está representada corretamente na alternativa:
A) I, II, IV, III.
B) IV, II, III, I.
C) I, III, IV, II.
D) IV, II, I, III.
Referências Bibliográficas:
PERUZZO, F. M., CANTO, E. L. Química na abordagem do cotidiano, v.3. 3.ed. São Paulo: Moderna. 2003, p. 69-91.
USBERCO, J.; SALVADOR, E. Químca, 5.ed. São Paulo: Saraiva, 2004, p. 543-550.
http://www.ingresso.ufu.br/paies2007/provasgabaritos/provasgabaritos.asp?sub=0&e=0&d=0
http://www.ingresso.ufu.br/Vest20071/provasgabaritos/provasgabaritos.asp
GABARITO – PROPRIEDADES DOS COMPOSTOS ORGÂNICOS
1) a) (fórmulas)
b) quanto maior a quantidade de átomos de carbono na cadeia principal, maior será a temperatura de ebulição.
2) a) (fórmulas)
b) ao aquecer o panetone, rompem-se as ligações hidrogênio entre as moléculas de água e de glicerina, liberando moléculas de
água para o panetone, o que provoca um amolecimento do mesmo.
3) d)
9) d)
4) b)
10) a)
5) a)
11) V V F V F
6) d)
7) a)
12) V V V F V
8) d)
13) b)
14) a) pois são aminas e podem receber H+ quando reagem com ácido
b) dimetilamina > metilamina > fenilamina
15) F V F F F
16) F V F V F
17) a)
18) o metóxi-benzeno apresenta menor ponto de ebulição do que o álcool, porque o álcool apresenta hidroxila que forma
interações muito fortes do tipo ligações hidrogênio.
19) a) as aminas são bases de Brönsted-Lowry, que é a substância que recebe íon H+ (o ácido seria a substância capaz de liberar H+). O par de
elétrons do nitrogênio atrai o íon H+ liberado por uma espécie ácida.
O
CH3 N CH3
CH3
b)
CH3
C
OH
e
H
O
CH3
c)
20) c)
C
OH
+
CH3
N CH3
CH3
CH3
23) d)
N+ CH3
O
+
CH3
CH3
24) a)
25) b)
C
-
O
27) d)
28) b)
21) a) amônia (NH3) e água (H2O) são moléculas polares, já o metano (CH4) é apolar. (representar as moléculas)
b) a amônia, por ser polar será mais solúvel em água por apresentarem polaridades semelhantes.
22) O cicloexano (C6H12) é uma molécula apolar (representar estrutura) e por isso é muito pouco solúvel em água – molécula polar.
26) a) C8H11O3N
b) hibridização do tipo sp2.
c) 5 (3 nas hidroxilas e 2 no grupo amina)
d) os dois hidrogênios dos grupos fenóis (OH ligado diretamente ao anel aromático), pois os fenóis são mais ácidos que os alcoóis.