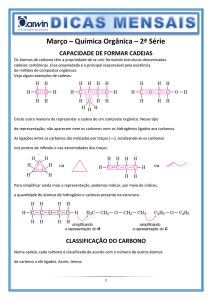
QUÍMICA 1
Resoluções
Capítulo 3
Hibridização do carbono
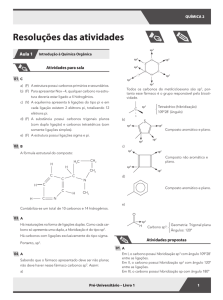
ATIVIDADES PARA SALA
01 C
5
1
2
3
4
Na estrutura do composto, os carbonos 1, 2, 3 e 4 são híbridos sp2, e o carbono 5 é híbrido sp3.
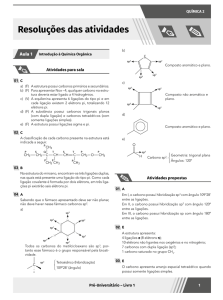
02 A
1
3
2
Após a análise da estrutura da morfina, pode-se concluir que os carbonos 1, 2, e 3 são híbridos sp2, sp3 e sp2, respectivamente.
par de elétrons não ligantes
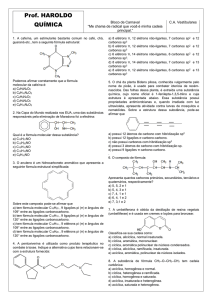
03 E
sp
Ao analisar a estrutura do composto, verifica-se que há:
Ligações pi (π) = 4. Logo, têm-se 8 elétrons pi (π).
π
Elétrons não ligantes = 10
Carbonos híbridos sp2 = 7
π
sp 2
Carbono saturado = 1
sp 2
04
α
2
π
sp
2
sp 2
π
sp 2
sp 3
carbono saturado
sp 2
γ
1
2
3
4
β
a) Na estrutura do composto, os carbonos 1 e 3 são híbridos sp2, o carbono 2 é híbrido sp, e o 4 é híbrido sp3.
b) Os valores correspondentes aos ângulos de ligação α, β e γ são, respectivamente, 120º, 180º e 109º28'.
05
a
α
1
2
b
3
c
d
β
4
5
f
2a série – Ensino Médio – Livro 1
e
7
QUÍMICA 1
a) Na estrutura do composto, o carbono 1 é híbrido sp, o 3 é híbrido sp2, e o 5 é híbrido sp3.
b) Os valores correspondentes aos ângulos de ligação α e β são, respectivamente, 180º e 120º.
c) Ligação sigma b (sp – sp2), ligação sigma c (sp2 – sp2), ligação pi d (p – p), ligação sigma a (s – sp), ligação sigma f (s – sp3) e
ligação sigma e (sp3 – p).
ATIVIDADES PROPOSTAS
01 B
No diamante, os átomos de carbono se encontram hibridizados na forma sp3; já na grafite, encontram-se hibridizados na
forma sp2.
02 B
2
sp 3
3
sp 3
1
sp 2
Carbono sp2 – ângulo de ligação entre os orbitais é 120º.
Carbono sp3 – ângulo de ligação entre os orbitais é 109º28’.
Assim, tem-se: 1 = 120º e 2 = 3 = 109º28’.
03 E
T
sp 3
T
sp 3
Q
T
Q
O
sp 3
sp 3
T
π
sp 3
Q
T
sp 3
T
sp 3
Q
Lanosterol
Após a análise da estrutura do composto, conclui-se o seguinte:
8
π
Carbonos terciários (T) com hibridação sp3: 3
Carbonos quaternários (Q) com hibridação sp3: 4
Ligação pi (π): 2. Logo, há 4 elétrons pi.
2a série – Ensino Médio – Livro 1
QUÍMICA 1
04 E
06 D
sp 2
π
σ
σ
sp 2
σ
sp
σ
π
σ
σ
2
sp 2
π
sp 2
sp
2
σ
π
sp
π
σ sp
π
σ
σ
π
σ sp
sp
π
π
σ sp
sp
σ
sp 3
sp 2
sp 2
sp 2
π
π
elétrons não ligantes
sp 2
π
sp 2
sp 3
Carbonos híbridos sp: 6
Carbono híbrido sp3: 1
Ligação pi (π): 9
Após a análise da estrutura do composto, conclui-se o
seguinte:
a) (F) Possui 6 carbonos com hibridização sp2.
b) (F) Possui 13 ligações sigma (s) carbono-carbono.
c) (F) Possui um carbono híbrido sp3.
d) (F) Possui 6 carbonos com hibridização sp.
e) (V)
σ
sp 3
σ
sp 2
π
σ
σ
σ
σ
sp 2
σ
σ
sp 3
σ
σ
σ
sp 3
σ
π
sp 2
sp 3
σ
sp 2
σ
π
σ
sp 2
sp 2
sp 3
σ
σ
σ
sp 2
π
sp 2
120 º
sp 2
sp 2
π
sp 2
π
sp 2
sp 2
π
sp 2
sp 2
σ
FM = C18H18
σ
sp 3
sp 2
sp 2
π
σ
π
sp 2
sp 2
sp 2
sp 3
sp 3
π
σ
σ
sp 3
sp 3
07 B
π
σ
sp 3
sp 3
sp 3
Após a análise dos carbonos e da estrutura do composto,
conclui-se que este apresenta 4 ligações pi (π), logo, 8 elétrons pi, 14 elétrons não ligantes, 7 carbonos híbridos sp2 e
13 híbridos sp3.
05 D
σ
sp 3
sp 3
sp 2
σ
sp 3
π
sp 3
sp 3
sp 2
Carbonos híbridos sp2: 6
sp 2
Após análise da fórmula estrutural do composto, conclui-
σ
σ
-se o seguinte:
FM = C10H18O
Carbono sp é plano trigonal.
2
Carbono sp3 é tetraédrico.
Após a análise da estrutura do composto, conclui-se:
a) (F) Possui 28 ligações sigma (σ) e 2 pi (π).
b) (F) Sua fórmula molecular é C10H18O.
c) (F) Existem mais carbonos sp3 que sp2.
d) (V)
Sua fórmula molecular é C18H18;
Há 9 ligações pi (π);
Todos os carbonos são híbridos sp2;
Os ângulos de ligação entre os carbonos são de 120°.
08 Após a análise dos carbonos da molécula, conclui-se que
suas hibridizações são as seguintes:
e) (F) Não há carbono híbrido sp.
sp 2
sp
sp 3
sp 2
sp
2a série – Ensino Médio – Livro 1
sp 3
sp 3
sp 3
9
QUÍMICA 1
09 Após a análise da hibridização dos carbonos e das ligações, tem-se:
σ (sp 2 – sp)
σ (sp – sp)
2
σ (s – sp 2)
sp 2
sp
σ (sp – sp)
sp
2
sp
sp
π (p – p)
π (p – p)
σ (sp – s)
π (p – p)
10 Após a análise da hibridização dos carbonos, das ligações
e dos ângulos entre as ligações, tem-se:
σ (sp 3 – sp 2)
sp 3
10
109º28'
sp 2
π (p – p)
120º
180º
sp
sp 2
σ (sp – sp )
2
σ (sp 2 – p)
sp 2
2a série – Ensino Médio – Livro 1